長期口服雙膦酸鹽對PVP術后相鄰椎體骨折的影響及預防
胡日鶴,鐘華,黃艷,朱智敏,崔立興,岑怡彪
(1.清遠市中醫院骨科二區,廣東 清遠 511500;2.湛江中心人民醫院,
隨著人口社會老齡化,越來越多的老年患者身患骨質疏松和胸腰椎椎體壓縮性骨折,嚴重影響老年人的日常生活和生活質量[1]。由于保守治療需要的時間較久,容易合并其他嚴重并發癥,如何快速有效的改善癥狀和解決患者痛苦,是目前臨床亟待解決的難題[2]。
目前,經皮椎體成形術(percutaneous vertebroplasty,PVP)是治療骨質疏松和胸腰椎椎體壓縮性骨折(osteoporotic vertebral compression fracture,OVCF)一種較為普遍的微創手術。手術方式是先從骨折椎體后路進入,直至其后緣,然后將特定的強化材料放入或注射進入病變椎體,并增強椎體的強度和骨穩定性[3]。在此種條件下,PVP可以快速緩解疼痛并增加椎體機械強度。然而,骨折骨質疏松的根本原因尚未解決,仍有骨折風險[4]。本文旨研究雙膦酸鹽聯合鈣片對PVP手術后OVCF患者骨質疏松的治療效果,現報告如下。
1 資料與方法
1.1 一般資料 選取2013年1月至2017年1月我院收治的骨質疏松性椎體壓縮骨折患者120例,其中男39例,女81例;年齡48~79歲,平均(64.00±11.04)歲。共計182個椎體骨折,其中T56個,T65個,T77個,T87個,T108個,T1124個,T1238個,L140個,L220個,L315個,L412個,根據治療方法分為單獨口服鈣片組(A組60例)和雙膦酸鹽加鈣片組(B組60例)。兩組患者性別、年齡、身高、體征、病椎等一般資料比較,具有均衡性(P>0.05)。
1.2 納入排除標準
1.2.1 納入標準 均符合《中國人骨質疏松癥建議診斷標準》(第2稿)中關于骨質疏松的診斷標準;所有患者經骨密度(bone densitometry,BMD)檢查證實為骨質疏松性,經X線或CT檢查證實椎體楔形或雙凹型壓縮性,發生于T5~L5椎體的新鮮(1~3周)壓縮性骨折。
1.2.2 排除標準 椎體爆裂性骨折;有椎管內占位者;脊髓神經損害體征者;合并心、肝、腎疾病以及骨腫瘤、骨軟化癥,影響骨代謝的各種疾病者;不能配合疼痛評估、隨訪、隨訪丟失以及不能行隨訪期間相關檢測患者,長期使用糖皮質激素類藥物者。
1.3 方法 兩組患者入院后立即完善相關檢查,根據需要予以臥床休息、吸氧、鎮靜、ICU監護、等常規治療。PVP手術均由同一組高年資醫師操作,PVP術后在常規治療基礎上,A組患者術后單獨口服鈣片(鈣爾奇)治療,B組患者采用口服雙膦酸鹽(阿侖膦酸鈉片)加鈣片治療。
1.4 檢測方法 雙能X線骨密度儀檢測腰椎和股骨頸骨密度。分別抽取兩組治療前后清晨空腹靜脈血,3 000 r/min離心30 min取血清,置于-80℃冰箱保存待測。β-膠原特殊序列采用酶聯免疫吸附測定(enzyme linked immunosorbent assay,ELISA)方法檢測,嚴格按照試劑盒說明書操作。
1.5 觀察指標 觀察兩組患者治療12、24、48周后視覺模擬評分(visual analogue scale,VAS)、腰椎和股骨頸骨密度水平及β-膠原特殊序列水平變化情況。所有患者均獲得隨訪,隨訪時間48~54個月,平均(52.01±1.82)個月,記錄兩組患者胸椎和腰椎壓縮性骨折發生率。

2 結 果
2.1 兩組患者治療前后VAS評分情況比較 B組患者術后12、24、48周時VAS均優于A組(P<0.05,見表1)。
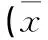
表1 兩組治療前后VAS比較±s,分)
2.2 兩組患者治療前后腰椎骨密度水平變化情況 術后12周、24周、48周時,B組患者的腰椎骨密度水平均高于A組(P<0.05,見表2)。

表2 兩組治療前后腰椎骨密度水平變化比較±s,g/cm2)
2.3 兩組患者治療前后股骨頸骨密度水平變化情況 術后12周、24周、48周時,B組患者的股骨頸骨密度水平均高于A組(P<0.05,見表3)。

表3 兩組治療前后股骨頸骨密度水平變化比較±s,g/cm2)
2.4 兩組患者治療前后β-膠原特殊序列水平變化情況 B組患者術后12周、24周、48周時β-膠原特殊序列水平均低于A組(P<0.05,見表4)。
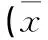
表4 兩組治療前后β-膠原特殊序列水平變化比較±s,ng/mL)
2.5 兩組患者治療后壓縮性骨折發生率比較 B組患者壓縮性骨折發生率為36.67%,A組為16.67%,B組患者壓縮性骨折發生率高于A組(P<0.05,見表5)。

表5 兩組治療后壓縮性骨折發生率比較(例,%)
3 討 論
高骨折風險和初期OVCF前椎體楔形進行性后凸引起身體的重心向前,使椎體前方承受負荷并在椎體前形成異常壓力,形成新的骨折[5]。PVP將骨水泥注入椎體后,可引起相鄰椎骨的應力分布發生顯著變化,相鄰椎間盤壓力和椎體終板的壓力增加,形成不可逆性形變而導致相鄰的椎體骨折。造成OVCF骨折的原因主要有:a)再創傷。任何輕微的外力都可能導致OVCF患者發生脆性骨折[6];b)生物力學因素。由于椎體結構復雜,骨水泥注入后其對椎體矢狀面恢復程度難以調控,導致椎體容積減弱,相鄰椎間盤負荷增加,通過相鄰椎體應力可引起骨間張力增加,導致相鄰的椎體骨折風險,使骨水泥外滲進入椎間盤,改變椎間盤的負荷,臨床在進行抗骨質疏松治療時是否達到標準化,在很大程度上影響著相鄰骨折發生的概率[7]。
對于嚴重疼痛或非手術治療失敗的OVCF患者,可以使用抗骨質疏松藥物聯合手術治療,包括椎體成形術和椎體外科術后骨凸度成形術[8],此兩種手術方式和患者手術體位較為一致,但是椎體成形術之間存在一定的技術差異[9]。骨水泥(通常是聚甲基丙烯酸甲酯)進入椎體的PVP僅用于治療由椎體骨折引起的疼痛,而對骨折骨質疏松癥存在的根本原因尚未得到根本解決,仍存在骨折和骨質疏松癥的發生風險[10]。骨質疏松主要是骨強度的變化,骨強度集中在質量和數量兩個方面,其中不僅包括骨量,而且包括骨組織和骨骼生物力學變化而引起的微觀結構變化[11]。
補充鈣劑是骨質疏松治療最基本的方法,它為人體提供骨礦物質,增加骨強度[12]。單純使用普通鈣片,能對骨質起到一定的堅固作用,但對PVP術后相鄰椎體骨折發生的預防及治療作用不佳,本研究使用鈣片與雙膦酸鹽進行聯合治療,對骨質疏松患者和PVP術后相鄰椎體骨折均起到較好的治療作用[13]。雙膦酸鹽已廣泛用于日本和歐洲骨質疏松癥患者的治療中,以降低破骨細胞活性,減少破骨細胞計數,抑制骨吸收活性維生素D代謝物,增加胃腸鈣攝取,直接或間接抑制降鈣素釋放并減少骨量丟失,同時具有強烈的鎮痛作用,特別適用于OVCF術后的抗骨質疏松治療。本研究中表1、2、3顯示,雙膦酸鹽加鈣片組患者治療后疼痛視覺摸擬評分,腰椎骨密度和股骨骨密度均較優于單獨口服鈣片組,說明使用鈣片聯合雙膦酸鹽治療可明顯降低PVP術后的疼痛,提高骨密度水平,恢復患者功能活動,提高患者生活質量。
但越來越多的學者報道,長期使用雙膦酸鹽進行抗骨質疏松治療會增加非典型性骨折的發生率[14],本文回顧性分析研究表5結果也證明PVP術后雙膦酸鹽加鈣片治療組壓縮性骨折的發生率大于單獨口服鈣片組。這一臨床現象的機制尚處于不斷關注和研究中。雙膦酸鹽治療骨質疏松的機制是抑制破骨細胞活性從而促進成骨,中性粒細胞堿性磷酸酶,I型膠原羧基端肽,β-膠原特殊序列及骨轉換標志物(bone turnover markers,BTMs)等骨轉化生化指標可以提示骨轉化過程中骨形成、骨吸收的活動強度。其中β-膠原特殊序列水平是骨質疏松患者血清中含量變化最為明顯的因子之一,明顯升高的β-膠原特殊序列水平可增加患者骨質疏松的發病率[15]。本研究中表4顯示,治療后雙膦酸鹽加鈣片組患者β-膠原特殊序列水平均低于單獨口服鈣片組,說明使用鈣片聯合雙膦酸鹽治療骨質疏松時,能降低血清β-膠原特殊序列水平,增強患者抗骨質疏松能力。但國內學者唐鵬等[16]設計了長期應用雙膦酸鹽類藥物對中性粒細胞堿性磷酸酶、I型膠原羧基端肽活性影響的隨機對照實驗,其活性的變化是一個波動變化的過程,中性粒細胞堿性磷酸酶表達的成骨活性在某一個時間會明顯下降,而I型膠原羧基端肽表達的破骨活性會逐漸大于成骨活性。因此,在長期應用雙膦酸鹽抗骨質疏松的過程中,實驗研究表明由于過度抑制了破骨細胞的活性,成骨活性也會降低,這樣可導致骨質脆性增加,其機制與長期使用雙膦酸鹽損傷骨骼重建,微損傷聚集有關,這或許也是長期口服雙膦酸鹽和鈣片誘使PVP術后鄰近椎體骨折的重要原因[17]。國外學者研究表明[18],長期使用雙膦酸鹽后會大大增加破骨細胞的數量,甚至出現部分巨大的破骨細胞,這可能是長期口服雙膦酸鹽和鈣片加重PVP術后鄰近椎體骨折發生的又一因素。
如何避免長期使用雙膦酸鹽的并發癥,根據骨密度測量結果,規范抗骨質疏松治療是基礎[19],骨轉化生化指標BTMs對骨質疏松的診斷、分類以及療效評價越來越受到重視[20]。通過檢測BTMs,可以判斷骨丟失速率、了解骨質疏松病情進展、指導治療方法的選擇和調整。一般來說,對BTMs較高(即中、高轉換)的骨質疏松或骨量減少患者,應及時選擇使用抗骨吸收藥物。對BTMs較低(即低轉換)的骨質疏松患者,可暫不治療或選擇使用骨化三醇、骨鈣素等促骨形成藥物,盡量避免雙膦酸鹽藥物單獨長期使用。
本研究尚缺乏多中心臨床數據,下一步擬對長期使用雙膦酸性鹽導致PVP術后相鄰椎體骨折發生率增加的機制進行進一步研究。

