葛仙米多糖中單糖定性定量分析方法研究
周 熙王 希劉水平羅 誠王宗成張瑞華
(1. 株洲市食品藥品檢驗所,湖南 株洲 412000; 2. 湖南科技學院化學與生物工程學院,湖南 永州 425199;3. 湖南炎帝生物工程有限公司,湖南 株洲 412007)
葛仙米學名擬球形念珠藻(Nostoc sphaeroides),發育成熟后呈藍綠色膠質狀,顆粒圓潤,玲瓏剔透[1],為中國獨有的淡水野生藍藻,與發菜同屬。葛仙米不含藍藻毒素,是一種有較高藥用和食用價值的經濟藍藻[2],而且富含蛋白質及豐富的多糖[3-5]。多糖類物質往往具有許多生物活性,葛仙米多糖主要成分為半乳糖、甘露糖和木糖,對HCT116細胞增殖具有很強的抑制活性[3]。隨著技術的進步和多糖研究的深入,葛仙米必將進一步在食品、保健食品及醫療行業發揮巨大作用[6-7]。現有多糖測定的標準方法均為化學法:SN/T 4260—2015《出口植物源食品中粗多糖的測定 苯酚—硫酸法》、NY/T 1676—2008《食用菌中粗多糖含量的測定》等。這2種方法經過不斷優化后,已經廣泛用于植物、真菌等多糖的測定。但由于葛仙米中多糖含量高,而且黏度非常大,采用化學法分析時,多糖較難完全提取出來,測定結果不穩定,無法準確測定[7-9]。
對葛仙米有效成分多糖進行檢驗方法研究及質量分析,可為企業原料規模化養殖、提取方法優化篩選、進一步的開發利用等提供試驗依據,為食品藥品監管部門對其質量及安全風險評估提供準確可靠的數據,為質量監控提供技術指標。
目前,有關葛仙米多糖的化學結構研究較少,其多糖的單糖組成是研究多糖生物活性的基礎[10-11]。1-苯基-3-甲基-5-吡唑啉酮(1-phenyl-3-methyl-5-pyrazolone,PMP)柱前衍生化高效液相色譜測定多糖含量的方法,目前被廣泛用于各種多糖的單糖組分檢測研究[12]。氣相色譜法亦可定性、定量分析多糖的組分和含量,一般是將多糖酸水解或甲醇醇解,再用衍生物法以增加其揮發性[13]。相比化學法,色譜法靈敏度應更高、穩定性更好,可定性、定量分析多糖的組分和含量[14]。但由于多糖的結構比較復雜,其水解前處理方法多樣,水解條件各有不同,因此有必要找到穩定的前處理方法,與化學法測定多糖含量進行對比,同時對該方法的精密度、重現性、顯色穩定性和加樣回收率進行考察,為葛仙米多糖提取物中多糖含量的準確測定提供依據。
1 材料與方法
1.1 試劑與材料
葛仙米多糖提取物:湖南炎帝生物工程有限公司。其中Y1與Y2為野生葛仙米,Y3~Y6分別為春夏秋冬4個季節的樣品,樣品信息見表1。
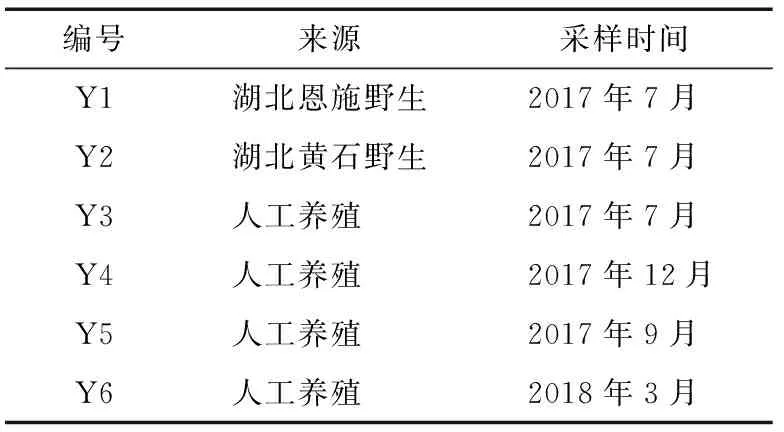
表1 樣品Table 1 Sample
1.2 儀器與設備
電子天平:MS205DU型,瑞士梅特勒-托利多國際貿易有限公司;
液相色譜儀:Thermo U3000型,美國賽默飛世爾科技公司;
pH計:FE-20型,瑞士梅特勒-托利多國際貿易有限公司。
1.3 HPLC法測定葛仙米多糖提取物的總糖含量
葛仙米多糖提取物的前處理水解條件經過單因素考察確定,參考相關文獻資料[15-17]主要考察水解溫度高低、時間長短以及三氟乙酸對水解程度的影響;通過單因素的考察確定最佳的水解條件。
1.3.1 標準單糖溶液的配置及衍生 分別精密稱取甘露糖、氨基葡萄糖、鼠李糖、葡萄糖醛酸、半乳糖醛酸、葡萄糖、半乳糖、木糖及巖藻糖標準品100 mg于10 mL容量瓶中,加水稀釋至刻度,搖勻,即得9種單糖的標準儲備溶液。再配置成濃度分別為0.1,0.5,1.0,1.5,2.0 mg/mL的單糖混合標準溶液。分別取50 μL的單糖標準液及不同濃度梯度的混合標準溶液,各加0.6 mol/L的NaOH溶液50 μL,置于5 mL的具塞試管中,漩渦混勻;再加0.5 mol/L的PMP(0.435 5 g/5 mL)甲醇溶液100 μL,漩渦混勻,在70 ℃的烘箱中避光反應80 min,取出避光冷卻至室溫,加0.3 mol/L的HCl溶液100 μL中和,加水至2 mL,再加等體積的氯仿,漩渦混勻,靜置,棄去氯仿相,如此萃取3次。將水相用0.45 μm 微孔膜過濾后供HPLC進行分析,作為定性定量的依據[15-18]。
1.3.2 葛仙米多糖提取物的水解 吸取0.1 mL質量分數為5 mg/mL的多糖樣品溶液于2 mL的西林瓶中,加入濃度為3 mol/L的三氟乙酸(trifluoroacetic acid,TFA)溶液100 μL,充N2封管,在110 ℃的烘箱中水解4 h;冷卻后將水解液轉移至5 mL的離心管中,并用0.2 mL甲醇沖洗轉移殘余水解液,加0.2 mL甲醇后用N2吹干,如此重復加甲醇并用N2吹干3次,去除TFA,得水解樣品。取本品水解的殘渣,加入50 μL超純水溶解殘渣,按照“1.3.1”方法進行衍生、中和、萃取,用0.45 μm微孔膜過濾后,超聲脫氣,進行HPLC檢測分析[15-18]。
1.3.3 色譜條件 色譜柱:Welch Xtimate(4.6 mm×250 mm,5 μm);流動相:以0.1 mol/L磷酸鹽緩沖溶液(用3 mol/L 氫氧化鈉調節pH值至6.7)為流動相A,乙腈為流動相B,梯度洗脫(表2);檢測波長:260 nm;柱溫:30 ℃;流速:1.0 mL/min;進樣量:10 μL。
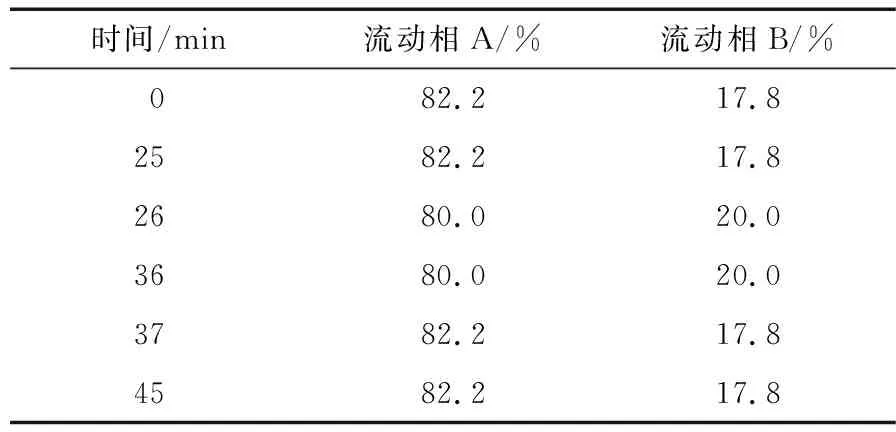
表2 梯度洗脫程序Table 2 Gradient elution program
1.4 苯酚-硫酸法測定葛仙米多糖提取物的總糖含量
1.4.1 溶液的配置 精確稱取重蒸酚25.0 g,加水溶解后,轉移至500 mL的容量瓶中,稀釋至刻度處,混勻,得到質量濃度為5%的苯酚溶液,將其保存在4 ℃中,備用。標準葡萄糖溶液配置:精準稱取無水葡萄糖10.0 mg于100 mL容量瓶中,加入蒸餾水至刻度處、搖勻,配成葡萄糖溶液濃度為0.10 mg/mL,備用[19]。
1.4.2 標曲的繪制 準確吸取葡萄糖標準溶液0.00,0.10,0.20,0.40,0.60,0.80,1.00 mL置于25 mL的離心管中,補加水至2.0 mL,加入5%的苯酚溶液1.0 mL,混合均勻后,繼續加入濃硫酸10 mL,混勻后,沸水浴2 min,冷卻至室溫,在485 nm波長處以試劑空白為參比,1 cm比色皿測定吸光光度值[19]。以葡萄糖質量為橫坐標,吸光光度值為縱坐標,繪制標曲,見圖1。
1.4.3 樣品中總糖的測定 稱取0.1 g的葛仙米多糖提取物在水中溶解,定容至100 mL(V1)。準確吸取2 mL(V2)的葛仙米多糖提取物溶液置于25 mL的離心管中,加入10 mL無水乙醇,混勻,于4 ℃冰箱中靜置4 h,離心(5 000 r/min, 5 min),棄去上清液,殘渣用2 mL 80%乙醇洗滌,洗滌3遍,殘渣溶解定容至25 mL(V3)[19]。準確吸取前處理好的葛仙米多糖提取物1.0 mL(V4),補加水至2.0 mL,然后照“1.4.2”方法測定吸光光度值,依照標曲計算葛仙米多糖提取物的濃度,按式(1)計算總糖含量[19]。
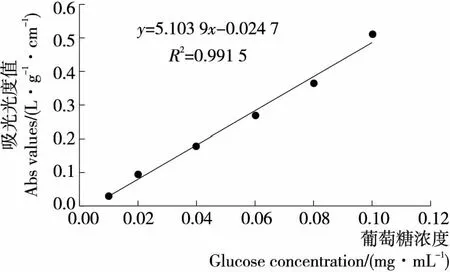
圖1 葡萄糖標準曲線Figure 1 Standard curve of glucose
(1)
式中:
X——總糖含量,%;
m1——樣品中葡萄糖測定量,mg;
m2——樣品的質量,g;
V1——樣品提取液的定容體積,mL;
V2——沉淀粗多糖所用溶液的體積,mL;
V3——粗多糖溶液體積,mL;
V4——測定樣品溶液體積,mL。
2 結果與分析
2.1 單糖PMP衍生物的色譜圖及線性關系
單糖PMP衍生物的標樣圖以及代表性樣品單糖衍生圖見圖2。表3表明:甘露糖、氨基葡萄糖、鼠李糖以及葡萄萄醛酸等9種單糖的衍生物在0.1~2.0 mg/mL時線性關系良好。
2.2 葛仙米多糖水解單因素試驗
2.2.1 水解時間的考察 按“1.3”水解衍生多糖樣品,分別考察水解2,3,4,5,6 h多糖的水解程度。最后結果如表4所示,隨著水解時間的延長,單糖的總峰面積增加,水解4 h時最大,隨后減少。由此可見,水解4 h最佳。
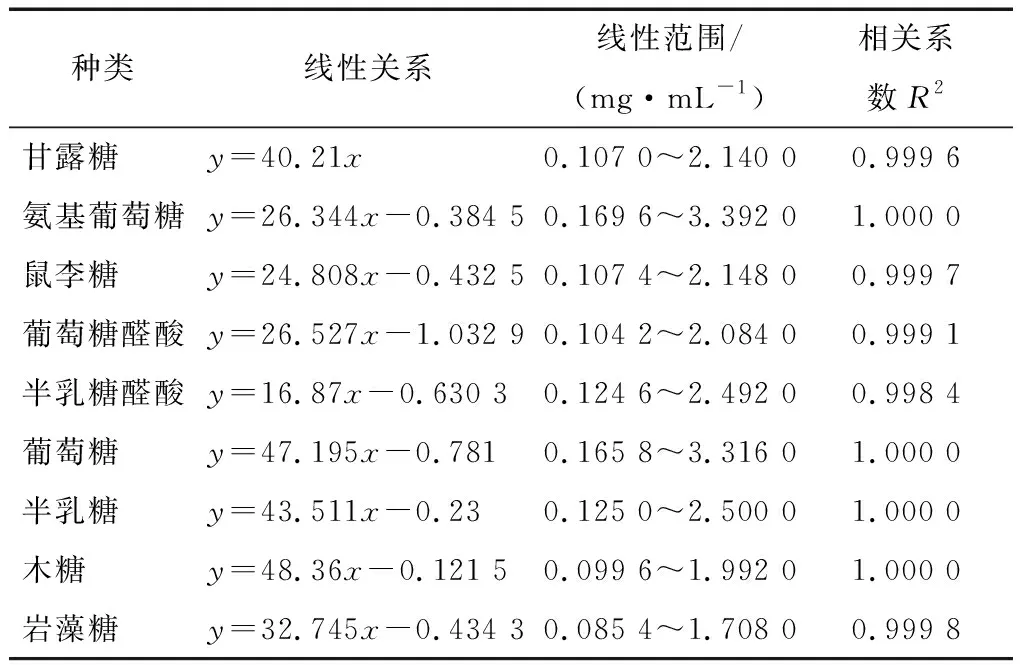
表3 單糖的標準曲線Table 3 The monosaccharide of lineal relation
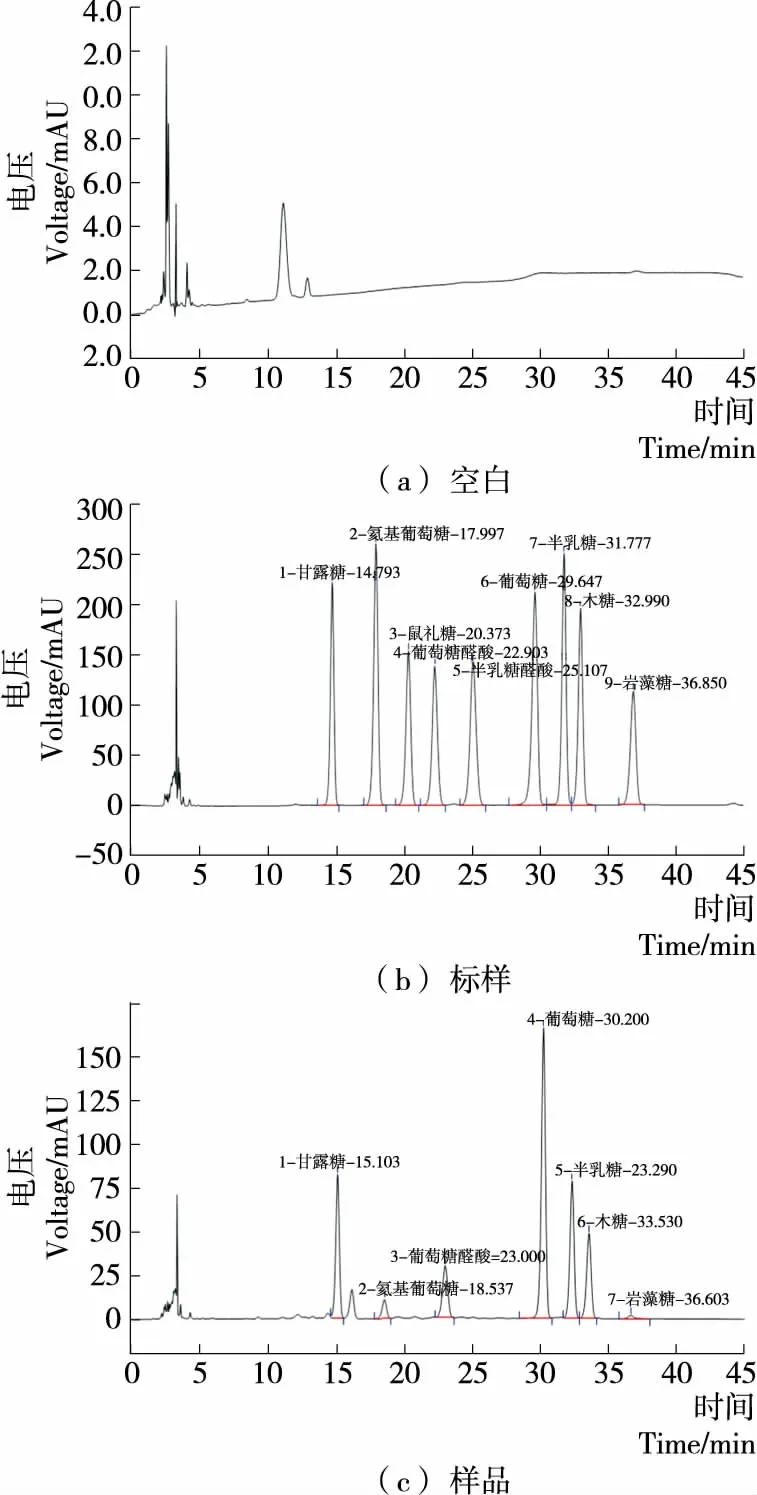
圖2 多糖水解樣品和標樣衍生物的HPLC分離效果圖Figure 2 Separation of polysaccharide hydrolysate and standards derivatives by HPLC
2.2.2 TFA濃度的考察 照“1.3”項,水解衍生多糖樣品,分別考察不同濃度TFA(2,3,4,5,6 mol/L)對多糖水解的影響。如表5所示,隨TFA的濃度的增加,單糖的總峰面積先增加然后降低,當TFA的濃度為3 mol/L時水解衍生結果最佳。
2.2.3 水解溫度的考察 照“1.3”項,水解衍生多糖樣品,分別考察不同溫度(100,110,120 ℃)對多糖水解的影響,如表6所示,根據峰面積總和的大小,確定110 ℃最佳。
2.3 系統適用性試驗
取“1.3.1”和“1.3.2”的對照品溶液和樣品溶液,按“1.3.3”的色譜條件進行分析,同時做空白試驗,記錄色譜圖,9種單糖分離良好,理論板數均不低于5 000(見圖2)。
2.4 方法學考察
2.4.1 儀器精密度 按“1.3.1”項下衍生混合標準溶液,再依照“1.3.3”項下色譜條件進樣,連續進樣6針,計算其RSD,測定結果見表7。結果表明儀器的精密度良好。
2.4.2 精密度試驗 分別精密量取同一對照品溶液50 μL,置于15 mL離心管中,共6份,按“1.3.1”項下衍生條件處理。然后,照“1.3.3”項下的色譜條件進行分析,計算甘露糖、氨基葡萄糖、鼠李糖以及葡萄糖醛酸等9種單糖衍生物的峰面積以及RSD值,測定結果見表8。結果表明本試驗精密度良好,說明樣品水解衍生的處理方法可靠。
2.4.3 穩定性試驗 精密量取同一對照品溶液50 μL,置于15 mL離心管中,按“1.3.1”項下衍生條件處理。放置在室溫條件下,分別于0,1,2,4,8,16,24,48 h,按照“1.3.3”的色譜條件進行分析,計算9種單糖衍生物峰面積的RSD值,結果見表9。結果表明衍生后9種單糖溶液24 h內均穩定。
2.4.4 重復性試驗 吸取5 mg/mL的葛仙米多糖提取物樣品溶液0.1 mL,按“1.3.2”的試驗方案,取樣6份水解衍生處理,然后照按“1.3.3”的色譜條件進行分析,計算樣品中主要5種單糖的RSD,結果見表10。其重復性尚可,葡萄糖醛酸以及木糖的RSD偏高,可能是水解后的穩定性稍差。
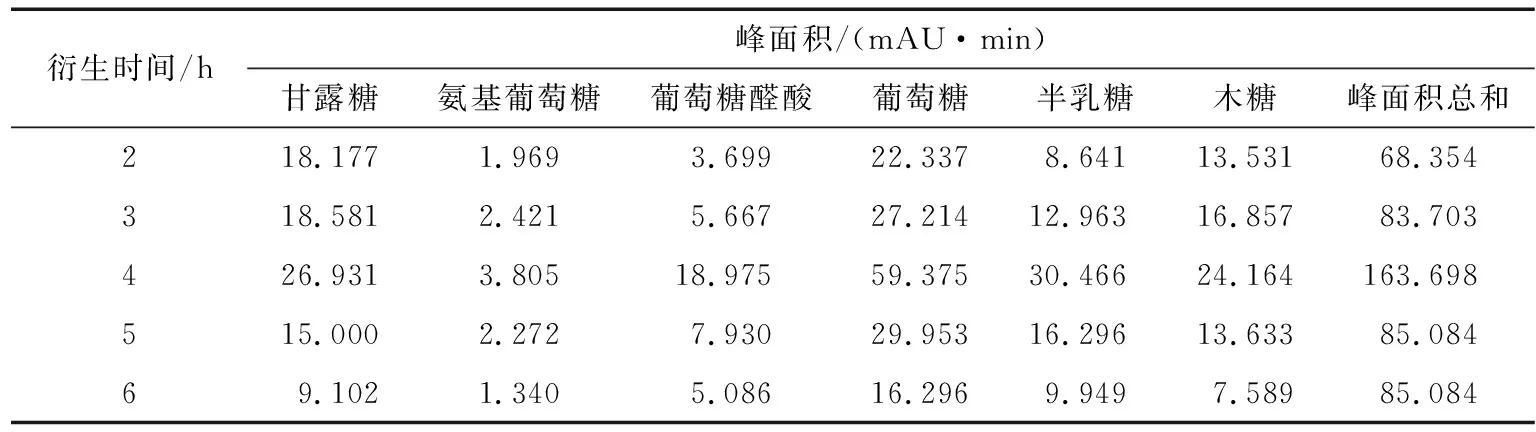
表4 水解時間對單糖峰面積的影響Table 4 The analysis of hydrolysis time (n=5)
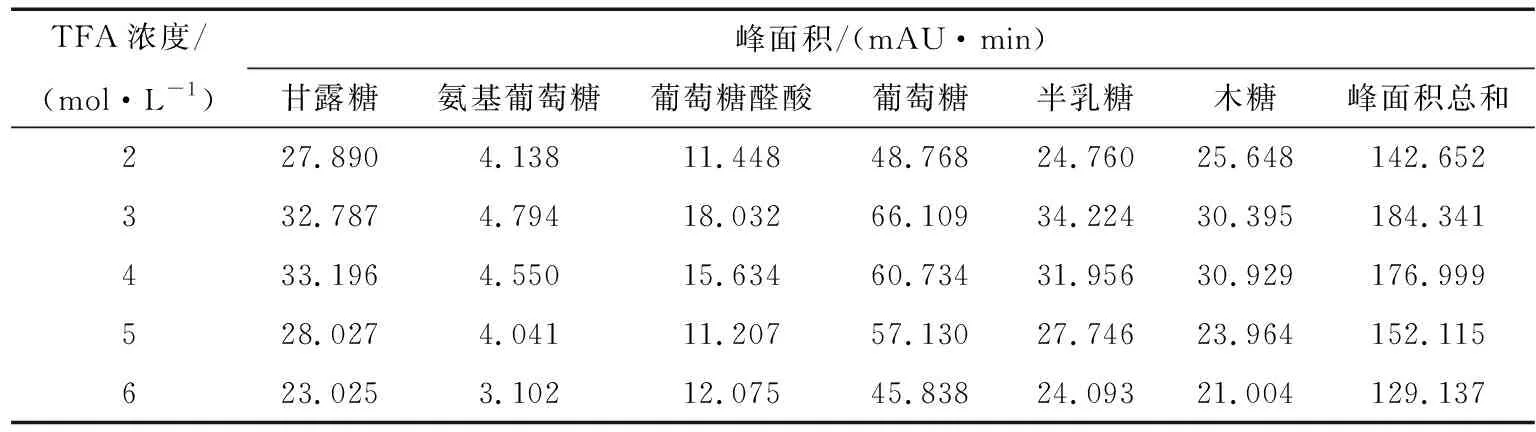
表5 TFA濃度對單糖峰面積的影響Table 5 The analysis of TFA concentration (n=6)
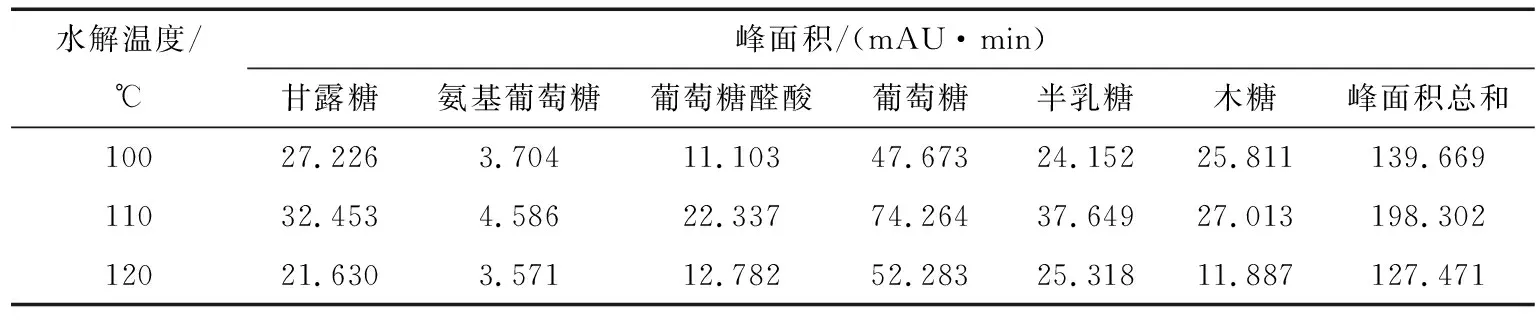
表6 水解溫度對單糖峰面積的影響Table 6 The analysis of hydrolysis temperature (n=3)

表7 儀器精密度Table 7 The precision of instrument
2.4.5 回收率試驗 吸取5 mg/mL的葛仙米多糖提取物樣品溶液0.05 mL,同時每份樣品中加入0.05 mL混合標準溶液(1 mg/L),按“1.3.2”的試驗方案,取樣6份水解衍生處理,然后照按“1.3.3”的色譜條件進行分析,計算樣品中主要9種單糖的回收率,結果見表11。回收率在80%~110%時,葡萄糖與甘露糖的回收率偏低。
2.4.6 檢出限試驗 精密量取“1.3.2”項下的混合標準溶液(1 mg/L) 0.25 mL置于100 mL量瓶中,用水稀釋至刻度,搖勻。按“1.3.1”的衍生條件處理。然后,照“1.3.3”的色譜條件進行分析,以信噪比(S/N)為3計算9種單糖的檢出限為4.27~8.48 μg/mL。檢出限計算結果見表12,與化學法相比,HPLC方法的檢出限更低。
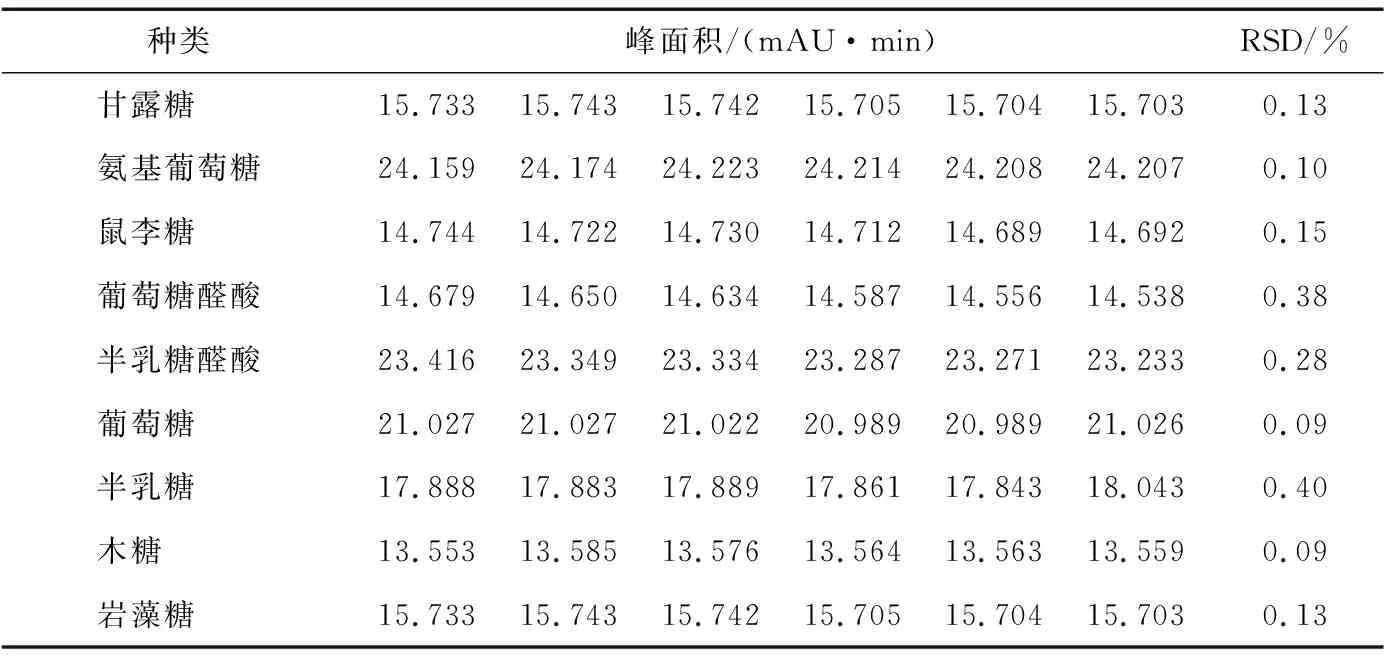
表8 精密度試驗Table 8 The precision test (n=6)
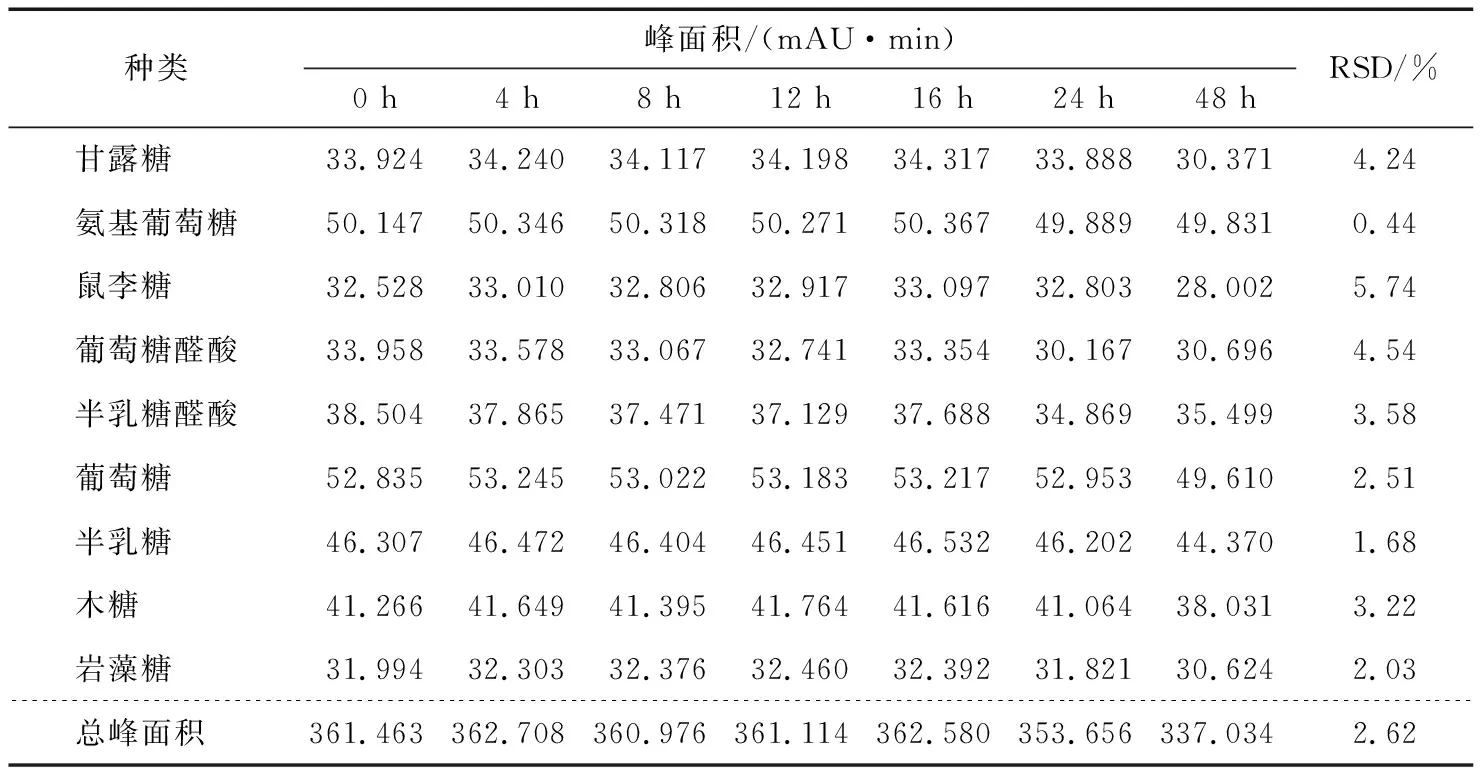
表9 穩定性試驗Table 9 The stability test (n=7)

表10 重復性試驗Table 10 The reproducibility test (n=6)
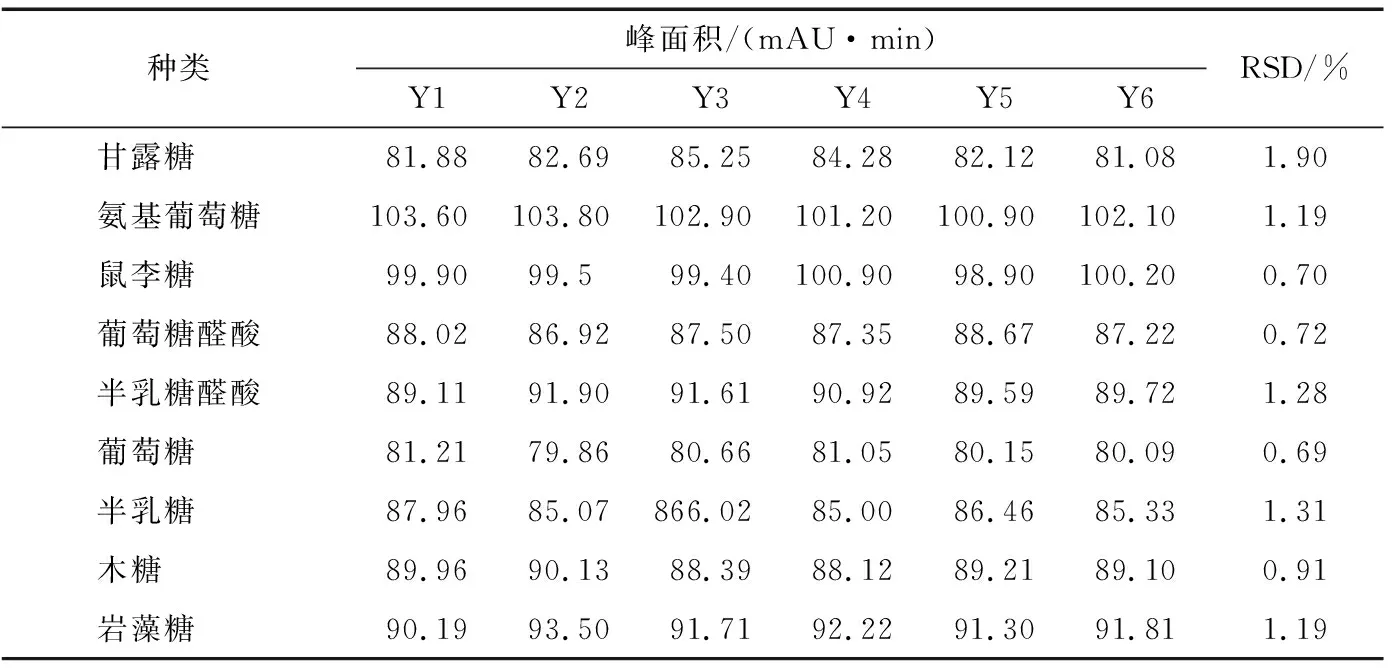
表11 回收率試驗Table 11 The recovery test (n=6)
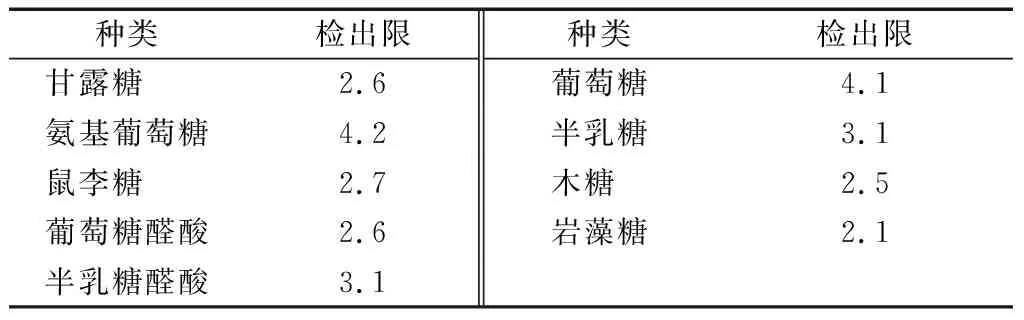
表12 檢出限Table 12 The detection limit (n=9) μg/mL
2.4.7 樣品測定 按“2.2”的方法制備對照品溶液和供試品溶液(共6批樣品),按“2.1”的色譜條件進行分析測定。以單糖的含量計算多糖的含量,選取6種主要的單糖來計算,即甘露糖、氨基葡萄糖、葡萄糖醛酸、葡萄糖、半乳糖以及木糖,9種單糖含量的計算結果見表13、14。同樣6批次樣品用化學法測定總糖含量,結果見表15。可以看出化學法測定結果整體數值偏高,平行試驗結果差別較大。
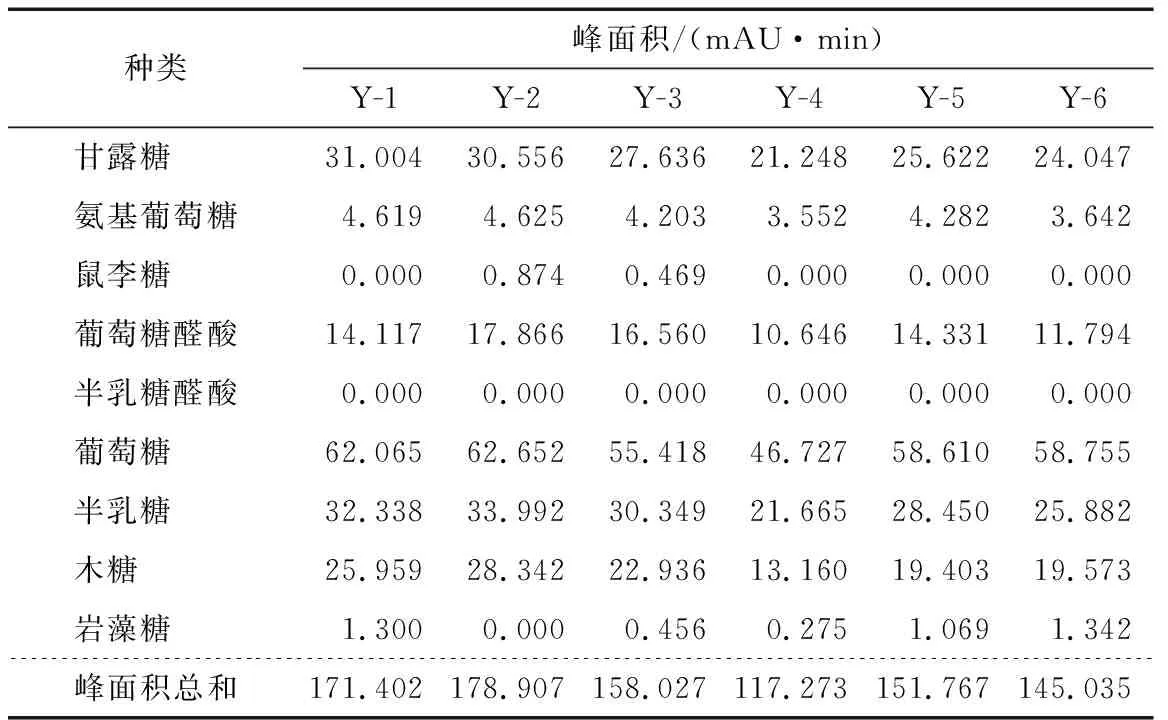
表13 HPLC法樣品測定結果Table 13 The content determination of samples by HPLC (n=6)
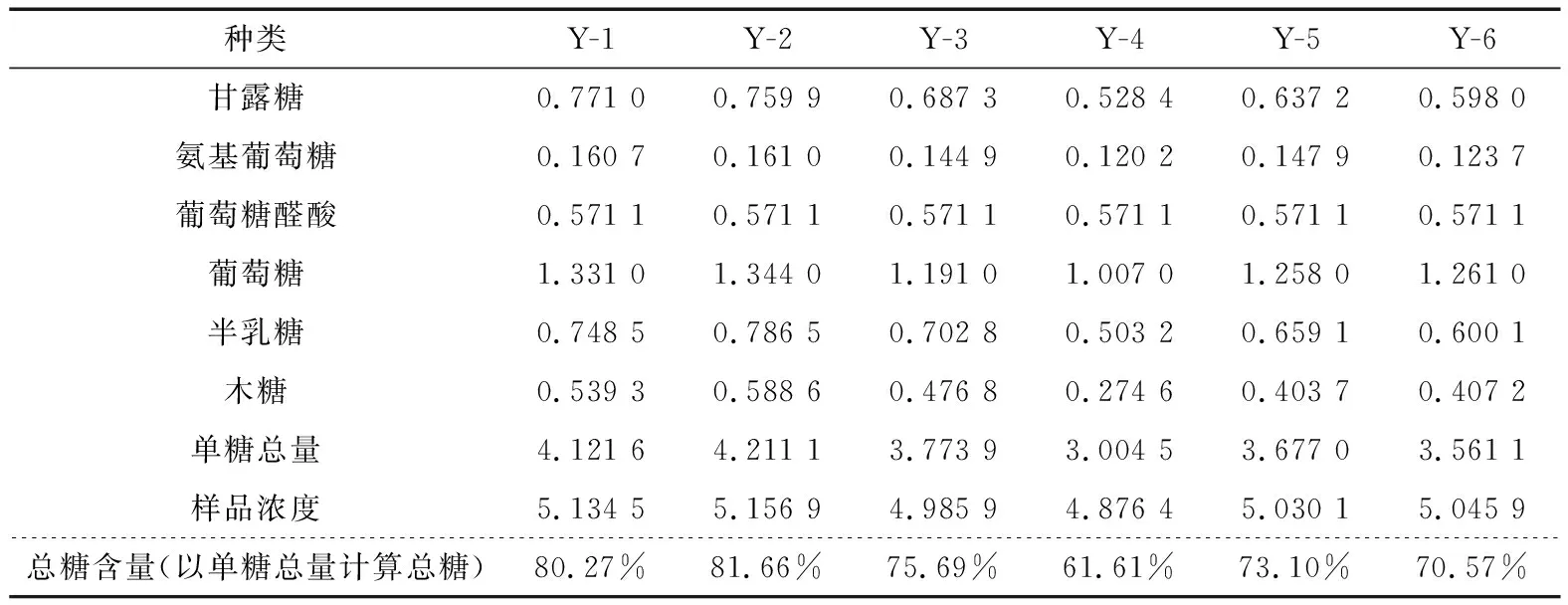
表14 HPLC法單糖含量的計算結果Table 14 The content determination of monosaccharide by HPLC (n=6) mg/mL
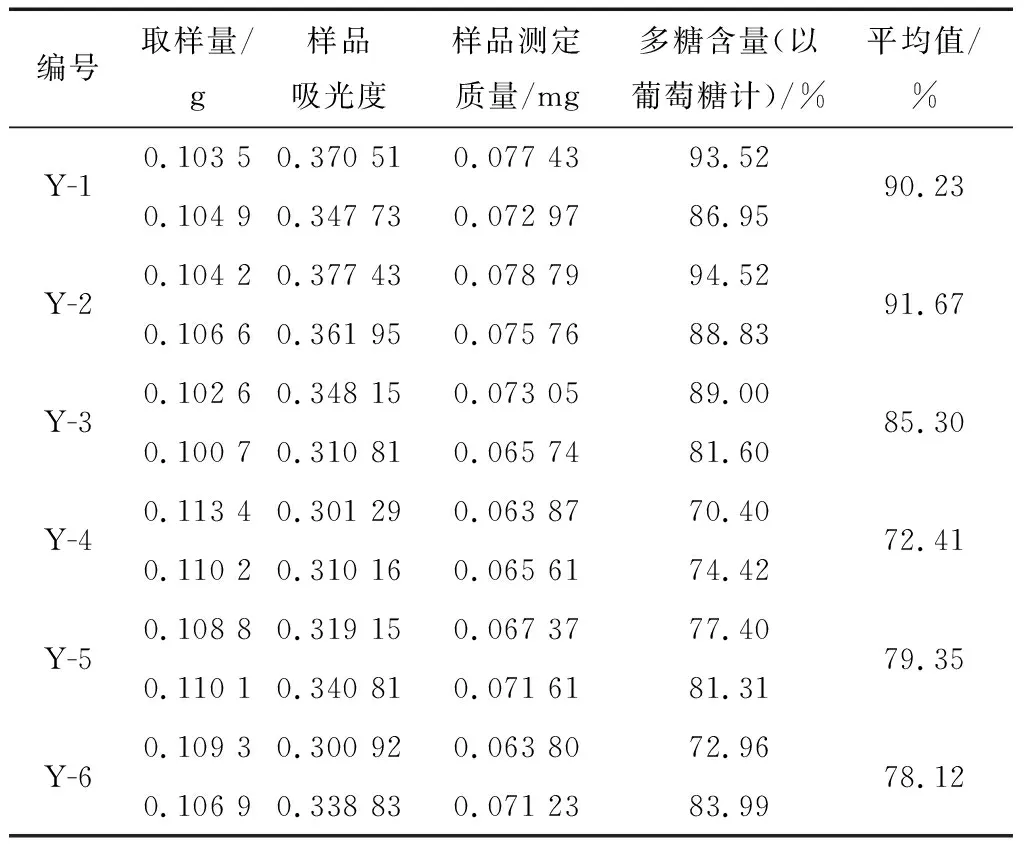
表15 化學法測定總糖含量的計算結果Table 15 The content determination of polysaccharides by chemical method (n=6)
2.5 單糖含量結果分析
柱前PMP衍生高效液相色譜法測多糖,以單糖總量計算多糖,存在操作步驟較多,數值整體偏低的問題。但相較于化學法,該方法準確可靠,線性關系良好,重復性和專屬性好,可以很好地完成葛仙米多糖提取物中的單糖組成及定性定量分析。雖然化學法操作步驟簡單、易行,但其測定值平行性差,檢出限不高,結果的可靠性較低。另外,按照上述所建立的水解衍生方法,并針對此方法進行方法學考察,測定6批樣品,同時與化學法進行了比較發現,其中野生的葛仙米多糖提取物多糖含量高于人工養殖的,夏秋季采樣的葛仙米多糖提取物所測多糖含量亦高于其他季節,可能是夏季葛仙米生長旺盛,存儲多糖含量較高。野生葛仙米的多糖提取物中的多糖含量明顯高于養殖的,可能有以下幾個原因:① 養殖的密度偏大;② 模擬野生環境可能有所欠缺;③ 經緯度的問題,日照、溫度等有所影響。
3 結論
本試驗采用三氟乙酸水解葛仙米多糖提取物,對水解條件進行了單因素考察。通過考察發現,在110 ℃下,采用3 mol/L 的三氟乙酸水解4 h,其水解效果更好。然后,進行方法學驗證,結果表明,相較于化學法新建立的分析方法可靠準確、靈敏度高,可同時用于9種單糖的分析,且分離效果較理想。樣品測定結果顯示,葛仙米多糖提取物中主要含有甘露糖、氨基葡萄糖、葡萄糖醛酸、葡萄糖、半乳糖及木糖6種單糖,其中甘露糖、葡萄糖、半乳糖以及木糖含量較高,與莫開菊等[15]報道的結果類似,通過對比,發現葛仙米多糖提取物中有一種單糖種類不一致,其文中報道含有阿拉伯糖。經加標試驗確認,木糖與阿拉伯糖保留時間極為接近,樣品中峰的保留時間與木糖衍生物一致,最終確認葛仙米多糖提取物中的單糖組成之一應是木糖。不足之處在于所測樣品批次少,野生葛仙米的樣品難以收集,沒能比較不同月份以及不同年份野生和人工養殖的葛仙米中多糖含量的差異,如有大樣本的數據,更能找出其中的規律,為葛仙米的人工養殖提供科學的依據。
此外,現有研究表明葛仙米多糖的分子量與其生物活性存在直接關聯,但由于多糖結構的復雜性,大部分研究都只是在一級結構上。而葛仙米多糖的研究起步較晚,相關的生物活性研究亦較少。確定葛仙米多糖單糖的組成和含量可以為進一步研究、開發葛仙米的相關活性提供理論基礎[3,10-11]。

