MyD88 基因L265P突變檢測輔助診斷淋巴漿細胞淋巴瘤/華氏巨球蛋白血癥1例
李懿皞, 周 琰, 陳 樸, 胡玉懿, 王蓓麗, 郭 瑋, 潘柏申
(復旦大學附屬中山醫院檢驗科,上海 200032)
淋巴漿細胞淋巴瘤(lymphoplasmacytic l y m p h o m a,L P L)/華氏巨球蛋白血癥(Waldenstr?m macroglobulinemia,WM)是一種少見的具有漿細胞樣分化特征的小B細胞惰性淋巴瘤,在非霍奇金淋巴瘤中的發病率<2%。以往由于LPL/WM與淋巴結邊緣區淋巴瘤(nodal marginal zone lymphoma,NMZL)、慢性淋巴細胞白血病/小淋巴細胞淋巴瘤(chronic lymphocytic leukemia/small lymphocytic lymphoma,CLL/SLL)等難以鑒別診斷,且缺乏相關特征性的細胞免疫標志物,通常采用排他法診斷,流程通常較長,不利于患者的及時診治。近年來的研究發現,超過90%的LPL/WM患者中存在髓樣分化因子88(myeloid differentiation factor 88,MyD88)基因L265P突變,這為臨床提供了分子診斷依據。本研究報道1例通過檢測MyD88基因 L265P點突變輔助診斷LPL/WM的病例。
1 病例
患者,男,66歲,自2016年起出現無明顯誘因的乏力、納差,伴消瘦,半年內體重減輕15 kg。無頭暈、頭痛,無發熱出汗,無胸悶、胸痛,無骨痛及骨折。2017年2月于復旦大學附屬中山醫院就診。血常規:血紅蛋白78 g/L,血小板計數217×109/L,紅細胞計數2.73×1012/L,白細胞計數5.38×109/L,紅細胞沉降率66 mm/H,血細胞比容22.2%,單核細胞百分比20.1%,鏡檢見少量未成熟粒細胞(0.4%)。血液生化檢查:IgM 19.70 g/L,IgG 13.50 g/L,IgA 0.82 g/L,IgE 37.00 IU/mL,κ輕鏈 5.68 g/L,血清蛋白電泳見γ區M蛋白,其他生化、免疫指標均未見異常。
2 診療
2.1 試劑與儀器
Capillarys2 Flex Piercing毛細管電泳儀、HYDRASYS 2免疫固定電泳儀(法國Sebia公司),FACS Canto II分析型流式細胞儀及相關流式抗體(美國BD公司),CX-31型光學顯微鏡(日本Olympus公司),7600-020全自動生化分析儀(日本日立公司)。LightCycler 480實時定量PCR儀(瑞士Roche公司)。Premix Taq Hot Start Version擴增體系[寶生物工程(大連)有限公司]。ABI 3130型遺傳分析儀(美國Theromo Fisher公司)及相關配套試劑。Lab-Aid 820 DNA抽提儀(廈門致善公司)及配套試劑。
2.2 檢測結果
2.2.1 免疫固定電泳及血清蛋白電泳結果 結合血常規及生化報告,考慮血液系統疾病,收治入院。行血清蛋白電泳檢測:白蛋白 38.4%,γ區35.1%,γ區存在M蛋白。 復查免疫固定電泳結果為陽性,可見IgM-κ型M帶,M蛋白濃度17.3 g/L,M蛋白百分比為24.0%,見圖1。
2.2.2 骨髓病理活檢 追加骨髓病理活檢、骨髓細胞免疫分型檢測,骨髓細胞涂片提示骨髓增生明顯活躍,淋巴細胞比例增高占43%,部分有漿樣分化表現。免疫組化結果示造血組織中可見到大量B淋巴細胞,T淋巴細胞及漿細胞數目未增多,B淋巴細胞約占骨髓有核細胞的55%,漿細胞約占骨髓有核細胞的5%,呈多克隆性,B淋巴細胞腫瘤性增生,考慮B細胞淋巴瘤累及骨髓。見圖2。
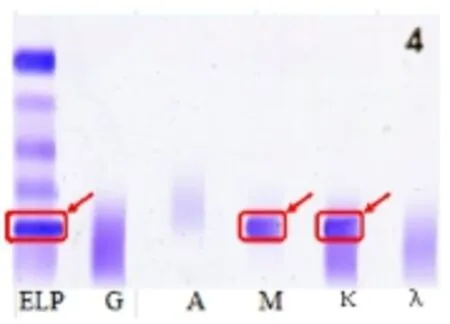
圖1 患者血清免疫固定電泳
2.2.3 流式細胞術結果 采用流式細胞術檢測CD19。 側向散射(side scatter,SSC)設門見B淋巴細胞κ陽性克隆 98.3%,呈限制性表達;CD22 97.6%,CD23 24.4%,FMC-7 16.2%,CD25 52%。見圖3。
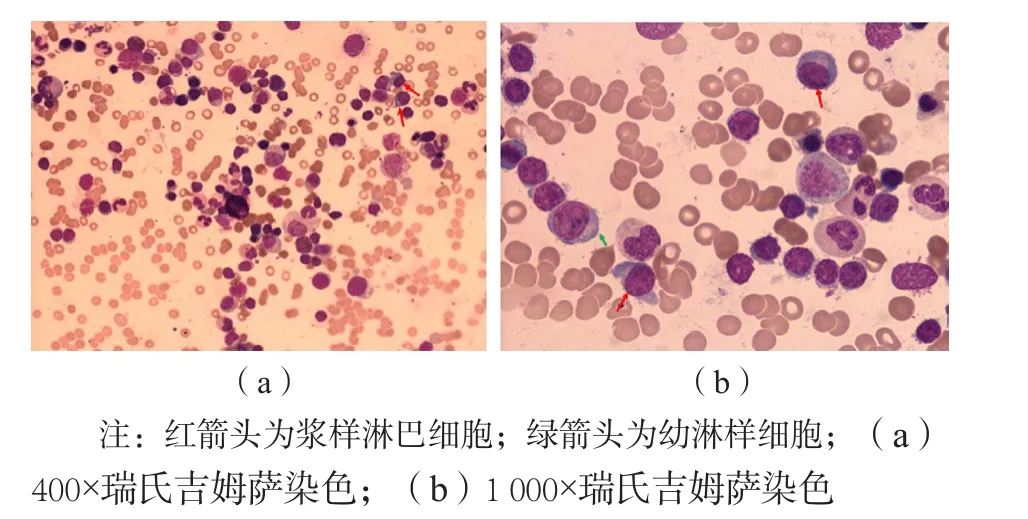
圖2 患者骨髓涂片
2.2.4 MyD88基因 L265P突變檢測 根據骨髓活檢和免疫分型結果,考慮淋巴細胞漿細胞淋巴瘤/華氏巨球蛋白血癥可能性大。采用Sanger測序法行MyD88基因L265P突變檢測,發現存在第794位堿基發生T→C的改變。見圖4。
MyD88基因 L265P突變檢測結果陽性,臨床確診為WM。采用烷化劑聯合重組人促紅細胞生成素的方案治療3 d后,患者狀況良好出院,醫囑定期隨訪。
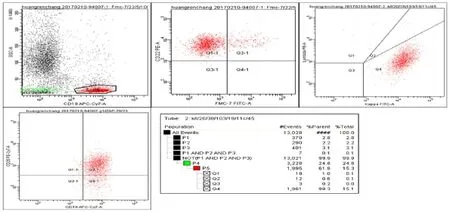
圖3 患者骨髓淋巴細胞流式圖(CD19/SSC設門)
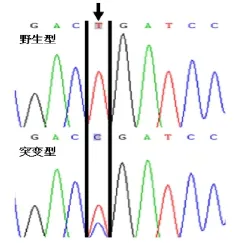
圖4 Sanger測序法檢測MyD88 L265P點突變
3 討論
本病例中,患者紅細胞計數、血紅蛋白明顯下降,血小板計數正常,紅細胞沉降率加快。生化檢測血清蛋白電泳提示M蛋白,IgM和κ鏈顯著升高,尿中存在κ輕鏈。免疫固定電泳報告IgM-κ型陽性M條帶,高度懷疑為血液系統腫瘤疾病,加做骨髓活檢、細胞免疫和MyD88 L265P點突變檢測。細胞免疫CD19/SSC設門見B淋巴細胞κ克隆限制性表達、FMC-7表達缺如、CD20(+)、CD25(+);骨髓活檢顯示CD20(+)、CD23(灶性+),均支持LPL/WM診斷。最終MyD88 基因L265P點突變檢測陽性,臨床確診為LPL/WM。
本病例中的WM是一種罕見的血液系統疾病,其發病率隨年齡增加而升高,具有一定家族傾向性,中位診斷年齡為63~68歲。在患有其他惡性腫瘤性疾病的人群中,WM的發病率較一般人有所增高。WM的發病主要與骨髓、腫瘤器官浸潤和異常IgM生成有關,主要臨床表現包括高黏滯綜合征、冷球蛋白血癥、冷凝集素性溶血性貧血、外周神經病變、淀粉樣變及腎小球病變等[1]。WM患者外周血一般不受累,細胞免疫表型特征包括:CD19 (+)、CD20(+)、slgM(+)、CD22(+)、CD79(+)、CD25(+),約20% 的WM患者存在CD5、CD10和CD23的表達[2]。在WM患者中,MyD88 L265P以及CXCR4 WHIM突變較為常見,且這2種突變均和腫瘤細胞生長、存活相關,前者在WM患者中的突變頻率更高,達90%以上[3]。也有文獻報道ARID1A是WM中一個重要的突變位點[4]。目前,WM的治療策略主要包括抗CD20單克隆抗體、烷化劑、核苷類似物、蛋白酶體抑制劑、免疫調節藥物、依維莫司等,其中MyD88和CXCR4基因的點突變是WM主要的治療和診斷靶點[5]。
MyD88是一種可溶性的銜接蛋白,屬于Toll樣受體(Toll-like receptor,TLR)/白細胞介素1受體(interleukin-1 receptor,IL-1R)家族,能介導多數TLR、IL-1R和IL-18R細胞的信號轉導,主要包含TIR、DD和ID3個功能區域[6]。MyD88基因L265P點突變是WM最主要的突變之一,其突變位點處于TIR結構域中,表現為Myd88基因編碼序列第794位堿基發生T向C突變,導致Myd88蛋白編碼區第265位的亮氨酸錯義突變為脯氨酸[4]。這種突變能使其成為TLR和IL-1R信號通路的受體分子,從而激活白細胞介素受體相關激酶1和2,活化Janus 激活酶信號轉導和轉錄激活因子3通路及核因子-κB通路,從而促進細胞惡性增殖、逃避細胞周期抑制、阻滯細胞分化成熟,導致腫瘤形成。有研究發現,超過90%的LPL/WM患者都能出現MyD88 L265P的基因突變[7-8],同時也發現該突變可見于部分IgM型(不見于IgG或IgA型)意義未明免疫球蛋白血癥和約30%非生發中心型彌漫大B細胞淋巴瘤[9],但在漿細胞骨髓瘤中即使是IgM型也無此突變。MyD88基因的L265P點突變檢測一般依靠Sanger測序或具有較高敏感度的等位基因特異-聚合酶鏈反應來進行[4],熒光原位雜交法也是一種檢測的手段[9]。目前LPL/WM診斷與治療的專家共識認為,MyD88基因 L265P點突變是WM診斷與鑒別診斷的重要標志,對臨床鑒別診斷B細胞相關血液系統腫瘤有著重要的意義[2]。另外,MyD88 L265P點突變的檢測和研究對WM患者靶向治療的開發有著重要的意義,依魯替尼等藥物能抑制MyD88基因L265P靶點的酪氨酸激酶受體,進而誘導腫瘤細胞凋亡。
WM是一種罕見的淋巴細胞腫瘤,既往由于沒有特征性的免疫學及分子生物學標志物,往往采用排除性的方法進行診斷。MyD88基因L265P點突變是WM有別于許多B系淋巴瘤的1個重要標志物,有助于區分LPL/WM和其他淋巴瘤疾病,具有一定的臨床價值。但其在彌漫大B細胞淋巴瘤、IgM型意義未明的單克隆丙種球蛋白血癥中也有表達,因此MyD88基因L265P點突變并非WM的特異性診斷標志物。聯合臨床表現、血清蛋白電泳、免疫固定電泳、細胞免疫分型、骨髓病理活檢和MyD88基因L265P點突變的檢測,有助于對WM更為準確的診斷和治療,同時也為靶向治療提供了方向。

