E-cadherin、TGF-β1和Twist1在結(jié)直腸癌變過程中的表達及意義
溫 輝 薛敬玲
(武漢大學(xué)基礎(chǔ)醫(yī)學(xué)院 武漢 430071)
結(jié)腸直腸癌,一種最常見的起源于上皮細胞的上皮癌,是工業(yè)化國家癌癥相關(guān)死亡率的主要原因,在西方國家結(jié)腸癌占惡性腫瘤死因的第3位[1]。在我國,據(jù)統(tǒng)計結(jié)直腸癌發(fā)病率為29.44/105,死亡率為14.23/105,且其發(fā)病率與死亡率呈逐步上升的趨勢[2]。Morson等研究者提出了腺瘤-癌演變學(xué)說[3],認為結(jié)直腸癌的發(fā)生起源于腺瘤的癌變,結(jié)直腸腺瘤屬癌前期病變,上皮細胞出現(xiàn)異常增殖,逐漸形成腺瘤性息肉組織,最終形成惡性腫瘤組織。近年來研究發(fā)現(xiàn)腫瘤浸潤轉(zhuǎn)移及局部復(fù)發(fā)是導(dǎo)致其治療失敗和患者死亡的主要原因,上皮-間質(zhì)轉(zhuǎn)化(epithelial-mesenchymal transition, EMT)是許多腫瘤侵襲和轉(zhuǎn)移早期的一個重要的過程[4],其中多個轉(zhuǎn)錄因子參與 EMT 的調(diào)節(jié)。
Twist1是一種堿性螺旋狀的轉(zhuǎn)錄因子,在惡性腫瘤疾病發(fā)生發(fā)展中發(fā)揮作用,還可明顯促進腫瘤出現(xiàn)侵襲和轉(zhuǎn)移等病理現(xiàn)象[5]。轉(zhuǎn)化生長因子β1(transforming growth factor β1,TGF-β1)則是具有多種生理學(xué)功能的多肽類生長因子,可有效抑制細胞生長,促進細胞間基質(zhì)的形成,與腫瘤疾病發(fā)生、發(fā)展存在密切的聯(lián)系[6]。上皮性鈣黏蛋白(E-cadherin)是一種鈣黏蛋白,其表達水平降低可導(dǎo)致上皮細胞之間的黏附能力明顯喪失、極性消失,使得腫瘤細胞遷移能力顯著性增強,最終導(dǎo)致腫瘤出現(xiàn)侵襲和轉(zhuǎn)移等[7]。本研究擬檢測E-cadherin、TGF-β1和Twist1在結(jié)直腸癌組織中的表達,并探討其臨床意義。
1 資料與方法
1.1 臨床資料
選擇我院2016年1月~2017年12月間手術(shù)切除、病理證實為結(jié)直腸癌(腺癌) 的標本70例,其中男性45例,女性25例,年齡18~80 歲,組織病理學(xué)確定病理類型、分化程度、浸潤深度、微浸潤情況及有無局部淋巴結(jié)轉(zhuǎn)移。組織分化程度:高、中、低分化分別36、20、14例;浸潤深度: 至或者穿透漿膜層的42 例,到達肌層的28 例;有局部淋巴結(jié)轉(zhuǎn)移的26 例,無轉(zhuǎn)移的44例;30 例癌旁正常組織取自距腫瘤邊緣5 cm 以上黏膜;結(jié)直腸高級別上皮內(nèi)瘤變60例,結(jié)直腸低級別上皮內(nèi)瘤變60例。
1.2 研究方法
采用免疫組織化學(xué)方法檢測各組E-cadherin、TGF-β1和Twist1表達水平,將所有切除后新鮮標本固定在10%中性緩沖甲醛固定液中,取出標本,經(jīng)脫水、透明、浸蠟、包埋等步驟后,切片,片厚3μm,測定時進行二甲苯脫蠟及梯度乙醇水化,3%過氧化氫浸泡10min滅活內(nèi)源性過氧化物酶,檸檬酸緩沖液( pH 6.0±0.1)高溫修復(fù)抗原;使用一抗分別為:兔抗人TGF-β1單克隆抗體(購自武漢博士德生物技術(shù)有限公司,工作液濃度為1∶200) 、兔抗人Twist1多克隆抗體(購自上海愛必信生物技術(shù)有限公司,工作液濃度為1∶1600) 、鼠抗人E-cadherin單克隆抗體(購自福州邁新生物有限公司, 即用型),使用二抗是即用型免疫組化EliVision檢測試劑盒(購自福州邁新生物有限公司)。采用EnVision二步法:滴加一抗,4℃冰箱孵育過夜;滴加二抗,37°C孵育30min;各步驟間均以0.01 mol /L PBS 緩沖液沖洗,嚴格按照說明控制時間和溫度;DAB顯色、蘇木素輕微襯染、脫水、透明、中性樹膠封片,用PBS代替一抗作陰性對照,用已知陽性切片作為陽性對照,顯微鏡觀察。
1.3 判斷標準
E-cadherin和TGF-β1按Shimizu[8]方法對每張切片陽性細胞的著色程度進行分析,分為著色、淡黃色、棕黃色、棕褐色,分別計為0、1、2、3分,著色陽性面積按無著色、著色面積<1/3、1/3~2/3、>2/3分別計0、1、2和3分,根據(jù)著色程度和著色面積積分之和判斷最終實驗結(jié)果:≥3分為陽性,<3分為陰性,隨機選擇5個視野,取其平均值。Twist1主要表達于細胞核,根據(jù)陽性細胞數(shù)的比例將染色結(jié)果分為陽性與陰性[9]:即陽性細胞數(shù)0~10%為陰性,陽性細胞數(shù)>10%為陽性,所有切片由兩名具有豐富閱片經(jīng)驗的病理醫(yī)師以雙盲法予以判讀。
1.4 統(tǒng)計學(xué)方法
采用SPSS16.0軟件包對全部資料予以分析處理,計數(shù)資料采用χ2檢驗,相關(guān)性采用非參數(shù)Spearman等級進行相關(guān)分析,以P<0.05表示差異有統(tǒng)計學(xué)意義。
2 結(jié)果
2.1 各組E-cadherin、TGF-β1和Twist1陽性率比較
E-cadherin、TGF-β1和Twist1蛋白在不同組織中的表達結(jié)果見圖1。免疫組化結(jié)果顯示了3種蛋白在癌組織中的定位:E-cadherin在正常細胞主要定位于細胞膜,而在腫瘤細胞定位于細胞膜和細胞質(zhì), TGF-β1定位于癌細胞的細胞質(zhì)中,而Twist1表達定位主要存在于癌細胞細胞核中,部分細胞質(zhì)也有表達。
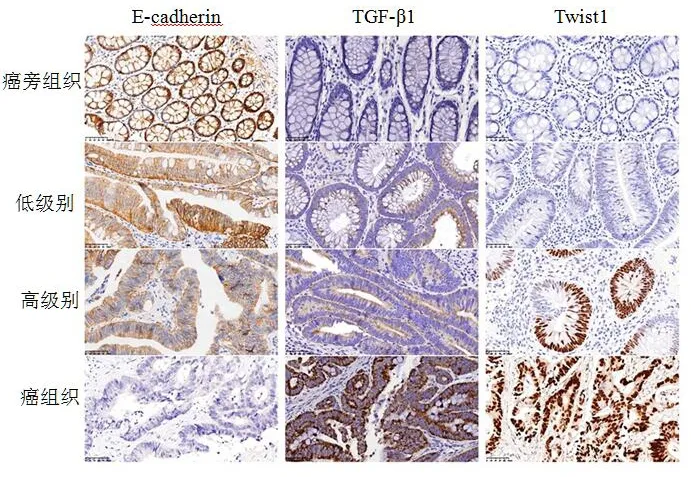
圖1 結(jié)直腸癌組織、高級別上皮內(nèi)瘤變組織、低級別上皮內(nèi)瘤變組織、癌旁組織中E-cadherin、TGF-β1和Twist1蛋白表達差異(免疫組化SP×200)
免疫組化結(jié)果顯示各組E-cadherin、TGF-β1和Twist1陽性率比較均有顯著性差異(P<0.05),且隨著結(jié)直腸癌組織、高級別上皮內(nèi)瘤變組織、低級別上皮內(nèi)瘤變組織、癌旁組織,E-cadherin陽性率明顯升高(P<0.05),而TGF-β1和Twist1陽性率明顯降低(P<0.05),見表1。
2.2 結(jié)直腸癌E-cadherin、TGF-β1和Twist1表達與臨床病理特征的關(guān)系
結(jié)直腸癌E-cadherin、TGF-β1和Twist1表達在分化程度、Duke分期、浸潤深度、淋巴結(jié)轉(zhuǎn)移等方面均存在顯著性差異(P<0.05),而在性別、年齡等方面無明顯差異(P>0.05),見表2。
2.3 結(jié)直腸癌E-cadherin、TGF-β1和Twist1表達之間的相關(guān)性分析
結(jié)直腸癌E-cadherin與TGF-β1、Twist1均呈負相關(guān)性關(guān)系(r=-0.632,-0.584,P<0.05),TGF-β1與Twist1呈正相關(guān)性關(guān)系(r=0.617,P<0.05)。
表1 各組E-cadherin、TGF-β1和Twist1陽性率比較(%)

組別例數(shù)Cadherin陽性率TGF-β1陽性率Twist1陽性率結(jié)直腸癌組織7042.86(30/70)85.71(60/70)80.0(56/70)高級別上皮內(nèi)瘤變組織6061.67(37/60)*68.33(41/60)*63.33(38/60)*低級別上皮內(nèi)瘤變組織6075.0(45/60)*#50.0(30/60)*#45.0(27/60)*#癌旁組織30 90.0(27/30)*#▲33.33(10/30)*#▲30.0(9/30)*#▲
注:*與結(jié)直腸癌組織比較,P<0.05;#癌旁組織、低級別上皮內(nèi)瘤變組織與高級別上皮內(nèi)瘤變組織比較,P<0.05;▲癌旁組織與低級別上皮內(nèi)瘤變組織比較,P<0.05。
表2 結(jié)直腸癌E-cadherin、TGF-β1和Twist1表達與臨床病理特征的關(guān)系
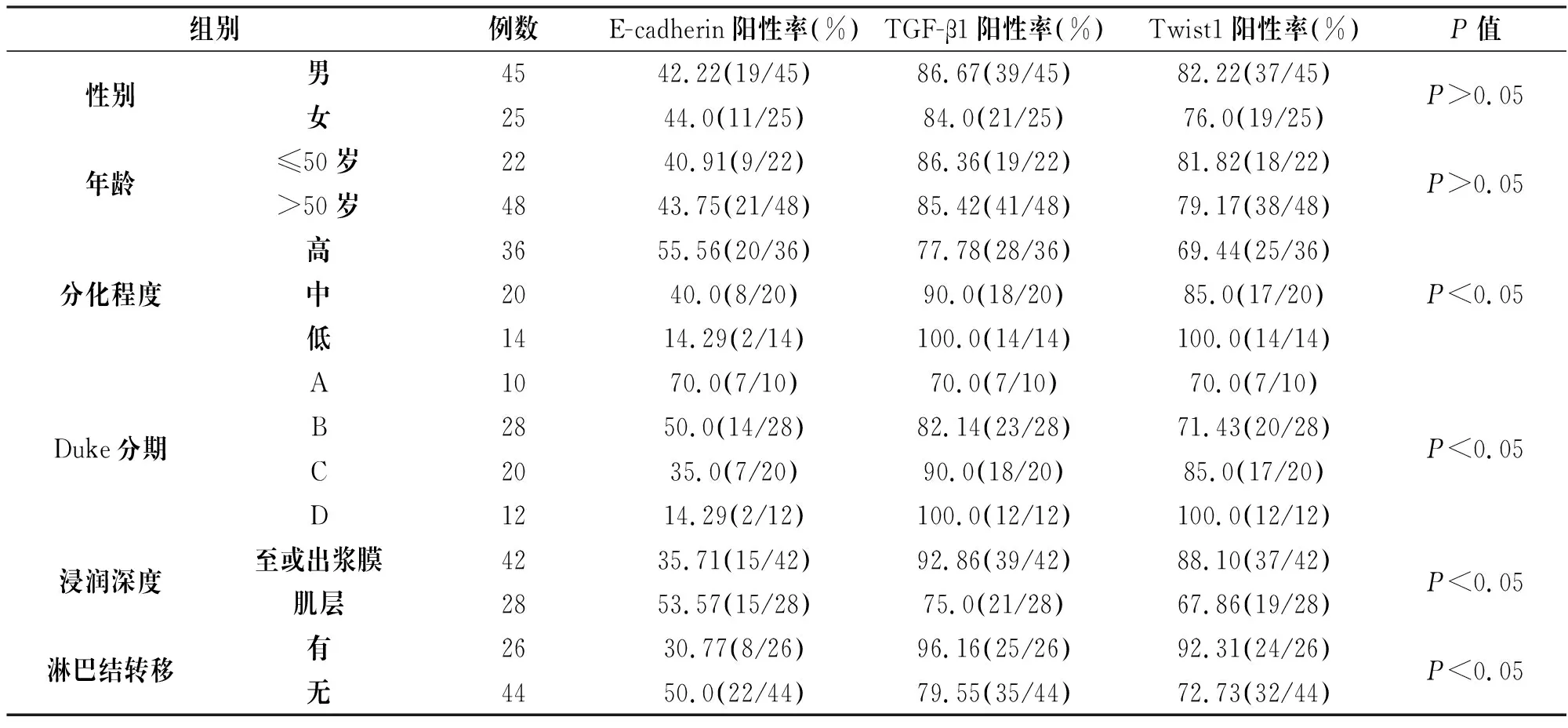
組別例數(shù)E-cadherin陽性率(%)TGF-β1陽性率(%)Twist1陽性率(%)P值性別男4542.22(19/45)86.67(39/45)82.22(37/45)女25 44.0(11/25)84.0(21/25)76.0(19/25)P>0.05年齡≤50歲2240.91(9/22)86.36(19/22)81.82(18/22)>50歲4843.75(21/48)85.42(41/48)79.17(38/48)P>0.05分化程度高3655.56(20/36)77.78(28/36)69.44(25/36)中2040.0(8/20)90.0(18/20)85.0(17/20)低1414.29(2/14)100.0(14/14)100.0(14/14)P<0.05Duke分期A1070.0(7/10)70.0(7/10)70.0(7/10)B2850.0(14/28)82.14(23/28)71.43(20/28)C2035.0(7/20)90.0(18/20)85.0(17/20)D1214.29(2/12)100.0(12/12)100.0(12/12)P<0.05浸潤深度至或出漿膜4235.71(15/42)92.86(39/42)88.10(37/42)肌層2853.57(15/28)75.0(21/28)67.86(19/28)P<0.05淋巴結(jié)轉(zhuǎn)移有2630.77(8/26)96.16(25/26)92.31(24/26)無4450.0(22/44)79.55(35/44)72.73(32/44)P<0.05
3 討論
E-cadherin是鈣黏蛋白家族成員之一,是一類Ca依賴的糖蛋白,在上皮細胞中起著維持細胞極性及黏附力的作用,維持正常組織和器官的結(jié)構(gòu)和功能,EMT過程中會出現(xiàn)上皮性標記物喪失,最典型就是E-cadherin蛋白的丟失,導(dǎo)致上皮細胞之間的黏附力喪失、極性消失,使細胞的遷移能力增強,導(dǎo)致侵襲和轉(zhuǎn)移[10]。Twist1為在果蠅、鼠、人等生物體內(nèi)的一種堿性螺旋轉(zhuǎn)錄因子,主要表達于胎盤、胚胎中胚層和成人的某些中胚層來源的未分化組織。最近研究發(fā)現(xiàn),Twist1具有癌基因的特征,能夠抑制腫瘤細胞凋亡,參與腫瘤細胞周期的調(diào)控,并通過調(diào)解腫瘤細胞上皮-間質(zhì)轉(zhuǎn)化(epithelial-mesenchymal transition, EMT)等參與了惡性腫瘤的發(fā)生,并且促進腫瘤侵襲轉(zhuǎn)移[11]。Valdés-Mora等[5]使用實時定量PCR技術(shù)檢測了54例結(jié)直腸癌及其癌旁正常黏膜Twist1的mRNA表達,發(fā)現(xiàn)結(jié)直腸癌Twist1的mRNA表達顯著高于正常黏膜組織表達, 并且其表達還與腫瘤淋巴結(jié)轉(zhuǎn)移呈顯著正相關(guān),提示Twist1是結(jié)直腸癌演進過程中一個重要因子。TGF-β1是一類具有多種功能的多肽類生長因子,主要功能是抑制細胞生長,促進基質(zhì)形成,與腫瘤發(fā)生、發(fā)展密切相關(guān),其以自分泌或旁分泌方式產(chǎn)生,生物學(xué)作用多樣,能調(diào)節(jié)細胞增殖、分化、形態(tài)形成及刺激細胞外基質(zhì)分泌、抑制免疫反應(yīng)等[12, 13]。研究認為[1],TGF-β1 作為 EMT 發(fā)生的一個主要誘導(dǎo)劑,與E-cadherin的轉(zhuǎn)錄啟動序列E-box結(jié)合,抑制E-cadherin的轉(zhuǎn)錄,通過改變細胞形態(tài)變化、上調(diào)間質(zhì)細胞標記(vimentin、fibronectin)表達及下調(diào)上皮細胞標記 E-cadherin表達來誘導(dǎo)癌細胞發(fā)生EMT,而Twist1作為TGF-β1 信號途徑的下游信號因子,我們推測TGF-β1可能是通過轉(zhuǎn)錄激活Twist1的表達,進而發(fā)揮其對EMT標記蛋白的轉(zhuǎn)錄調(diào)節(jié)。 Fan等[14]對193 例結(jié)直腸癌患者組織進行免疫組化檢測發(fā)現(xiàn),Twist1的異位表達可降低E-cadherin的表達,誘導(dǎo)EMT產(chǎn)生,從而促進癌細胞侵襲轉(zhuǎn)移能力的增強,結(jié)合前面的實驗,隨著結(jié)直腸癌組織、高級別上皮內(nèi)瘤變組織、低級別上皮內(nèi)瘤變組織、癌旁組織,E-cadherin陽性率明顯升高(P<0.05),而TGF-β1和Twist1陽性率明顯降低(P<0.05),這表明Twist1、TGF-β1 的高表達以及E-cadherin的低表達在誘導(dǎo)結(jié)直腸癌細胞EMT過程中發(fā)揮一定作用,這一現(xiàn)象的發(fā)現(xiàn)可為我們后期探討結(jié)直腸癌癌變的分子機制提供必要的理論基礎(chǔ)。
本次實驗結(jié)果我們發(fā)現(xiàn)結(jié)直腸癌E-cadherin、TGF-β1和Twist1表達在分化程度、Duke分期、浸潤深度、淋巴結(jié)轉(zhuǎn)移等方面均存在顯著性差異(P<0.05),且結(jié)直腸癌E-cadherin與TGF-β1、Twist1均呈負相關(guān)性關(guān)系(P<0.05),TGF-β1與Twist1呈正相關(guān)性關(guān)系(P<0.05),這與國內(nèi)外文獻報道基本一致[10,13]。綜上所述,E-cadherin、TGF-β1和Twist1三者與結(jié)直腸癌的發(fā)生發(fā)展等生物學(xué)行為密切相關(guān),通過檢測結(jié)直腸組織E-cadherin、TGF-β1和Twist1的表達有可能為判斷結(jié)直腸癌的惡性程度及患者的預(yù)后提供線索并且有助于早期診斷結(jié)直腸癌和指導(dǎo)臨床治療。