GLP-1重組減毒沙門菌治療對2型糖尿病小鼠的Caveolin-1及胰島β細胞自噬相關因子的影響
高蕓 康林 祝瑩 黃瑾
(雅安市人民醫院干部內科, 四川 雅安 625000)
胰高血糖素樣肽-1(GLP-1,Glucagon like peptide-1)是人體內重要的激素,主要由小腸L細胞合成并分泌,可有效作用于胰島β細胞,促進釋放胰島素,實現有效控制機體內胰高血糖素水平[1]。人體內GLP-1可有效改善氧化應激和炎癥損傷,有效保護胰島細胞,并可有效抑制胰島細胞凋亡和氧化[2]。現階段,臨床常采用皮下注射方式進行GLP-1類藥物治療,因而常導致患者長期治療依從性較差。近年,基因治療日益成為臨床新興的治療手段,其可特異性編碼某種蛋白質,并利用口服灌胃方式將重組表達載體置入體內,可有效實現在宿主細胞內表達基因,起到治療和預防疾病的作用[3]。一般情況下,由于減毒沙門菌可通過腸壁M細胞到達Peyer淋巴結,可在腸系膜相關淋巴組織中進行定位,并經淋巴結侵襲達脾臟、肝臟等腫瘤組織和器官,有效刺激呈遞基因、機體免疫等作用[4]。既往研究結果顯示,結腸癌、黑色素瘤、肺癌及胃癌等患者采用重組減毒沙門菌治療具有較高臨床療效[5]。但現階段GLP-1重組減毒沙門菌的應用仍鮮有報道。本研究采用GLP-1重組減毒沙門菌對2型糖尿病小鼠干預,分析GLP-1重組減毒沙門菌治療對2型糖尿病小鼠的Caveolin-1、胰島β細胞自噬相關因子的影響。
1 資料與方法
1.1 實驗動物 選取40只SPF級昆明種健康清潔級4周齡小鼠,分為正常組、對照組、空載組及治療組,每組各10只。所有小鼠均在SPF級實驗條件喂養,所有小鼠、飼料及墊料均購買自南京大學模式動物中心,自由攝食及飲水,環境溫度24~26 ℃,本研究經雅安市人民醫院動物倫理委員會批準。
1.2 實驗方法
1.2.1 儀器與試劑 本組研究中所用血糖儀購買自美國強生公司,鏈脲佐菌素(STZ,Streptozotocin)購買自美國Sigma公司。
1.2.2 質粒于菌株 GLP-1蛋白質粒pcDNA3.3-GLP1、減毒沙門氏菌菌株Ty21a控pcDNA3-flag均購買自上海生工生物有限公司。
1.2.3 重組減毒沙門菌構建 本組研究中使用構建好的質粒制備減毒沙門菌感受態,將50μL減毒沙門菌感受態細胞及1μL質粒置于電擊杯中,后將參數設定為0.8 ms,2399V進行電轉化。電轉成功后挑選單克隆菌種,提取DNA擴增,后行鑒定。鑒定成功后涂板,過夜挑選菌種,鑒定克隆菌中是否存在GLP-1基因。
1.2.4 造模及分組造模 小鼠適應性喂養一周后,將小鼠分為造模30只,10只正常培養作為正常組。造模小鼠給予60%高脂飼料,正常組小鼠給予10%低脂對照飼料,均輻照飼料,定時更換鼠水、鼠籠及飼料,4周后過夜禁食,空腹12小時以上,稱量空腹體質量并記錄,后空腹注射STZ(65 mg/kg),72小時后,使用微量血糖儀檢測空腹血糖,血糖≥11.1mol/L則判定為造模成功,成功后分為對照組、空載組及治療組。
1.2.5 重組減毒沙門菌干預 造模成功120小時后進行干預,正常組每組灌胃100 μL 5% NaHCO3溶液、對照組每組灌胃100 μL 5% NaHCO3溶液、空載組每只灌胃100 μL pcDNA3減毒沙門菌,菌液濃度109/mL、治療組每只灌胃100 μL pcDNA3-GLP-1減毒沙門菌,菌液濃度109/mL,所有組別均治療28天。
1.3 檢測指標 在造模前、造模成功后及治療結束后進行眼眶取血0.5 mL,使用血糖儀檢測血中血糖水平。在治療結束后使用水合氯醛麻醉后斷頭處死,冰上解剖并分離胰腺組織,使用液氮保存并標記。取胰腺組織分成兩塊,使用RIPA裂解液提取總蛋白,后使用Western Blot法檢測Caveolin-1及β-actin水平,并使用Caveolin-1/β-actin表示Caveolin-1水平。取另一塊胰腺組織使用RT-PCR法檢測β胰島細胞中Atg3、Atg12及Beclin1 mRNA水平,本組研究反應體系26.5 μl,其中上下游引物各1μl(5 μmol/L),Sybr Premix Ex Taq 13 μl,cDNA 2.5 μl,滅菌水9 μl,選擇GAPDH作為管家基因,計算各mRNA相對表達量。所用試劑盒購買自羅氏公司,見表1。

表1 引物表Table 1 The primers
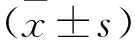
2 結果
2.1 治療前后各組血糖水平檢測結果 治療后治療組小鼠血糖水平顯著低于對照組及空載組,差異有統計學意義(P<0.05),見表2。

表2 治療前后各組血糖水平檢測結果Table 2 Blood glucose levels before and after treatment
注:治療組與對照組、空載組比較,①P<0.05
2.2 治療后各組胰島Caveolin-1水平檢測結果 治療后,治療組小鼠胰島Caveolin-1水平顯著高于對照組及空載組,差異有統計學意義(P<0.05),對照組及空載組Caveolin-1水平無明顯差異(P>0.05),見表3。

表3 治療后各組Caveolin-1水平檢測結果Table 3 Caveolin-1 levels after treatment
注:治療組與對照組、空載組比較,①P<0.05
2.3 治療后各組自噬相關因子表達水平檢測結果 治療后,治療組小鼠胰島Atg3、Atg12及Beclin1水平顯著低于對照組及空載組(P<0.05),對照組及空載組Atg3、Atg12及Beclin1水平無明顯差異(P>0.05),見表4。

表4 治療后各組自噬相關因子表達水平檢測結果Table 4 levels of autophagy related factors after treatment
注:治療組與對照組、空載組比較,①P<0.05
3 討論
隨著我國人民生活水平不斷提高,人口老齡化趨勢的不斷加重,膳食結構不斷改變,我國2型糖尿病的臨床發病率逐漸增加,且存在諸多糖尿病前期患者,因此,2型糖尿病的臨床及日常防治趨勢日益嚴峻。有研究顯示,在2型糖尿病的發生及發展過程中,胰島素功能障礙及胰島素抵抗起到十分重要的作用,在發病過程中可能伴有胰島細胞凋亡、持續性損害及胰島功能衰退[6]。一般情況下,在對2型糖尿病患者進行治療時側重于控制血糖水平,但并未有效控制糖尿病的癥狀及多種并發癥,且無法實現從根本上緩解胰島功能,也無法有效促進胰島細胞增殖[7]。此外,在傳統療法的長期治療過程中可能導致低血糖、體重增加及胰島細胞功能衰竭等諸多不良反應。在防治2型糖尿病時,有效降低血糖同時促進β細胞增殖抑制其凋亡并保護胰島功能是最佳途徑[8]。與傳統的胰島素治療及降糖藥治療方案相比,GLP-1類似物治療具有諸多優點,其可使胰島β細胞有效避免炎癥和高糖損害,刺激增殖[9]。采用GLP-1類似物治療后可顯著改善胰島素抵抗,提高外周組織敏感性,延緩胃排空,抑制食欲,盡可能避免吸收能量物質,有助于控制體重和血糖[10]。此外,GLP-1類似物可有效改善糖化血紅蛋白等中長期生化指標,促進胰島素分泌,避免發生低血糖,改善神經營養,提高抗炎能力,提高長期使用安全性[11]。現階段,國內外GLP-1類似物多采用化學合成,其純化相對困難、工藝復雜、價格昂貴、生產成本高,因而常需皮下注射,導致治療依從性較差。因此臨床中亟待研究廉價、高效的GLP-1類似物以對2型糖尿病進行治療。
現階段常采用STZ誘導小鼠糖尿病模型應用于2型糖尿病,GLP-1類似物藥物可顯著控制STZ誘導糖尿病小鼠血糖,改善胰島損傷[12]。本組研究結果顯示,采用構建編碼GLP-1序列質粒并轉入減毒沙門菌中,后灌胃治療,結果顯示GLP-1重組減毒沙門菌有較理想的降糖效果,改善糖尿病小鼠的體重變化及多食多飲癥狀。Caveolin-1在機體內以二聚體形式存在,主要存在于小凹結構細胞膜側,隨著研究深入,其糖代謝作用逐漸被解釋。有研究顯示,Caveolin-1在糖代謝過程中逐漸被廣泛認識,敲除Caveolin-1后,小鼠可見脂肪組織萎縮,在正常飲食干預后仍會出現胰島素抵抗,提示機體胰島素敏感性與Caveolin-1密切相關[13]。本組研究結果顯示,采用GLP-1重組減毒沙門菌治療后,可有效改善Caveolin-1水平,改善胰島素抵抗,提高治療效果。機體自噬可有效利用細胞因子或高分子蛋白與自噬溶酶體和細胞器相互作用,溶解細胞,促使胰島細胞凋亡,Atg3、Atg12、Beclin-1蛋白有利于自噬體的形成,影響細胞凋亡[14-15]。其中,Beclin-1是機體內重要的自噬相關基因,有效調節并促進溶酶體膜和自噬泡膜相互融合,并與Bcl-1相互作用影響凋亡,進而造成胰島細胞凋亡[16]。Atg12屬泛素樣蛋白成員,介導自噬體膜拓展,Mcl-1蛋白與BH3樣結構域結合,影響細胞凋亡[17-18]。LC3-1脂溶性反應在Atg3催化下可進一步加速,并與Atg12形成復合物,誘導細胞凋亡[19-20]。本組研究結果顯示,GLP-1重組減毒沙門菌治療后,可有效改善Atg3、Atg12及Beclin-1水平,改善胰島細胞凋亡,保證胰島β細胞合成胰島素及分泌能力,阻滯細胞自噬,實現抑制胰島細胞凋亡,實現治療糖尿病;移植GLP-1重組減毒沙門菌可有效調節小鼠體內Caveolin-1、Atg3、Atg12及Beclin-1蛋白水平,進而起到降低STZ誘發糖尿病小鼠體內血糖的作用。
4 結論
采用GLP-1重組減毒沙門菌治療可有效改善2型糖尿病小鼠Caveolin-1及胰島β細胞自噬相關因子表達,具有較廣的應用價值。但口服重組減毒沙門菌后的體內分布情況及胃腸道環境對減毒沙門菌的影響尚待深入研究,且研究移植GLP-1重組減毒沙門菌后,影響Caveolin-1、Atg12及Beclin1水平的機制,亦有待后續深入拓展研究。

