α-硫辛酸用于2型糖尿病周圍神經病變患者的臨床療效*
楊雨平 林東源 葉健波 林華征 楊吉
(1.貴港市人民醫院內分泌科,廣西 貴港 537100;2.廣西醫科大學第一附屬醫院內分泌科,廣西 南寧 530021 )
2型糖尿病周圍神經病變是糖尿病的并發癥之一,其病理主要包括節段性、軸突萎縮變性、彌漫性脫髓鞘病變。臨床主要表現為肢體疼痛、麻木、感覺減退等,嚴重影響患者的日常生活[1]。其發病機制目前尚未明確,但普遍認為與機體代謝紊亂、神經營養不足、氧化應激反應等因素有關[2]。甲鈷胺為治療糖尿病神經病變較為常用的藥物,具有促進神經元髓鞘形成作用。但有研究顯示,甲鈷胺對改善患者四肢麻木、疼痛等癥狀并不顯著[3]。因此,尋找一種新的藥物治療糖尿病神經病變具有十分重要的臨床意義。α-硫辛酸有較強的抗氧化性,在神經傳導速度方面具有改善作用。其他國家醫學界已經將此藥物用于治療糖尿病周圍神經病變[4-5],國內對于α-硫辛酸治療2型糖尿病周圍神經病變鮮有報道。為明確α-硫辛酸在2型糖尿病周圍神經病變中的作用,本研究旨在觀察α-硫辛酸治療2型糖尿病周圍神經病變患者的臨床研究及對血清載脂蛋白a 、sVCAM-1和8-ISO-PGF2α水平的影響,現將結果報告如下。
1 資料與方法
1.1 一般資料 納入我院就診的2型糖尿病周圍神經病變患者142例,分為觀察組和對照組,每組各62例,觀察組男34例,女28例;年齡43~65歲;BMI為19.53~30.43 kg/m;DM病程3~12年;DPN病程1~4年;對照組男32例,女30例;年齡45~67歲;BMI為20.43~29.63 kg/m;DM病程4~11年;DPN病程1.5~5年。納入標準:①符合2型糖尿病診斷標準并確診,即隨機血糖高于11.1mmol/L,或空腹血糖高于7.0mmol/L,或餐后2h血糖高于11.1mmol/L。②臨床癥狀符合周圍神經病變,即具有明確的糖尿病病史或有糖代謝異常的癥狀。以下5項檢查中有2項或2項以上癥狀出現:溫度覺異常;尼龍絲檢查,足部感覺減退或消失;振動覺異常;踝反射消失;神經傳導速度有2項或2項以上減慢。排除標準:①患有其他嚴重系統疾病。②在本治療前一個月內使用過其他藥物治療。③其他原因導致周圍神經病變者。兩組患者一般資料差異無統計學意義,具有可比性(P>0.05),見表1。本研究患者均知情并簽署知情同意書,同時獲得我院倫理委員會的批評。

表1 2組患者的一般資料比較Table 1 Comparison of general information between the two groups
1.2 方法 所有患者行穩定血糖血脂、改善微循環等常規治療后,靜脈注射用甲鈷胺(臨沂仁華藥品有限責任公司,1ml:0.5mg,20140318)治療,取藥品1mg混合于250ml生理鹽水給予患者靜脈滴注,1次/天;觀察組在此基礎上加用0.45g α-硫辛酸(中山市三才醫藥集團有限公司,12ml:0.3g,20140512)混合于250ml生理鹽水使用避光輸液器給患者進行靜脈滴注,時間25~35min,1次/天,兩組均治療15天。
1.3 觀察指標 觀察兩組治療后臨床療效,并在治療前后對所有患者進行TSS評分,分析兩組治療前后運動神經傳導速度、感覺神經傳導速度以及血清載脂蛋白a (Apolipoprotein a,Apo-a)、可溶性血管細胞黏附分子1(Soluble vascular cell adhension molecule-1,sVCAM-1)和8-異前列腺素F2α(8-Iso-prostaglandin F2α,8-ISO-PGF2α)水平變化。臨床療效:①顯效:治療后,患者臨床癥狀基本消失,深淺感覺基本正常,神經傳導速度基本恢復正常。②有效:治療后,患者臨床癥狀改善明顯、深淺感覺有明顯恢復,神經傳導速度明顯增加。③無效:治療后,患者各項癥狀并無改善。于治療前后抽取所有患者清晨空腹靜脈血3ml,離心處理并取血清置于-30℃環境中待檢。采用全自動分析儀檢測血清Apo-a水平, 血清sVCAM-1、8-ISO-PGF2α水平采用雙抗夾心酶聯免疫吸附法檢測;使用肌電圖儀檢測神經傳導速度。
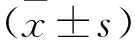
2 結果
2.1 兩組患者臨床療效比較 治療后,觀察組總有效率顯著高于對照組,差異有統計學意義(P<0.05),見表2。

表2 兩組患者臨床療效比較[n×(10-2)]Table 2 Comparison of efficacy of the two groups
注:與對照組相比較, ①P<0.05
2.2 TSS評分比較 治療前,兩組患者疼痛、麻木、燒灼感、感覺異常評分比較差異無統計學意義(P>0.05);治療后,兩組患者評分均顯著降低(P<0.05),觀察組患者評分較低,與對照組比較,差異有統計學意義(P<0.05),見表3。

表3 兩組治療前后TSS評分比較Table 3 Comparison of TSS score between the two groups before and after treatment
注:與對照組相比較,①P<0.05;同組治療前相比較, ②P<0.05
2.3 運動神經傳導速度比較 治療前,兩組患者腓總神經、脛神經、正中神經、尺神經傳導速度差異無統計學意義(P>0.05);治療后,兩組患者運動神經傳導速度均顯著提高(P<0.05),且觀察組患者運動神經傳導速度顯著高于對照組(P<0.05),見表4。
2.4 感覺神經傳導速度比較 治療前,兩組患者腓淺神經、腓腸神經、正中神經、尺神經傳導速度無顯著差異(P>0.05);治療后,兩組患者感覺神經傳導速度均顯著提高(P<0.05),且觀察組患者感覺神經傳導速度顯著高于對照組(P<0.05),見表5。

表4 兩組治療前后運動神經傳導速度比較Table 4 Comparison of motor nerve conduction velocity between the two groups before and after treatment
注:與對照組相比較,①P<0.05;同組治療前相比較,②P<0.05

表5 兩組治療前后感覺神經傳導速度比較Table 5 Comparison of sensory nerve conduction velocity between the two groups before and after treatment
注:與對照組相比較,①P<0.05;同組治療前相比較, ②P<0.05
2.5 血清Apo-a、sVCAM-1、8-ISO-PGF2α水平比較 治療前,兩組患者血清Apo-a、sVCAM-1、8-ISO-PGF2α水平差異無統計學意義(P>0.05);治療后,兩組患者血清Apo-a、sVCAM-1、8-ISO-PGF2α水平均明顯改善(P<0.05),與對照組相比,觀察組患者血清Apo-a水平較高,且血清sVCAM-1、8-ISO-PGF2α水平較低(P<0.05),見表6。

表6 兩組治療前后血清Apo-a、sVCAM-1、8-ISO-PGF2α水平比較Table 5 Comparison of the serum Apo-a, sVCAM-1, 8-ISO-PGF2αlevels between the two groups before and after treatment
注:與對照組相比較,①P<0.05;同組治療前相比較, ②P<0.05
2.6 血壓與血脂水平比較 治療前后,兩組患者收縮壓、舒張壓及甘油三酯水平均差異無統計學意義(P>0.05);治療后,觀察組總膽固醇水平明顯降低(P<0.05),對照組治療前后則無明顯變化(P>0.05),見表7。

表7 兩組治療前后血壓與血脂水平比較Table 5 Comparison of the blood pressure and blood fat levels between the two groups before and after treatment
注:同組治療前相比較, ①P<0.05
2.7 血糖水平比較 治療前后,兩組患者空腹血糖及餐后2小時血糖水平均無變化,差異無統計學意義(P>0.05),見表8。

表8 兩組治療前后血糖水平比較Table 8 Comparison of blood glucose levels
3 討論
2型糖尿病周圍神經病變是影響糖尿病患者生活質量下降、致殘的一個重要因素,其發病機制通常認為由代謝紊亂、氧化應激、免疫因素、神經營養因子不足、血管受損等多因素共同導致的結果[6]。有學者通過研究顯示,糖尿病患者體內的醛糖還原酶具有較強的活性,而高活性的醛糖還原酶是糖尿病周圍神經病變發生發展的一個重要因素[7-8]。
sVCAM-1是粘附分子免疫球蛋白超家族中的成員之一,主要存在機體血管內皮細胞表面,可介導淋巴細胞、白細胞以及內皮細胞的粘附作用[9]。在正常情況下,其水平較低,當血管內皮細胞受損后可使水平增加。研究顯示,2型糖尿病周圍神經病變患者血清sVCAM-1水平均較高[10-12]。本研究與上述文獻結論一致。對于糖尿病患者而言,體內的氧自由基會因氧化應激增加,氧自由基以及糖基化總產物可使血管內皮細胞中的粘附分子表達增強,從而提高了血清sVCAM-1水平[13-14]。此外,高表達粘附分子可激活單核細胞,從而間接誘發血栓、血小板粘附,刺激血管平滑肌細胞使其增加,微血管阻塞導致周圍神經出現缺血缺氧癥狀,最終導致周圍神經病變[15]。目前對于sVCAM-1在糖尿病周圍神經病變中的作用機制尚未明確,筆者猜測可能與血管通透性增加、血小板聚集以及血栓的形成等原因有關。但sVCAM-1在糖尿病周圍神經病變中具有重要的作用,抑制其水平的增加是防治糖尿病周圍神經病變的有效措施。
8-ISO-PGF2α一種自由基催化生物膜上發生非酶促反應之后的特異性產物,具有介導血管內皮細胞以及DNA的合成,對血小板的聚集有促進作用,同時可選擇性的促進血管以及炎性反應等[16-17]。8-ISO-PGF2α在機體血清中相對穩定,特異性強,可靈敏反映出機體內氧化應激水平,且易檢測,因此臨床通常通過測定其水平高低判定氧化反應的相關疾病[18]。其水平的增高說明機體氧化應激反應的增加,反之降低[19]。本研究通過檢測糖尿病周圍神經病變患者血清8-ISO-PGF2α水平顯著升高,提示糖尿病周圍神經病變患者體內存在明顯的氧化應激[20]。Apo-a在構成血漿脂蛋白中為必不可少的部分,具有運載脂類物質以及穩定脂蛋白結構的功能;因Apo-a主要存在于HDL-C中,因此與HDL-C的意義相同,其水平降低時,會誘發神經病變等疾病[21-22]。而本研究中,患者在治療前后檢測血清Apo-a水平則較低,說明Apo-a為2型糖尿病周圍神經病變的保護因子。
甲鈷胺為一種內源性的輔酶B12,對神經組織內核酸與蛋白質的合成具有積極作用,修復受損的神經纖維,是臨床治療周圍神經病變的首選藥物[23-24]。但單用甲鈷胺在改善2型糖尿病周圍神經病變癥狀并不太理想[25]。因此,在治療上采用抗氧化劑可有效提高治療的效果[26]。α-硫辛酸是一種脂容性與水容性兼具的抗氧化物,可促進細胞對葡萄糖的吸收,從而調節血糖;能夠再生氧化物質以及清除自由基,對氧化應激具有抑制的效果,改善血管內皮細胞功能,使神經生長因子逐漸恢復正常,通常刺激神經纖維的再生,可改善2型糖尿病周圍神經病變癥狀;且可抑制炎癥因子的產生,對周圍神經的脫髓鞘病變具有明顯的改善效果,從而增加神經傳導速度[27-30]。本研究顯示,患者在使用甲鈷胺與α-硫辛酸聯合治療后,其疼痛、麻木、燒灼感、感覺異常癥狀得到了明顯的改善,且臨床療效也得到顯著提高。
4 結論
α-硫辛酸可通過降低氧化應激、調節代謝紊亂、改善血管內皮炎癥損傷等多重機制,降低2型糖尿病周圍神經病變患者血清sVCAM-1、8-ISO-PGF2α水平,增加血清Apo-a水平,改善患者臨床癥狀及神經傳導速度,顯著提高療效。

