基于雙旋轉波片法的癌變組織穆勒矩陣的測量研究*
王惠敏,黃丹飛△,鄒彤,李世維,鐘艾琦,王雄才
(1.長春理工大學生命科學技術學院,吉林 長春 130022;2.長春理工大學光電工程學院,吉林 長春 130022)
1 引 言
光和生物組織的相互作用在19世紀中期就開始被醫生定性地用于疾病檢測,對生物組織進行病理診斷時采用光學的方法會有許多優點,如無痛、無損以及非接觸等[1 - 2]。通常光在組織內傳播主要存在吸收和散射兩種形式,在可見光波段范圍內,生物組織大部分屬于高散射介質[3],因此,一般利用散射光對組織進行成像,以探測組織結構。在以往的普通光學成像中只是探測光波的強度信息,但作為光的固有屬性的偏振常被忽略。而偏振光在實際應用中具有重要的研究價值,其能夠闡明化學鍵的空間結構,揭露生物分子的不對稱特征,還有助于氣象學和天文學領域的研究,同時可以區分皮膚表面的正常和癌前細胞等[4]。
偏振測量能夠通過目標的偏振特性得到微觀結構和形態信息[5],同時,增強圖像對比度并提升成像分辨率使圖像更加清晰。相比于普通光學成像,偏振成像在獲取光強分布的基礎上增加了偏振信息維度,更容易得到目標物的結構信息,有效改善了傳統成像的不足[6 - 7]。生物組織本身的偏振特性可以由其穆勒矩陣充分表征,正常組織和癌變組織具有不同的偏振光學性質,我們試圖采用偏振成像技術,測量癌癥切片的穆勒矩陣,以探究穆勒矩陣偏振成像區分癌變和非癌變組織的能力。
目前,利用穆勒矩陣進行癌癥檢測的研究并不多,主要是清華大學實驗室搭建的穆勒矩陣成像系統,而該系統對樣品穆勒矩陣的獲取方法是HV法,通過測量36個反射率,將入射光以6種偏振態入射,相對應地6種偏振態出射,從而聯立36個方程組求得樣品的穆勒矩陣,但這種方法還需要旋轉起偏和檢偏模塊的兩個偏振片。而本研究采用雙旋轉波片法[8 - 9]固定偏振片,只旋轉1/4波片,搭建了一套穆勒矩陣成像系統,對肝癌、肺癌和胃癌三種病理組織切片進行穆勒矩陣測量。
2 穆勒矩陣成像系統設計
光路采用斜入射,正接收的方式,成像系統見圖1。CCD接收組織切片的背向散射光,散射光中的偏振成分攜帶了組織結構信息。
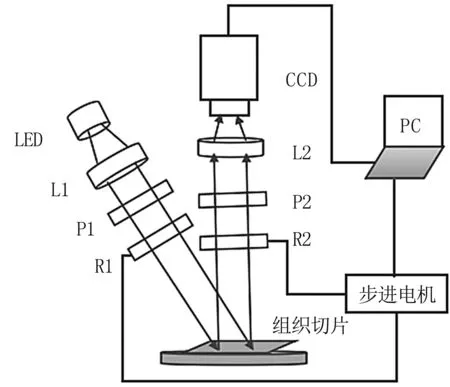
圖1 成像系統示意圖
其中,光源為中心波長630 nm,功率1 W的面光源LED;P1和P2分別為偏振片,R1和R2為1/4波片,采用武漢優光科技公司的632.8 nm波長的膠合真零級波片;CCD采用維視數字圖像技術有限公司的MV-VEM033SC,分辨率640×480;LED發出的光經過準直透鏡L1以及由P1和R1構成的起偏模塊照射到組織切片,然后由切片背向散射通過R2和P2組成的檢偏模塊,最后通過成像透鏡L2被CCD探測。
為了測量組織切片的穆勒矩陣,需調制入射和出射光的偏振態,使用Arduino Uno和步進電機作為偏振態調制的控制部件。實驗中,P1和P2固定且透光軸與水平方向平行,R1及R2的快軸與水平方向平行,步進電機以恒定的角速度帶動R1與R2按照1:5的角度旋轉。R1與R2從0°開始分別以6°和30°為步長進行旋轉,從而調制入射光和出射光的偏振態。調制期間CCD相應的采集30幅變換的光強圖像,根據光強傅里葉系數最后求得穆勒矩陣的各個元素。整個實驗裝置由計算機控制,一次穆勒矩陣的測量時間大約為2 min,在Matlab平臺上實現圖像采集和處理的過程。
3 實驗原理與系統誤差校正
3.1 穆勒矩陣測量原理
通常情況下,光的偏振態可由斯托克斯矢量法、邦加球法、瓊斯矢量法和三角函數法來描述[10],以上方法中,邦加球法直觀但不便于定量分析,瓊斯矢量法只能描述完全偏振光,而斯托克斯矢量法則能夠描述部分偏振光,完全偏振光以及非偏振光,考慮到光與組織切片的相互作用,采用斯托克斯矢量法描述入射光和出射光的偏振態。
一束光與目標相互作用后,偏振態將會發生改變。出射光的斯托克斯矢量通常可由目標的穆勒矩陣和入射光的斯托克斯矢量乘積求得,即S′=MS,M為目標的穆勒矩陣,表示目標的偏振光學特性,即對入射光偏振態的影響,S′和S分別代表出射光和入射光的斯托克斯矢量。
在圖1所示的光路系統中,入射光的斯托克斯矢量記為Sin;偏振片P1和P2固定其透光軸與水平方向平行,穆勒矩陣分別記為P1和P2,1/4波片R1和R2的快軸與水平方向的夾角分別為θ和5θ,穆勒矩陣分別記為R1和R2,切片的穆勒矩陣記為M,出射光的斯托克斯矢量記為Sout。則:
Sout=P2R2MR1P1Sin
(1)
這里將式(1)表示成:
Sout=AMP
(2)
A=P2R2;P=R1P1Sin;M為一個4×4的矩陣記為(mij)i,j=1,2,3,4;
Sout=[s0s1s2s3]TSin=[1 0 0 0]T
(3)
P1和P2[11]相等如下:
(4)
R1和R2[11]分別為式(5)和式(6):
(5)
(6)
因為出射光斯托克斯矢量的第一個分量即是CCD所探測到的光強,所以組織切片散射后的光強可由式(7)表示。其中ai為A的第一行元素,pi為P的所有元素。
(7)
可將該式表示成式(8)所示的形式:
(8)
由以上公式推導出:
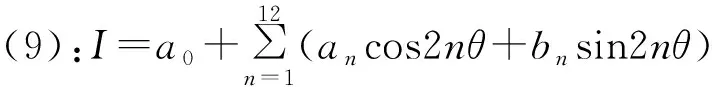
(9)
由此可以得到傅里葉系數即a0-a12,b1-b12與穆勒矩陣元素成函數關系,見表1。
表1a0-a12,b1-b12與穆勒矩陣元素的關系
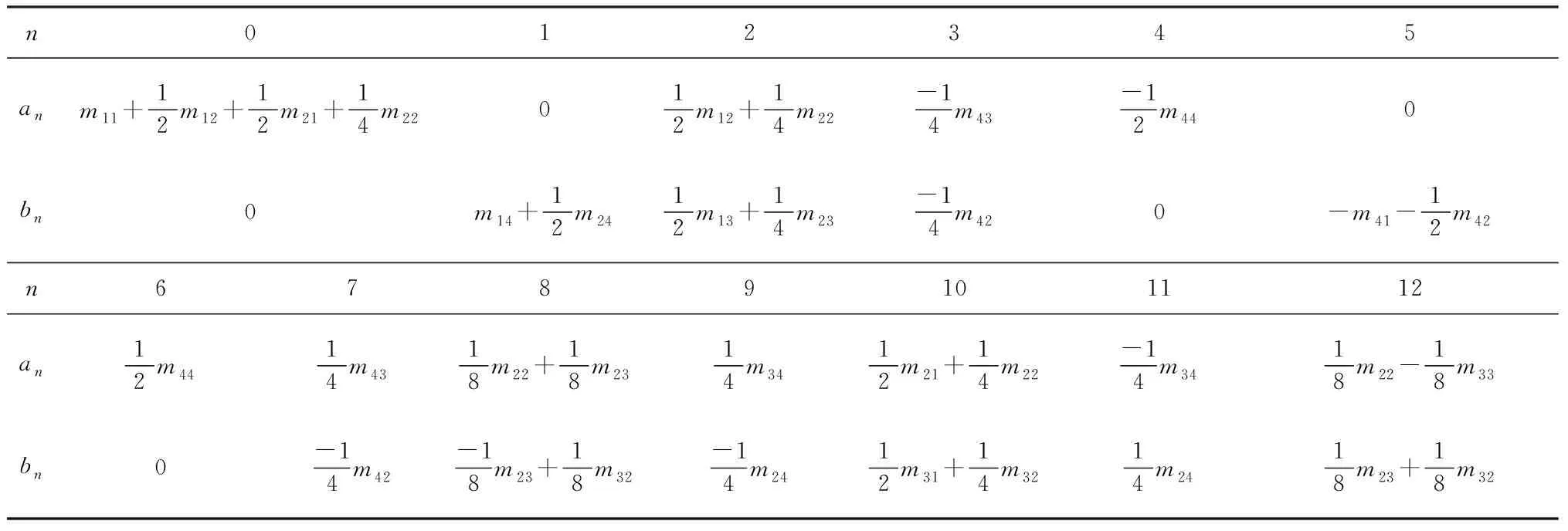
Table 1 Relationship of a0-a12,b1-b12and Mueller matrix elements
所以,求出光強的傅里葉系數便可求出介質的穆勒矩陣。
3.2 系統誤差校正
系統在運行時,對樣品的穆勒矩陣測量并不能達到理想的狀態,將上述實驗系統進行誤差分析,可以發現裝置關于光源的單色性、偏振片的透光軸、1/4波片的光軸及相位延遲以及CCD等方面可能存在系統誤差。通過測量空氣介質的穆勒矩陣,對成像裝置進行了誤差校正。
4 實驗結果
光與組織切片相互作用后其偏振態將會發生改變,偏振狀態的改變表達了組織的偏振特性。前人的研究結果指出穆勒矩陣的16個像元中,第一個像元m11代表目標對入射光強的散射或者反射能力,第一行的m12、m13及m14體現的是雙向衰減特性,第一列的m21、m31及m41為與偏振度有關的參數,其余九個像元則是和散射退偏及相位延遲有關的參量。分別針對肝癌,肺癌和胃癌組織進行測量,切片樣本均未染色且未加蓋玻片。圖2為肝癌的穆勒矩陣成像結果。


圖2 (a).未染色的肝癌切片,(b).肝癌組織的穆勒矩陣,(c).m23像元,(d).m44像元
圖(a)為測量所使用的未染色肝癌切片樣本,藍色標注區域大致為癌變組織,其余為非癌變組織。從圖(b)成像結果可以看出,穆勒矩陣包含了組織大量的結構信息,每個矩陣元表達的偏振特性不盡相同,除了體現強度特性的m11外,其中陣元m22、m33及m44和m23的值比較大,且這幾個陣元代表的偏振特性癌變與非癌變組織存在明顯差異。圖(c)中癌變的偏振特性值達到了0.3以上,而非癌變的幾乎為0;圖(d)中,癌變的值達到0.35左右,非癌變的值接近0.1。從以上肝癌的穆勒矩陣結果發現,癌變與非癌變組織在某些穆勒矩陣元中偏振特性有著顯著區別,穆勒矩陣可以輔助區分癌變與非癌變區域。
肺癌的偏振成像結果見圖3,圖(a)為測量使用的肺癌切片,藍色標注區域大致為癌變組織。圖(b)m31顯示的偏振特性癌變區域的值大部分接近0,右邊的正常組織則達到0.45左右;圖(c)m44像元體現的偏振特性左邊的癌變組織的值比右邊的正常組織整體偏低,基本趨近于0,右邊的非癌變組織的值近乎在0.18以上,此兩個像元表明可以輔助將癌變和非癌變區域加以區分。
圖4為胃癌組織切片的成像結果,圖(a)是測量的胃癌切片樣本,藍色曲線內大致為癌變組織,從圖(b)m13和圖(c)m44像元體現的偏振特性能夠看出癌變組織的整體高于非癌變組織,兩者的偏振特性差異明顯,同樣表明穆勒矩陣具有區分癌變和非癌變組織的潛力。



圖3 肺癌 (a).未染色切片,(b).m31像元,(c).m44像元



圖4 胃癌 (a).未染色切片,(b).m13像元,(c)m44像元
5 結論
本研究利用偏振成像的優勢,基于雙旋轉波片法搭建了一套穆勒矩陣自動測量系統,整體實驗裝置由計算機控制,介紹了裝置結構,測量原理及實驗過程。以肝癌,肺癌,和胃癌組織切片為實驗對象進行穆勒矩陣的測量,結果表明,成像系統運行良好,能夠正確測量組織切片的穆勒矩陣。通過對獲得的穆勒矩陣圖像進行分析,發現肝癌組織切片的m22、m23、m33和m44像元癌變區域與非癌變區域偏振信息差異顯著;肺癌的m31和m44像元體現的偏振特性癌變區域的整體表現比較低,非癌變區域則較高;胃癌的m13和m44像元顯示的偏振特性癌變組織整體偏高,而非癌變組織的整體偏低。通過以上實驗,可以發現某些像元中癌變和非癌變組織的偏振特性差異明顯,可以輔助區分癌變和非癌變組織,穆勒矩陣偏振成像在生物醫學領域將會有廣闊的發展前景。

