絲素蛋白基藥物緩釋功能腸道支架的研制
謝旭升,李 剛,王曉沁,趙澤宇,李 翼,蘭 平
(1.蘇州大學 a.紡織與服裝工程學院 ; b.現代絲綢國家工程實驗室, 江蘇 蘇州215123;2.曼切斯特大學 材料學院, 曼切斯特 M13 9PL 英國;3.中山大學 附屬第六醫院結直腸外科, 廣東 廣州 510655)
結直腸癌是人類第三大高發病率和死亡率的癌癥,且逐年增多,已經引起人們的廣泛關注[1-2]。其主要發病因素包括家族遺傳和不良飲食習慣如高脂肪、低纖維以及吸煙飲酒等,外界環境因素包括血吸蟲病、盆腔放射等[3-5]。腸梗阻是結直腸癌的常見癥狀之一,其發生率高達5%~20%,有時甚至為其首發癥狀,如果不進行干預治療,5年內患者的死亡率為80%~90%。針對腸癌患者,常用的治療方法是手術配合放化療治療[6-7]。然而,放化療引起的全身副作用大,危害患者的正常身體健康,而且化療藥物經代謝后,腫瘤部位的有效藥物濃度非常低,不能達到有效的治療效果[8-10]。對于腫瘤引起急性腸梗阻者,急診手術風險大、不能耐受手術者以及多發轉移和失去手術機會的晚期患者,放置腸道支架解除梗阻,進行姑息治療后再配合化療等輔助治療手段,是一個有效的治療思路[11]。
支架植入作為一種新興的治療結直腸癌的有效輔助手段,據統計其理論與臨床的成功率分別為90%與88%[12-13]。病人在進行結腸鏡檢查后確定腸梗阻位置后,準確植入腸道支架,其不僅可以支撐擴張腸道、緩解梗阻,恢復病人排便功能;對于可以切除的腫瘤疾病,支架植入作為前期的輔助治療方法,一定程度緩解病情,為后期的化療或者放療提供機會[14-16]。
近年來,一種從植物中提取的化合物——姜黃素的出色抗癌功能越來越引起研究者的關注。姜黃素的分子結構(如圖1所示)中的酚醛基側鏈和中央的亞甲基碳基團都可以脫掉一個氫原子,形成穩定的無毒害的自由基,它能選擇性地誘導癌細胞凋亡而對正常細胞作用很小[17-19]。絲素蛋白是一種含有人體必需氨基酸的天然蛋白質,具有良好的生物相容性和力學性能,在體內降解緩慢,適合用于藥物緩釋載體材料[20-23]。
本文開發一種新型絲素蛋白復合腸道支架,內層為采用緯編工藝制備的聚二氧六環酮(PDO)可降解裸支架,外層為采用烘干成膜工藝制備的絲素蛋白搭載姜黃素藥膜,其制備流程如圖2所示。將探討裸支架的力學性能,以及藥膜的微觀形貌、二級結構、晶體結構和藥物緩釋性能,并分析其中的影響因素。

圖1 姜黃素分子結構式Fig.1 Curcumin molecular structure

圖2 覆膜腸道支架的制備過程Fig.2 Preparation of covered intestinal stent
1 試驗材料及方法
1.1 試驗材料及儀器
桑蠶絲(購自嵊州市協和絲綢有限公司);PDO單絲(國標規格3-0)(購自韓國三洋公司);聚乙二醇(PEG-400,相對分子質量為400,優級純,國藥集團化學試劑有限公司);姜黃素(Sigma);其他所用試劑均為分析純。
自制ST-06SL型小口徑圓緯織機;日立S 4800型冷場發射掃描電子顯微鏡(FE-SEM): 日本Hitachi公司;Thermo Nicolet 5700 型傅里葉變換紅外光譜儀: 美國尼高力儀器公司;X射線衍射儀: 荷蘭飛利浦公司;Bio-Tek synergy H1型酶標儀。
1.2 試驗方法
1.2.1 內層PDO裸支架的制備
內層裸支架采用直徑為0.3 mm 的PDO單絲,選擇小口徑圓緯織機: 針筒直徑為20 mm,針齒數為22,織物張力為2 N,彎紗深度為3 mm,編織速度為3 m/min。按照上述參數,編織30 min后得到長度為60 mm、內徑為20 mm的裸支架。將所制裸支架嵌套在直徑為20 mm的管狀模型上,進行熱定型處理15 min,熱定型溫度為80 ℃。
1.2.2 外層藥膜的制備
室溫下,經過溶絲、透析、離心及濃縮,得到質量分數為5%、10%及15%的絲素蛋白溶液。姜黃素溶解于PEG-400中,再與絲素蛋白溶液均勻混合,通過磁力攪拌和超聲分散,得到均勻穩定的混合液。
選擇質量分數為10%的絲素蛋白溶液,質量分數為40%及100%的PEG-400溶液,質量濃度為100、50、25、10及5 mg/mL的姜黃素溶液,按上述操作依次混合,結果如圖3所示,得到姜黃素的最佳質量濃度為5 mg/mL。
選擇絲素蛋白溶液的質量分數為5%、10%及15%, PEG-400與絲素蛋白溶液的質量配比為1∶3(姜黃素的質量分數為0.125%)、1∶6(姜黃素的質量分數為0.071%)及1∶9(姜黃素的質量分數為0.056%),溫度為25、60及80 ℃,設計9組正交試驗,如表1所示,進行成膜試驗。
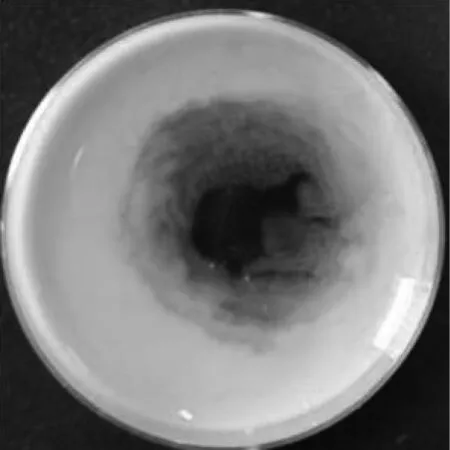
(a)姜黃素質量濃度為100 mg/L,PEG-400質量分數為100%

(b)姜黃素質量濃度為100 mg/L,PEG-400質量分數為40%

(c)姜黃素質量濃度為50 mg/L,PEG-400質量分數為40%
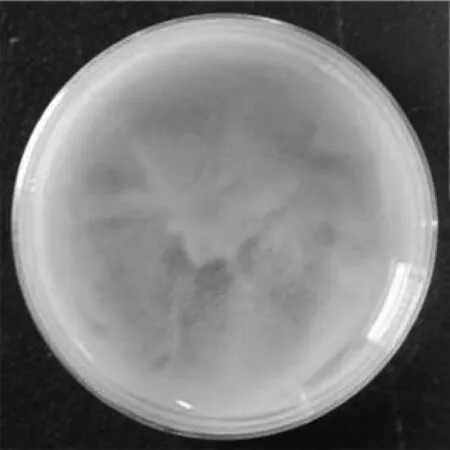
(d)姜黃素質量濃度為25 mg/L,PEG-400質量分數為40%

(e)姜黃素質量濃度為10 mg/L,PEG-400質量分數為40%
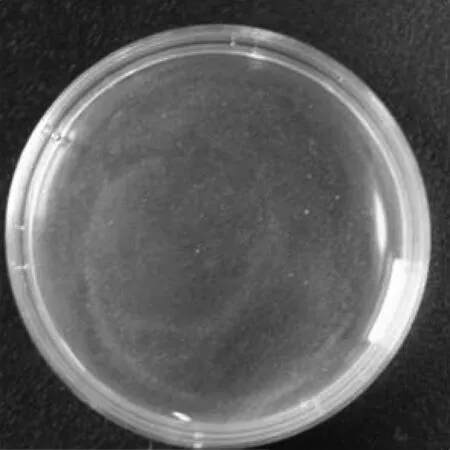
(f)姜黃素質量濃度為5 mg/L,PEG-400質量分數為40%圖3 質量分數為10%的絲素蛋白溶液與不同質量濃度的姜黃素溶液和不同質量分數的PEG-400溶液的混合溶液Fig.3 The mixed solution of silk fibroin, curcumin with different concentrations and PEG-400 with mass fraction of 10% different mass fraction表1 外層藥膜的正交試驗參數 Table 1 The orthogonal experimental parameters of outer drug membrane

試驗號ABC絲素蛋白質量分數/%PEG-400與絲素蛋白溶液的質量配比溫度/℃1#11151∶3常溫2#12251∶6603#13351∶9804#212101∶3605#223101∶6806#231101∶9常溫7#313151∶3808#321151∶6常溫9#332151∶960
1.2.3 藥膜形貌表征
隨機選取外層藥膜樣品,并對其進行噴金處理90 s,在日立S 4800型場發射掃描電子顯微鏡下觀察藥膜表面形態,放大倍數為5 000。
1.2.4 二級結構表征
隨機選取純絲素膜和9組藥膜樣品,剪成粉末狀,取2 mg樣品和20 mg的溴化鋰在瑪瑙研缽中研磨,放入模具,壓成薄片,利用Thermo Nicolet 5700型傅里葉變換紅外光譜儀檢測,分析其二級結構。
1.2.5 晶體結構表征
隨機選取PEG-400與絲素蛋白溶液的質量配比為1∶3、1∶6及1∶9的藥膜樣品,剪成粉末狀,選用150目篩子篩選樣品,進行下一步測試。利用X射線衍射儀和超能探測針計數器記錄5°~45°之間的衍射強度曲線。
1.2.6 藥物緩釋表征
將不同載藥量的藥膜進行水蒸氣處理6 h,使其不溶于磷酸鹽緩沖溶液(pH=7.4)。精確量取藥膜裝于5 mL離心管內,加入2 mL 磷酸鹽緩沖溶液,密封后置于恒溫搖床(37 ℃,100 r/min)。一定時間間隔吸取0.5 mL待測液,同時滴加0.5 mL新鮮磷酸鹽緩沖溶液,測定姜黃素(波長為425 nm)的累積釋放率。
2 結果及討論
2.1 支架力學性能
支架管壁厚度為0.3~1.5 mm,節距為5~10 mm,軸向密度為15~20束/cm,單位質量為0.03~0.06 g/cm。所獲得支架經過熱定型后,其徑向支撐力為30~240 cN,縱向拉伸強度大于20 MPa,橫向拉伸強度大于10 MPa。
2.2 不同參數對藥膜形貌的影響
外層藥膜借助支架支撐力作用,直接貼合病灶部位,進行緩釋治療作用。因此,藥膜表面平整度及空隙對于治療效果至關重要[24]。利用PEG-400誘導絲素蛋白成膠,然后風干成膜,得到了不溶于水的絲素蛋白膜,不同參數的藥膜外觀形貌如圖4所示。從圖4可以看出,7#藥膜透明度高,表面平整光滑,不存在空隙。因此,外層藥膜的最佳成膜工藝參數為: 絲素蛋白質量分數15%,PEG-400與絲素蛋白溶液的配比1∶3,溫度80 ℃。

(a) 1#

(b) 2#

(c) 3#

(d) 4#

(e) 5#

(f) 6#

(g) 7#

(h) 8#

(i) 9#圖4 不同參數的藥膜外觀形貌Fig.4 Morphology of drug membrane with different parameters
2.3 紅外光譜分析
文獻[25-26]研究表明,酰胺I(1600~1700 cm-1)中,β-折疊的最大吸收峰在1616~1637 cm-1,無規卷曲的最大吸收峰出現在1638~1655 cm-1,α-螺旋的最大吸收峰在1656~1662 cm-1,β-轉角的最大吸收峰在1663~1696 cm-1。純絲素蛋白膜和不同參數條件下所制藥膜的傅里葉變換紅外光譜如圖5所示。由圖5可知,純絲素蛋白膜主要以silk Ⅰ的結構存在,而不同參數藥膜的特征吸收峰發生了明顯的偏移,說明絲素蛋白在處理后發生了構象上的轉變,由silk Ⅰ結構轉變為silk Ⅱ結構。

圖5 純絲素膜及不同參數藥膜的傅里葉變換紅外光譜圖Fig.5 FT-IR spectra of silk membrane and drug membrane with different parameters
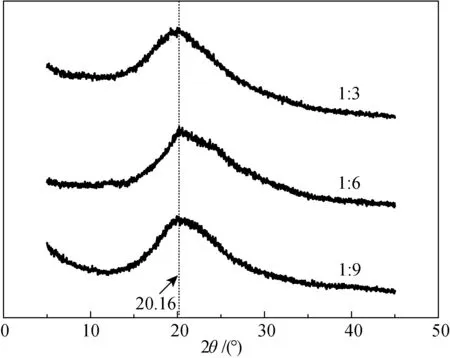
圖6 配比為1∶3、1∶6及1∶9藥膜的X射線衍射光譜圖(絲素蛋白質量分數為15%,溫度為80 ℃)Fig.6 X-ray diffraction pattern of drug membrane with different ratio of 1∶3,1∶6 and 1∶9 (silk fibroin mass fraction was 15%, temperature was 80 ℃)
2.4 X射線衍射分析
純絲素蛋白膜主要以silk I的結構存在,為了探究姜黃素的質量分數對絲素蛋白結構的影響,選取絲素蛋白質量分數為15%,溫度為80 ℃, PEG-400與絲素蛋白溶液的質量配比分別為1∶3、1∶6及1∶9[27],觀察不同配比情況下,藥膜中絲素蛋白結構的轉變。不同配比藥膜的X射線衍射光譜結果如圖6所示。由圖6可知,藥膜中絲素蛋白結構均轉變成silk II,在20.16°處出現了衍射峰,這種現象與FT-IR譜圖顯示的結果一致。
2.5 藥物緩釋分析
選取絲素蛋白質量分數為15%,溫度為80 ℃, PEG-400與絲素蛋白的質量配比分別為1∶3、1∶6及1∶9不同參數的藥膜中姜黃素的釋放曲線如圖7所示。由圖7可知,載藥量越高,藥物釋放速率越大,累積釋放率越高。載藥量不同的藥膜約在200 h內持續釋放,400 h 達到藥物最高釋放濃度,其中,藥物最高累積釋放質量濃度為(13.32±0.80)mg/L,最高累積釋放率為(98.67±5.93)%。由此說明所制藥膜具備很好的藥物緩釋性能。

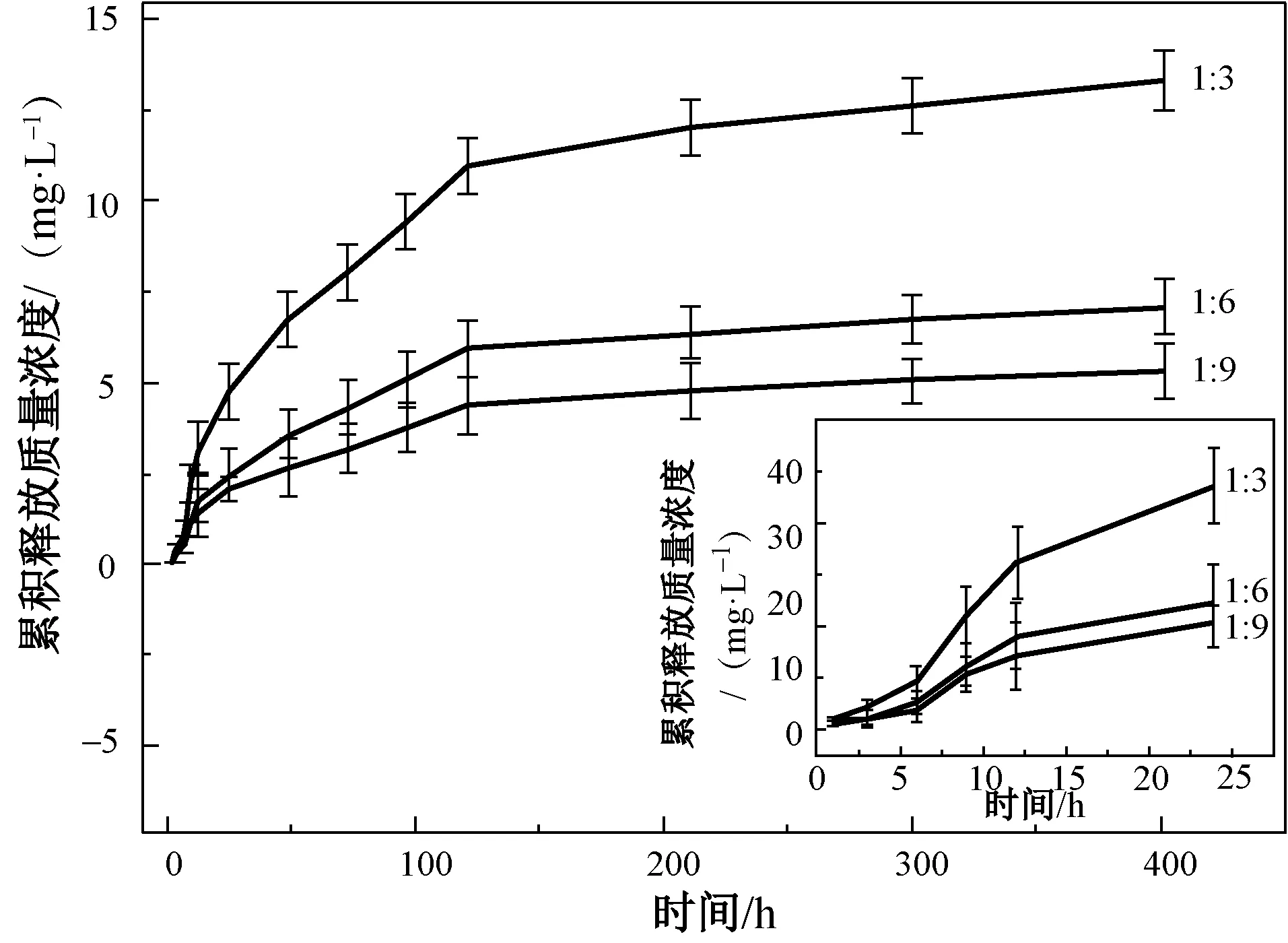
圖7 不同載藥量藥膜的藥物緩釋曲線Fig.7 In vitro drug release profile of drug membrane with different composition
3 結 語
本文制備了一種新型絲素蛋白復合腸道支架,并探討了內層支架力學性能,外層藥膜的形貌結構、二級結構及藥物緩釋性能。研究結果表明: 當絲素蛋白質量分數為15%、PEG-400與絲素蛋白溶液的質量配比為1∶3(姜黃素的質量分數為0.125%)、溫度為80 ℃時,可以制備出最佳藥膜;相較于純絲素蛋白膜,藥膜中的絲素蛋白的構象由silk Ⅰ轉變為silk Ⅱ。絲素蛋白搭載姜黃素納米纖維可以實現藥物的穩控釋放,具備優良的藥物緩釋性能。因此,絲素蛋白基藥物緩釋功能腸道支架在治療結直腸患者過程中具備一定的潛在價值。

