全靜脈搭橋與全動脈搭橋對行CABG術后心肌損傷及遠期療效的影響
董經光,宋 偉,江 昆
(1.山東陽光融和醫院心臟中心,山東濰坊 261000;2.山東省聊城市第二人民醫院心外科,山東聊城 252600)
冠狀動脈粥樣硬化性心臟病(coronary heart disease,CHD),簡稱“冠心病”,一般是由于患者的冠狀動脈血管發生粥樣硬化,血管彈性降低,同時粥樣硬化斑塊導致血管管腔狹窄,血流受阻,造成心肌缺血甚至壞死,臨床常表現為心絞痛、心肌梗死、心力衰竭等癥狀[1]。冠狀動脈旁路移植術(coronary artery bypass grafting,CABG)是治療CHD的主要手段之一,CABG通常選擇乳內動脈或大隱靜脈作為橋血管,但是乳內動脈長度有限,不適用于多支動脈病變[2];大隱靜脈操作簡單,也可以作為橋血管,但文獻報道其暢通率低于乳內動脈[3]。行CABG術時選擇合適的橋血管對患者預后具有重要意義,但關于這兩種橋血管的遠期暢通率尚存爭議[4]。CABG雖然可以解決血管堵塞,恢復心肌供血,但是缺血再灌注依然會對心肌造成損傷;血清糖原磷酸化酶同工酶腦型(glycogen phosphorylase isoenzyme BB,GPBB)是心肌缺血損傷指標,是心肌梗死的診斷指標[5]。本研究旨在比較全靜脈搭橋與全動脈搭橋行CABG術對CHD患者的遠期療效影響,以及對GBPP的影響,以期為臨床治療提供依據。
1 資料與方法
1.1一般資料 選取2011年1月至2015年12月在聊城市第二人民醫院行CABG手術的CHD患者98例為研究對象,以乳內動脈為橋血管的患者為全動脈組,共50例;以大隱靜脈為橋血管的患者為全靜脈組,共48例。本研究經聊城市第二人民醫院倫理委員會批準進行。納入標準:(1)符合CHD相關診斷標準[6];(2)經冠狀動脈造影確診為CHD;(3)患者由于血管狹窄不適合進行經皮冠狀動脈治療(percutaneous coronary intervention,PCI)支架置入;(4)前降支系統、回旋支系統、右冠狀動脈系統存在2支及以上血管狹窄,其中至少1支血管狹窄程度大于或等于50%;(5)已獲得患者家屬知情同意。排除標準:(1)伴有嚴重肝腎功能異常患者;(2)合并患有惡性腫瘤患者;(3)既往PCI史患者;(4)同期進行其他心內操作手術患者;(5)近期合并系統性感染疾病患者。兩組性別、年齡、高血壓史、糖尿病史、高血脂史、心功能分級等一般資料類型差異無統計學意義(P>0.05),具有可比性。
1.2方法 術前進行常規檢查,包括血常規、肝腎功能、心肌酶等,進行多普勒超聲血管檢查,明確血管走向。并進行硝酸異山梨酯擴展冠狀動脈,控制心率在60~80次/min內,并將血糖、血脂、血壓控制在正常范圍內。術前12 h禁食禁飲,手術前30 min進行0.5 mg東莨菪堿注射液、50 mg鹽酸哌替啶注射液肌肉注射。采用靜脈吸入復合麻醉、一次性氣管插管,使用麻醉機輔助維持呼吸;在麻醉成功后,對患者進行生理指標持續監測(包括血壓、血氧飽和度、心電圖等)。
術前進行全身肝素化,建立體外循環,術中維持淺低溫(30~32 ℃)進行CABG手術。所有患者采用平臥位,進行正中開胸。全動脈組患者取乳內動脈進行搭橋,全靜脈組取大隱靜脈搭橋。對左心室功能低下[左室射血分數(LVEF)<40%]的高危CABG患者給予術前主動脈球囊反搏(intra-aortic balloon pump,IABP)預防性安置,以降低術中的風險,輔助時間為3 d左右;對術前急性心肌梗死合并心源性休克患者給予IABP術前輔助3~4 d,術后輔助5~7 d;對術后出現心肌梗死心力衰竭患者IABP輔助5~7 d。
術后所有患者進行常規呼吸機輔助呼吸,并持續監測血壓、心率及中心靜脈壓,每天拍胸片觀察肺部是否滲出,并檢查心肌酶,觀察有無心肌缺血和心肌梗死的發生。維持血糖穩定,在撤離呼吸機后給予阿司匹林口服抗凝。
術后進行12個月隨訪,并于12個月后CT復查橋血管是否通暢,無失訪病例。
1.3 評價指標與方法
1.3.1臨床指標評價 記錄并比較兩組行CABG的手術耗時、阻斷升主動脈血流時間、術后呼吸機輔助時間、術后24 h胸腔引流液量、術后住院時間、術后并發癥。
1.3.2術后血管通暢率 統計比較兩組手術移植血管數量;分別在術后1、6、12個月采用冠狀動脈血管造影(CTA)評價兩組血管暢通率:以血管未發生狹窄或輕度狹窄判定為暢通,以血管發生中度至重度狹窄判定為不通暢。
1.3.3血清GPBB水平測定 分別于升主動脈阻斷時,升主動脈開放后30 min、2 h、4 h及手術結束后24 h采集動脈血5 mL,離心取上清液,-80 ℃保存,采用ELISA法測定血清GPBB水平,試劑盒購自美國Sigma公司,所有操作嚴格按照說明書進行。
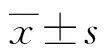

表1 兩組臨床指標比較
2 結 果
2.1兩組臨床指標對比 全動脈組共移植105條乳內動脈,全靜脈組共移植162條大隱靜脈,兩組平均移植血管數量差異有統計學意義(P<0.05)。全動脈組手術耗時、阻斷升主動脈血流時間顯著長于全靜脈組(P<0.05),術后呼吸機輔助時間顯著短于全靜脈組(P<0.05);兩組術后24 h胸腔引流量、術后住院時間差異無統計學意(P>0.05)。見表1。
2.2兩組術后并發癥對比 全動脈組術后心房纖顫、切口感染發生率顯著低于全靜脈組(P<0.05),兩組肺部感染、腎衰竭、心室顫動、病死率差異無統計學意義(P>0.05)。見表2。
2.3兩組術后血管暢通率對比 除去死亡病例,全動脈組和全靜脈組分別成功移植101條乳內動脈,154條大隱靜脈。術后12個月內兩組的血管通暢率均有所下降,全靜脈組下降更為顯著,兩組血管通暢率組間(F=5.971)、不同時間(F=4.536)、組間不同時間(F=7.628)比較差異均有統計學意義(P<0.01),全動脈組血管通暢率優于全靜脈組。見表3。

表2 兩組術后并發癥比較[n(%)]

表3 兩組術后遠期血管通暢率比較[n(%)]
2.4兩組血清GPBB水平比較 兩組患者血清GPBB水平的變化在升主動脈開放后30 min到達峰值,隨后緩慢下降,全靜脈組升主動脈開放后血清GPBB水平顯著高于全動脈組,兩組組間(F=113.518,P=0.00 1)、不同時間(F=62.390,P=0.000)、組間不同時間(F=195.684,P=0.000)比較差異均有統計學意義。見表4。

表4 兩組手術過程血清GPBB水平對比
3 討 論
CHD是由于冠狀動脈發生粥樣硬化彈性降低,收縮擴張功能下降,斑塊沉積導致血流受阻形成堵塞,導致心肌發生缺氧缺血損傷。由于人口老齡化、肥胖、三高等眾多誘因,我國CHD發病率近年逐年增高,已經成為心血管疾病中第一位死亡原因[7]。PCI和CABG是臨床上治療CHD的常用手術方法,但是PCI支架的應用遠期可能發生較高的再次狹窄,而且對于多支冠狀動脈病變的患者置入支架發生內血栓的風險更高[8]。CABG可以使血液從左心室泵出后由主動脈經過新架的血管橋到達心肌,避開發生狹窄病變的冠狀動脈,繞開易損斑塊,解決血管堵塞問題,術后冠狀動脈再通率高于PCI[9]。臨床一般選擇乳內動脈或大隱靜脈作為橋血管,但是兩者在臨床操作和遠期療效上存在一定差異,本研究在體外循環條件下,比較乳內動脈作為全動脈搭橋與大隱靜脈作為全靜脈搭橋的臨床效果和遠期療效。
中國人乳內動脈的管徑小且短,取材更加困難,不適用于多支冠狀動脈病變,但主張采用此法的學者認為其擁有致密的內彈力層,能夠有效遏制平滑肌細胞的移動,減輕術后粥樣硬化及血栓,具有較好的遠期暢通率[10]。大隱靜脈位置表淺管腔大,更易于采集,但其遠期發生閉塞的可能性較大[11]。本研究結果顯示乳內動脈手術操作耗時更長、阻斷升主動脈流血時間更長、手術難度更高,術后并發癥發生較低,但大隱靜脈更適用于需要多支血管搭橋的患者。CABG術后橋血管的遠期通暢率是決定CHD患者生存率的重要因素。本研究結果發現全動脈組的遠期暢通率(87.13%)優于全靜脈組(75.97%)。普遍認為靜脈搭橋通暢率低于動脈搭橋,但是目前臨床采用全動脈搭橋比例不足10%,錢松屹等[12]發現靜脈移植10年通暢率小于50%,但全動脈搭橋術與全靜脈搭橋術的10年以上大樣本對比仍需后續進一步跟進。CHD患者在主動脈阻斷手術期間心肌處于缺氧狀態,術后恢復心肌供血,缺血再灌注會對心肌造成損傷。GPBB是一種心肌缺血損傷標志物,研究表明其可作為心肌梗死的診斷指標之一,可用于CABG術后心肌損傷的評價[13]。本研究發現兩組血清GPBB水平變化趨勢相同,均是在升主動脈開放后30 min到達峰值,隨后下降并在24 h后恢復到低水平,但兩組比較全靜脈組血清GPBB水平普遍高于全動脈組。說明全靜脈搭橋術心肌損傷程度重于全動脈搭橋術。分析原因認為GPBB參與糖原的磷酸化作用,在缺氧時發生活化分解糖原,為了補充葡萄糖供應,心肌中GPBB水平迅速升高[14]。同時心肌細胞處于缺氧狀態,其細胞膜通透性增加,GPBB穿過細胞膜進入血液,使得血清水平相應升高。CABG手術時升主動脈阻斷后,短時間內有心肌保護液保護,所以在升主動脈開放后30 min血清GPBB水平達到峰值,隨后在搭橋成功后冠狀動脈恢復供血,血清GPBB水平逐漸下降。全動脈組心肌損傷輕于全靜脈組可能是由于乳內動脈具有彈力層,其抗痙攣、抗血栓能力更強;另一方面可能是因為乳內動脈的側支血運重建功能較大隱靜脈更強,可以增加心肌血運,減輕心肌損傷[15-16]。
綜上所述,全動脈搭橋手術比全靜脈搭橋手術耗時更長,操作難度更大,但術后并發癥發生率更低,遠期橋血管通暢率更高,對心肌損傷更輕。

