CpG?ODN通過調控細胞免疫顯著增強熱休克蛋白腫瘤疫苗誘導的抗腫瘤免疫效應
張瑩瑩,王曉文,唐勁天
(1中南大學湘雅醫院腫瘤科,湖南 長沙410078;2清華大學工程物理系醫學物理與工程研究所,北京100084)
0 引言
隨著醫學的不斷發展,腫瘤治療的技術也在不斷的進步。但是對于很多惡性腫瘤來說,常規治療效果欠佳,死亡率居高不下,仍是臨床治療中的難點。近年來,研究者們發現,部分惡性黑素瘤患者出現腫瘤自發性的消退現象,于是逐漸關注黑色素瘤固有的致免疫性。隨著研究的不斷深入,人們將其認為是惡性腫瘤中具有高免疫原性的一種。因此,免疫治療開始成為惡性黑色素瘤治療的研究熱點和發展方向,并期待取得突破性進展[1]。
已有研究[2-3]報道熱療可以增強腫瘤細胞的免疫原性,且這種增強在很大程度上與熱休克蛋白(heat shock proteins,HSPs)的過表達有關。大量的實驗研究[4-5]已經證實了經熱誘導的癌細胞中的HSP70、HSP90等物質能夠激發抗腫瘤免疫。然而,眾多熱休克蛋白相關腫瘤疫苗的動物或臨床研究[6-8]均顯示,雖然在實驗對象體內可以檢測到特異性免疫反應并且腫瘤生長受到不同程度地抑制,但尚難達到滿意的療效。分析原因,發現有可能與MHC?I抗原的表達不強有關[9]。甚至有研究[3]表明熱休克處理雖然可以增加抗原肽形成,但同時抑制了抗原的呈遞。B16細胞經熱誘導后,會形成免疫原性的抗原。例如檢測細胞中的HS,發現其P?抗原復合物的含量有所上升,但是MHC?I分子卻不能有效地將抗原傳遞給T細胞,從而造成免疫耐受或逃逸。因而,比較理想的腫瘤疫苗應該能夠有效地激活T細胞,為其提供良好的第一和第二信號,將其特異性抗腫瘤免疫效應充分發揮出來[8],同時也避免由于免疫強度不夠而發生逃逸,影響患者身體健康。
要想抗原誘導機體更好地發生免疫反應,可適當地添加佐劑,適當的佐劑能夠為T細胞的活化提供第二信號。所以在疫苗的研究過程中,對佐劑的研究也是其中很重要的部分。目前使用比較多的佐劑大多是人工合成的,寡聚核苷酸鏈(oligodeoxynucleoti?des,ODN)中含有非甲基化 CpG 基序(CpG?ODN),也是一種近年新引起廣泛關注的水性佐劑。其自身無免疫原性,不會引起自身免疫疾病。更重要的是CpG?ODN作為Toll樣受體9的配體,能夠提高蛋白抗原和DNA疫苗的免疫原性,直接激活 NK細胞[10]、樹突狀細胞[11]、巨噬細胞[12]等,并刺激這些細胞分泌 IFN?γ、IL?2、TNF?α 等 Th1 樣細胞因子,從而誘導 Th1型細胞免疫應答[13-14]。 此外,它還能夠在一定程度上促進細胞抗原呈遞,促進其細胞表面分子MHC?II、B7?1、B7?2 等的表達,活化樹突狀細胞,促進抗原呈遞,協同激活 T 細胞[15-16]。 因此,可將 CpG?ODN作為多種抗原的免疫佐劑,以增強免疫作用[13,15,17-19],在抗腫瘤免疫治療領域顯示出巨大的潛力。
綜上所述,富含熱休克蛋白的腫瘤細胞瘤苗和CpG?ODN在抗腫瘤免疫功能上具有互補性,CpG?ODN有望克服單純腫瘤細胞疫苗抗原呈遞活性的不足,起到協同增效的作用。本研究的實驗模型是小鼠惡性黑色素瘤,腫瘤疫苗選擇經過熱誘導且富含HSP70的B16細胞裂解的產物,聯合新型免疫佐劑CpG?ODN免疫小鼠,觀察疫苗對小鼠產生的免疫保護作用,并研究小鼠免疫系統的功能改變。
1 材料和方法
1.1 主要試劑羊抗鼠HSP70多克隆抗體,購自美國Cellsigna公司;抗羊二抗液,被辣根過氧化物酶標記,購自北京中杉金橋生物技術有限公司,大鼠抗小鼠CD4 R?PE和CD8a TRI?COLOR熒光抗體、大鼠抗小鼠CD25?FITC熒光抗體均購自美國Invitrogen公司;脾淋巴細胞分離液,購自達科為生物有限公司;小鼠 IL?2、 IFN?γELISA 試劑盒,購自美國 Bioscience公司;LDH釋放法檢測試劑盒購自美國Promega公司(Madison, WI)。
1.2 實驗動物實驗小鼠,健康清潔級C57BL/6,雄性,體質量18~22 g,6~7周,購自中國醫學科學院實驗動物中心。小鼠飼養時溫度為(23±2)℃,相對濕度(55%±2%),普食飼養。
1.3 細胞培養小鼠B16黑色素瘤細胞購自中國協和醫科大學細胞庫。B16細胞接種于DMEM培養基,接種之后放于37℃、5%CO2環境下培養約24 h即可進行傳代,觀察發現細胞的數量呈對數期增長時即可提取用于實驗。
1.4 制備熱處理后細胞裂解瘤苗將經45℃15 min熱處理后的B16細胞(我們前期實驗研究發現,相較42℃ 60 min和50℃ 5 min,45℃ 15 min熱處理能誘導最高程度的HSP70蛋白表達,該western blot結果在補充材料中提供),立即更換培養基后放回37℃,5%CO2細胞培養箱復溫孵育24 h后取出,收集全部細胞,用PBS將細胞洗滌兩次,然后將其濃度調整至5×108個/mL。即可將細胞懸液轉移至冷凍管中進行保存,然后再交替置于液氮內10 min,37℃水浴中5 min,多次操作之后待細胞完全溶解后,即可放于-80℃的環境中進行冷凍保存,以備后用。
1.5 CpG?ODN2395佐劑配制CpG?ODN2395 的序列為 5′?TCGTCGTTTTCGGCGCGCGCCG?3′,購自上海生工生物工程技術服務有限公司。根據說明書,使用PBS溶解核酸,將濃度調制為0.1 mL/OD,注意即配即用。
1.6 實驗分組以及小鼠腫瘤疫苗接種及攻擊實驗實驗小鼠隨機分為下述四組。①對照組:接種PBS;②瘤苗組(heated cell lysates,HCL組):將45℃熱處理腫瘤細胞裂解產物(每0.1 mL含2×107個細胞的裂解產物)+PBS等體積混合后接種;③佐劑組(CpG?ODN 組): CpG?ODN2395(濃度為 30 μg/0.1 mL) +PBS等體積混合后接種;④聯合組(HCL+CpG?ODN組):將 45℃熱處理腫瘤細胞裂解產物+CpG?ODN2395等體積混合后接種。
健康小鼠的疫苗接種:分別于第 0、6、12、18及24 d向小鼠注射疫苗,需注意疫苗應分四點進行注射,注射位置為小鼠雙側腹股溝和腋窩皮下,每個位置的注射量為0.05 mL,每間隔5 d進行一次注射,每只小鼠接種5次。
B16細胞攻擊接種后小鼠:當B16細胞呈對數生長之后,取細胞放于0.25%胰酶中進行消化。重懸于PBS中。并將 B16的濃度調至 1×106個/mL,于第30天在小鼠為右肋腹部皮下位置進行注射,每只小鼠注射 0.1 mL。
觀察并記錄小鼠皮下腫瘤出現的時間、體積大小和小鼠生存天數。
1.7 外周血T細胞亞群檢測免疫結束后的第六天(d30),隨機從每組中挑選3只小鼠,用摘眼球取血法采集小鼠血液,并置于抗凝管中。在抗凝管中取血100 μL,置于 1.5 mL 離心管,分別向離心管中加入3 L的,在溫室、避光的環境中孵育15~20 min。1000 rpm離心 5 min,棄上清。加入 2 mL PBS,1000 rpm離心5 min,將未結合抗體洗去。在溶液中加入稀釋了的流式紅細胞裂解液,在溫室、避光的環境中孵育15 min,觀察發現溶液呈透明狀后取出。以1000 rpm的速度離心溶液離心5 min,棄上清。向其中加入2 mL PBS,再以1000 rpm的速度離心溶液離心5 min,重復洗滌2次。加入4%多聚甲醛,固定待測。用流式細胞儀檢測外周血中CD4+T細胞、CD8+T細胞以及CD25+T細胞的數量,計算各亞群比例。
1.8 小鼠脾淋巴細胞分離和培養取血后將小鼠斷頸處死,無菌取脾,置于200目尼龍網中研磨脾組織,分散的細胞經過尼龍網過濾即可進入到脾淋巴細胞分離液中。收集懸液,以1500 rpm的速度離心溶液離心30 min(密度梯度法),得到脾臟單個核細胞。用PBS液將細胞漂洗兩次,于5 mL 10%FCS RPMI 1640培養液重懸(含 IL?2 100 U/L),以常規細胞培養方式進行培養,培養液隔天更換。
1.9 ELISA法檢測小鼠脾細胞分泌Th1型細胞因子IL?2、INF?γ水平將所獲各組小鼠脾淋巴細胞(單核細胞)作為效應細胞,以絲裂霉素C滅活處理后B16細胞作為刺激細胞,按10∶1的比例共培養3 d,收集培養上清,ELISA法檢測其中Th1型細胞因子 IL?2、INF?γ 的水平。
1.10 LDH釋放法檢測免疫后小鼠脾細胞毒性T淋巴細胞(cytotoxic lymphocyte,CTL)對B16的特異性細胞毒作用將效應細胞(分離的脾單核細胞)和靶細胞(滅活的B16細胞)以效靶比為20∶1混合培養于10%FCS RPMI 1640 培養液(含 IL?2 100U/L)中,4 h后用LDH釋放法檢測試劑盒檢測不同組LDH的釋放水平,CTL殺傷效率計算公式:殺傷率(%)=OD(實驗組?效應細胞自發?靶細胞自發)OD(靶細胞最大?靶細胞自發)×100%。
1.11 統計學分析所有實驗均重復至少兩次。實驗數據采用 StatView (version 5.0) software(SAS Institute Inc.Cary,NC)統計軟件處理。計量數據以x ±s表示,組間均數比較采用ANOVA分析,統計學差異顯著性采用 log?rank檢驗,P<0.05為差異有統計學意義。
2 結果
2.1 同源腫瘤細胞攻擊后小鼠出瘤情況、腫瘤生長曲線及生存期觀察的比較總觀察期為40 d,將小鼠體內腫瘤體積繪制成動態圖(圖1):PBS對照組腫瘤生長迅速,平均出瘤時間為(5.3±1.8) d,并在 30 d內全部死亡(小鼠的生存周期為 20.9±2.9 d)。 相比于PBS組,CpG?ODN組、HCL組以及聯合疫苗組(HCL+CpG?ODN)的小鼠腫瘤均受到不同程度的抑制,其中聯合疫苗組的腫瘤抑制水平最高(P<0.05)。小鼠接瘤之后,直至觀察結束,約有35%未出瘤。已出瘤小鼠的平均出瘤天數為(11.7±5.0)d,超過 73%的小鼠在觀察結束之后仍然存活,存活時間明顯長于其他組(P<0.01)。 CpG?ODN 組未出瘤小鼠僅為一只,出瘤小鼠的出瘤時間為(8.6±3.2)d,小鼠 40 d 的存活率為52%(14/27)。HCL組和PBS組的出瘤時間基本相同,為(5.6±1.7) d,但是在腫瘤生長抑制作用上,兩組的差別比較明顯,HCL組46%(12/26)的小鼠生存期超過了40 d,較對照組延長。CpG?ODN組相較于HCL組來說,無論是平均出瘤時間,還是生存期都有所延長。
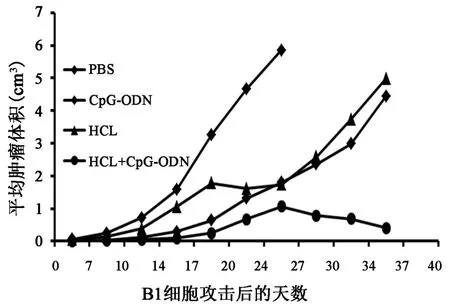
圖1 小鼠腫瘤體積生長曲線圖
2.2免疫后小鼠外周血T細胞亞群CD4+、CD8+的比值升高,但CD4+CD25+T細胞比例無差異研究顯示機體的免疫功能狀態在很大程度上與T細胞亞群的比例有關,以流式細胞術對細胞外周血進行檢測,CD4+T細胞與CD8+T細胞比值低提示免疫功能低下,而 HCL 組、CpG?ODN 組與 HCL+CpG?ODN 組小鼠的外周血CD4+/CD8+的值均較PBS組升高(P<0.001)。 其中聯合疫苗組 CD4+/CD8+的值最高,與其它治療組相比,差異有統計學意義(P<0.001)。HCL 組和 CpG?ODN 組的 CD4+/CD8+值比較,差異有統計學意義(P=0.048,圖 2)。

圖2 外周血T細胞亞群分布比例
2.3 聯合免疫小鼠脾細胞分泌Th1型細胞因子的活性顯著增加治療組IFN?γ和IL?2的水平與對照組相比,均有不同程度的提升(P<0.05)。 其中 HCL+CpG?ODN組的小鼠可誘導出最高水平的IFN?γ和IL?2,分別為(1402.5±156.5) pg/mL 和(532.9±41.8) pg/mL;CpG?ODN 組也可誘導出較高的 IFN?γ 和 IL?2,分別為(1021.8±136.9) pg/mL 和(395.3±20.1) pg/mL;HCL免疫組誘導出的IFN?γ和IL?2則相對較低,分別為(654.7±59.5) pg/mL 和(289.2±15.5) pg/mL,組間比較,差異有統計學意義(P<0.05,圖 3)。
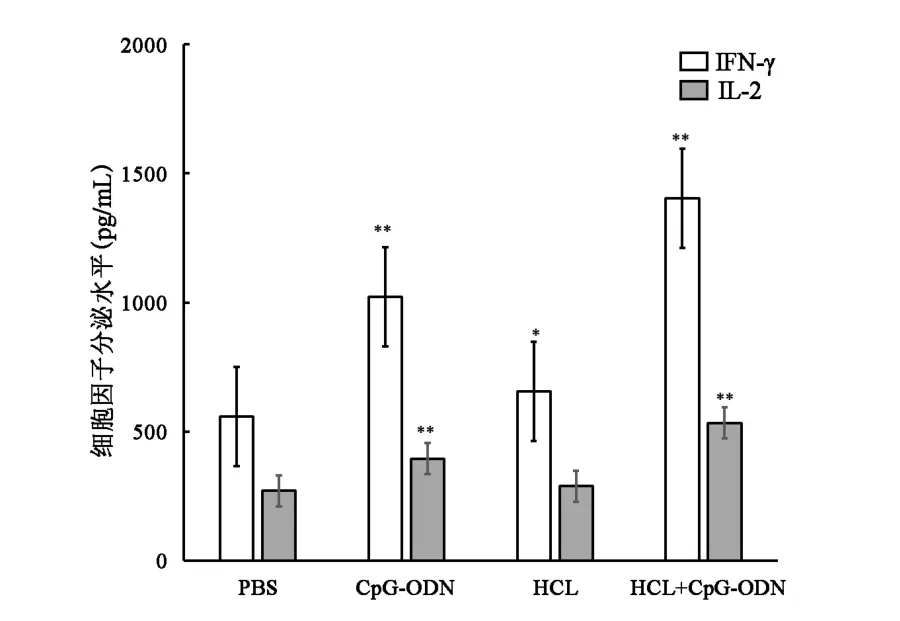
圖3 各組Th1細胞因子分泌水平比較
2.4 聯合免疫后小鼠脾CTL的細胞毒效率明顯增加對CTL細胞進行毒效率檢測,相比于PBS組,單獨HCL起不到增強CTL特異性細胞毒效率的作用(P>0.05)。 CpG?ODN 組和 HCL+CpG?ODN 組均能明顯增強小鼠 CTL的細胞毒殺傷效率(P<0.05),HCL+CpG?ODN 組與 CpG?ODN 組相比,差異有統計學意義(P<0.01),對細胞毒殺傷效率的增強作用最顯著(表 1)。
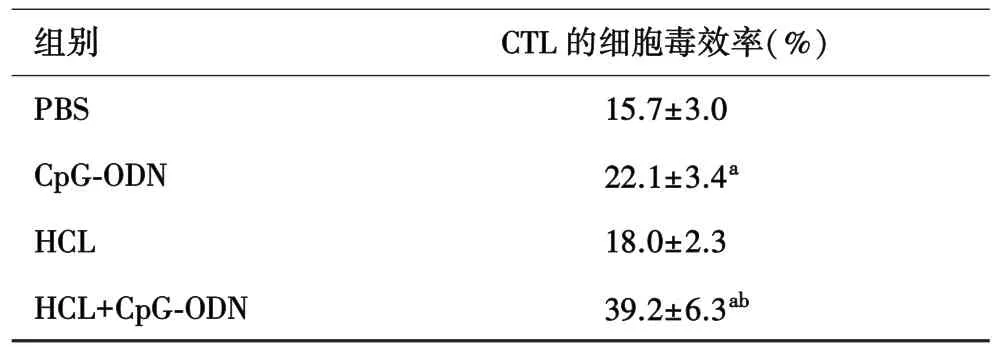
表1 各組脾CTL對B16的特異性細胞毒殺傷效率比較
3 討論
熱休克蛋白相關腫瘤疫苗及免疫活性物質CpG?ODN,在誘導抗腫瘤免疫反應上,能夠在一定程度上起到互補的作用。本實驗主要研究了小鼠的惡性黑色素瘤腫瘤細胞疫苗的療效,并觀察了不同疫苗配方對小鼠的抗腫瘤免疫效力的增強作用,通過檢測,聯合疫苗的效果最佳。聯合疫苗能使超過35%的小鼠抵抗住了B16細胞的攻擊。即使長出腫瘤的小鼠,其平均出瘤時間、生存期與其它各組相比亦有顯著性延長。本研究結果與Ito等[18]研究具有一致性,進行HCL瘤苗治療,小鼠未能產生更強的免疫保護,HCL組的出瘤時間與PBS對照組相比,差異無統計學意義,但是在腫瘤的生長和小鼠的生存期上有一定的差異,說明HCL瘤苗有一定的誘導抗腫瘤免疫作用,這可能與熱處理后腫瘤細胞內形成的大量HSP?抗原肽復合物具有一定抗腫瘤免疫活性且不依賴于MHC的表達有關[20-21]。 另外,值得一提的是 CpG?ODN 與HCL聯合應用后部分小鼠出現了因局部變態反應導致的皮膚潰瘍(該結果未在本文中列出),此現象在國內外尚未見類似報道,具體原因還有待進一步研究。此局部劇烈變態反應的出現除了證實聯合疫苗可誘導極強的免疫反應外,也提醒我們需改良接種方式以減輕治療的局部不良反應。
為對抗腫瘤機制進行更進一步的研究,本實驗還對小鼠細胞免疫狀態進行了檢測。在小鼠體內,CD4+T細胞是細胞免疫應答的主要效應細胞,通過分泌 IL?2、INF?γ 等細胞因子來調節免疫反應;CD8+T細胞能夠分泌物質,抑制T細胞因子的免疫作用,對于小鼠機體而言,CD4+/CD8+細胞比值決定著免疫是否平衡,從側面反映出機體免疫功能狀態,當CD4+/CD8+細胞比值下降,說明小鼠機體的免疫功能下降,而當免疫功能有所恢復,小鼠的CD4+/CD8+細胞比值會有所上升。本實驗結果顯示,當機體進行免疫治療之后,CD4+/CD8+細胞比值均有明顯的上調,其中聯合疫苗組的上調最為明顯。后續IL?2、INF?γ細胞因子以及CTL細胞毒殺傷效率的檢測結果亦印證了該結果。
CD4+CD25+T細胞在免疫應答過程中起著負調節的作用,所以也將其稱為調節性T細胞(T regular cell, Treg)。 有研究報道減少或清除 CD4+CD25+T細胞可以增強細胞疫苗的療效[22],而CpG?ODN可通過TLR9損傷Treg細胞使其數目減少[23]。因此,本實驗預期聯合免疫組小鼠CD4+CD25+T細胞比例會低于對照組,但結果卻顯示各實驗組無明顯差異。迄今為止,Treg細胞的調控機制尚未完全明確,Treg細胞可與細胞因子、T細胞、樹突狀細胞以及不同腫瘤和免疫微環境等多種因素相互影響、相互調控有關[24],本研究中各組小鼠Treg細胞亞群數量無明顯差異,亦反過來證實了Treg細胞調控機制的復雜性。下一步我們擬檢測Treg的功能狀態,探索其與CpG?ODN相互作用的可能信號通路,以期進一步揭示CpG?ODN強化抗腫瘤免疫應答的可能分子機制。
綜上所述,新型免疫佐劑CpG?ODN可顯著增強熱休克蛋白腫瘤疫苗的抗腫瘤免疫效應。HCL攜帶多種腫瘤特異或者相關抗原的HSP?抗原肽復合物,在免疫佐劑CpG?ODN的協同作用下,免疫細胞因子分泌將會更強,改善T細胞亞群的比例,活化腫瘤免疫微環境,進而增強單核細胞對腫瘤細胞的特異性細胞毒作用,從而抑制腫瘤生長。這些實驗結果為未來腫瘤疫苗的研究提供了一定的實驗依據。

