嘌呤P2X7受體介導對氯苯丙酸致大鼠前額皮質蛋白激酶的變化*
王慧,曹敏玲,左文彪,史琴
(貴陽中醫學院 1.功能實驗室,2.生理教研室,貴州 貴陽 550025)
腦內5-羥色胺(5-hydroxytryptamine, 5-HT)對睡眠和覺醒功能具有重要的調節作用,但5-HT濃度改變后通過何種途徑引起大腦皮質興奮性變化尚未明確。研究表明,三磷酸腺苷(ATP)及其嘌呤P2X受體在睡眠活動的穩態調控中起到重要的作用[1-3],細胞內ATP逐漸升高與非快速動眼睡眠delta波活動相一致[4];P2X受體激動劑增加NREM睡眠而P2X受體拮抗劑則抑制大鼠NREM睡眠;P2X7受體的蛋白表達水平能隨著睡眠周期的改變而改變[5]。前期研究發現對氯苯丙氨酸(parachlorophenylalanine, PCPA)所致的腦內5-HT濃度下降能引起大鼠前額皮質ATP含量下降,Na+-K+ATP酶和Ca2+-Mg2+ATP酶的活性下降[6],本研究進一步探討中樞5-HT與P2X受體及受體后信號蛋白激酶的作用關系,探討促眠藥物可能的作用環節和靶點。
1 材料與方法
1.1 實驗材料
1.1.1 實驗動物 清潔級SD雄性大鼠36只。體重200~220 g(湖北省實驗動物研究中心,合格證號42000600010950),置于安靜、溫度保持恒定(22±2)℃、避免強光的環境中飼養7 d。
1.1.2 試劑與藥物 PCPA、OxATP(非選擇性P2X受體拮抗劑)、A438079(高選擇性P2X7受體拮抗劑)和BzATP(P2X7受體激動劑)(購自美國Sigma公司),CaMKII和 PKC(美國 Abcam 公司)、P38 MAPK(CST)、二步法免疫組織化學(簡稱免疫組化)試劑盒(北京中杉金橋公司),DAB顯色劑(北京索萊寶科技有限公司),BCA蛋白濃度測定試劑盒(上海碧云天生物技術有限公司),cDNA合成試劑盒(Gene Copoeia),熒光定量試劑盒(大連寶生物工程有限公司)。
1.2 方法
1.2.1 大鼠分組及處理 大鼠隨機分為6組(每組6只):正常組、對照組、PCPA組[300 mg/(kg·d),腹腔注射,連續3 d]、OxATP、BzATP及A438079干預組,除正常組外,動物用10%水合氯醛(0.3 ml/100 g)腹腔注射麻醉,固定于立體定位儀上,根據Paxinos and Watson立體定位圖譜定位腦室位置(前囟后0.8 mm,中線外1.5 mm,顱骨表面下4.5 mm),在顱骨上鉆一小孔,將單管微量給藥系統導管插入左側腦室位置,用牙托粉和牙托水固定,腹腔注射青霉素抗感染3 d,手術 7 d 后用于實驗。OxATP(4 nmol,5 μl,)、BzATP(4 nmol,5 μl)及 A438079(10 μmol,5 μl)均為腦室給藥,每天1次,連續3 d。末次給藥2 h后取大腦皮質前額葉組織,分為左右2個部分,分別保存于-80℃冰箱及存放于10%多聚甲醛中備用。
1.2.2 免疫組織化學染色及分析 將前額皮質用石蠟包埋。免疫組化采用非生物素二步法,按試劑盒說明書操作。每只大鼠選取3張400倍照片,使用IPP 6.0軟件對免疫組化照片進行光密度分析,檢測PKC、CaMKⅡ和P38 MAPK陽性細胞的平均光密度值(MD)。
1.2.3 Western blot檢測PKC、CaMKⅡ和P38 MAPK蛋白表達 將100 g組織塊置于勻漿器中加入1 ml蛋白裂解液,在冰上進行勻漿,裂解30 min后,將裂解液移至1.5 ml離心管中,4℃下12 000 r/min離心5 min,取上清置于-20℃冰箱冷凍保存。對樣品進行蛋白濃度檢測,根據標準蛋白濃度和相應的吸光值計算直線回歸方程,利用回歸方程計算出樣品蛋白濃度。將提取的蛋白上清與5倍蛋白上樣緩沖液混合,放入沸水10 min變性。配制電泳膠和濃縮膠,上樣(上樣量為40 μg)、電泳分離(濃縮膠80 V,分離膠120 V)。使用PVDF膜進行轉膜,轉膜條件:GAPDH及P38 MAPK:200 mA,90 min;CaMK Ⅱ:200 mA,120 min;PKC:250 mA,120 min。進行免疫印跡顯色,用含5% 脫脂奶粉的TBST封閉液浸泡PVDF膜,室溫搖床封閉2 h,再用封閉液稀釋相應的一抗(GAPDH、P38 MAPK和PKC稀釋比為1∶1 000,CaMK Ⅱ稀釋比為1∶2 000),使PVDF膜浸泡于一抗孵育液中,4℃孵育過夜,TBST漂洗膜5次,將PVDF膜浸泡于已用封閉液稀釋的二抗孵育液中,37℃搖床孵育2 h。TBST充分洗滌PVDF膜5次,ECL顯影,用Band Scan分析膠片灰度值。將目標蛋白的灰度值與內參蛋白(GAPDH)比值作為目標蛋白的相對表達量。
1.2.4 實時熒光定量PCR(quantitative real-time polymerase chain reaction, qRT-PCR)檢測PKC、CaMKⅡ和P38 MAPK mRNA表達 ①取-80℃冰箱中保存的新鮮冷凍的組織100 mg,Trizol法提取RNA,紫外分光光度計測定A260/A280比值,比值在1.8~2.0之間滿足實驗要求。將總RNA放于-80℃冰箱內保存以備用。②逆轉錄:將RNA加入逆轉錄反應體系(按試劑盒說明書操作),逆轉錄為cDNA。引物為北京擎科生物公司合成。引物序列見表1。③半定量RT-PCR檢測反應體系為:內參正向引物(10 μmol/L)0.5 μl,內參反向引物(10 μmol/L)0.5 μl,dNTP(2.5 mmol/L)2 μl,ExTaq 0.25 μl,10×ExTaq E buffer 2.5 μl,cDNA 1 μl,ddH2O 加至 25 μl。反應條件為 :94℃變性30 s,56℃退火30 s,72℃延伸25 s。PCR產物電泳分析,瓊脂糖凝膠電泳顯示擴增的目的基因片段大小與設計的目的基因片段大小一致(見圖1)。④qRTPCR檢測反應體系為cDNA(10倍稀釋)4 μl,正向引物(100 μmol/L)0.4 μl,反向引物(100 μmol/L)0.4 μl,SYBR Green/Flourescein qPCR Master Mix (2×)10 μl,純水5.2 μl。反應條件:95℃預變性10 min;95℃變性30 s;60℃退火與延伸30 s;40個循環。獲得P38 MAPK mRNA、PKC mRNA、CaMKⅡ mRNA及GAPDH的Ct值,以目的基因相對于基礎值的表達量2-△△Ct反映各檢測指標的表達水平。

表1 實時定量PCR引物序列
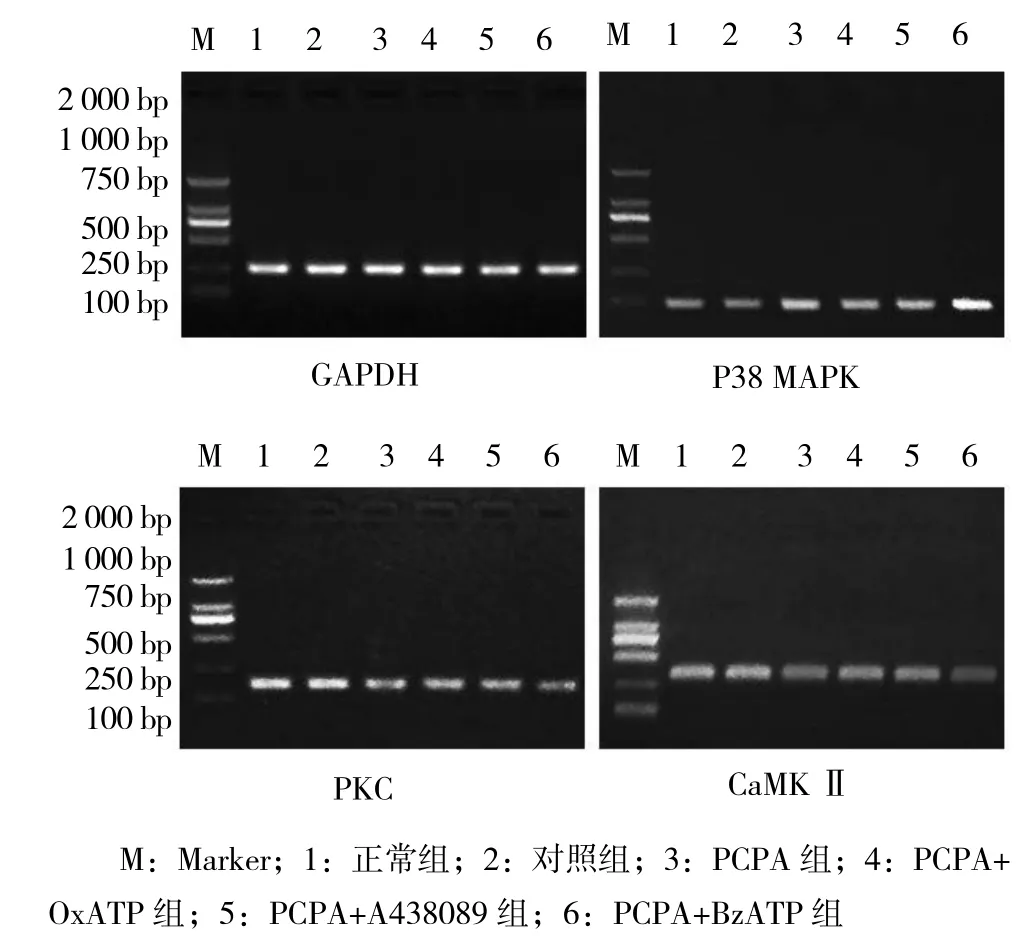
圖1 各組大鼠前額皮質組織P38 MAPK、PKC和CaMK Ⅱ電泳圖
1.3 統計學方法
數據分析采用SSPS 16.0統計軟件,計量資料以均數±標準差(±s)表示,組間比較采用單因素方差分析(One-way ANOVA),在方差分析有意義的基礎上,兩兩比較采用LSD-t檢驗,P<0.05為差異有統計學意義。
2 結果
2.1 各組大鼠大腦皮質P38 MAPK、PKC和CaMK Ⅱ蛋白和mRNA的表達
與對照組 [P38 MAPK(0.190±0.016),PKC(0.472±0.054),CaMK Ⅱ(0.396±0.061)]比較,PCPA 組 P38 MAPK蛋白表達增加(0.370±0.054)(t=7.838,P=0.000),而 PKC(0.258±0.025)(t=-8.881,P=0.000)和 CaMK Ⅱ(0.210±0.054)(t=-5.562,P=0.000)的蛋白表達水平下降(見圖2~5)。PCPA組的P38 MAPK mRNA表達增加,而PKC和CaMK mRNA表達水平下降(均P=0.000)。見表2。
2.2 P2X7受體在PCPA引起的受體后蛋白激酶蛋白表達變化中的作用
與 PCPA 組 [P38 MAPK(0.370±0.054),PKC(0.258±0.025),CaMK Ⅱ(0.210±0.054)]比 較,PCPA+OxATP組及PCPA+A438079組P38 MAPK蛋白 表 達 水 平 下 降 [(0.284±0.038)(0.276±0.035)(t=3.185和3.591,P=0.009和0.004)],但BzATP組P38 MAPK蛋白表達水平升高(0.452±0.046)(t=-2.854,P=0.017)。 與 PCPA 組 比 較,PCPA+OxATP組及PCPA+A438079組PKC蛋白表達水平[(0.344±0.034)(0.376±0.026)(t=-4.963 和 -8.209,均P=0.000)]和CaMKⅡ蛋白表達水平上升[(0.308±0.052)(0.293±0.048)(t=-2.620和-2.281,P=0.009 和 0.018)],而 PCPA+BzATP 組 PKC(0.167±0.019)(t=7.098,P=0.000)和 CaMK Ⅱ(0.112±0.024)(t=4.454,P=0.002)蛋白表達水平下降。見圖2~5。

圖2 各組大鼠大腦皮質P38MAPK蛋白的表達 (免疫組化,×400)
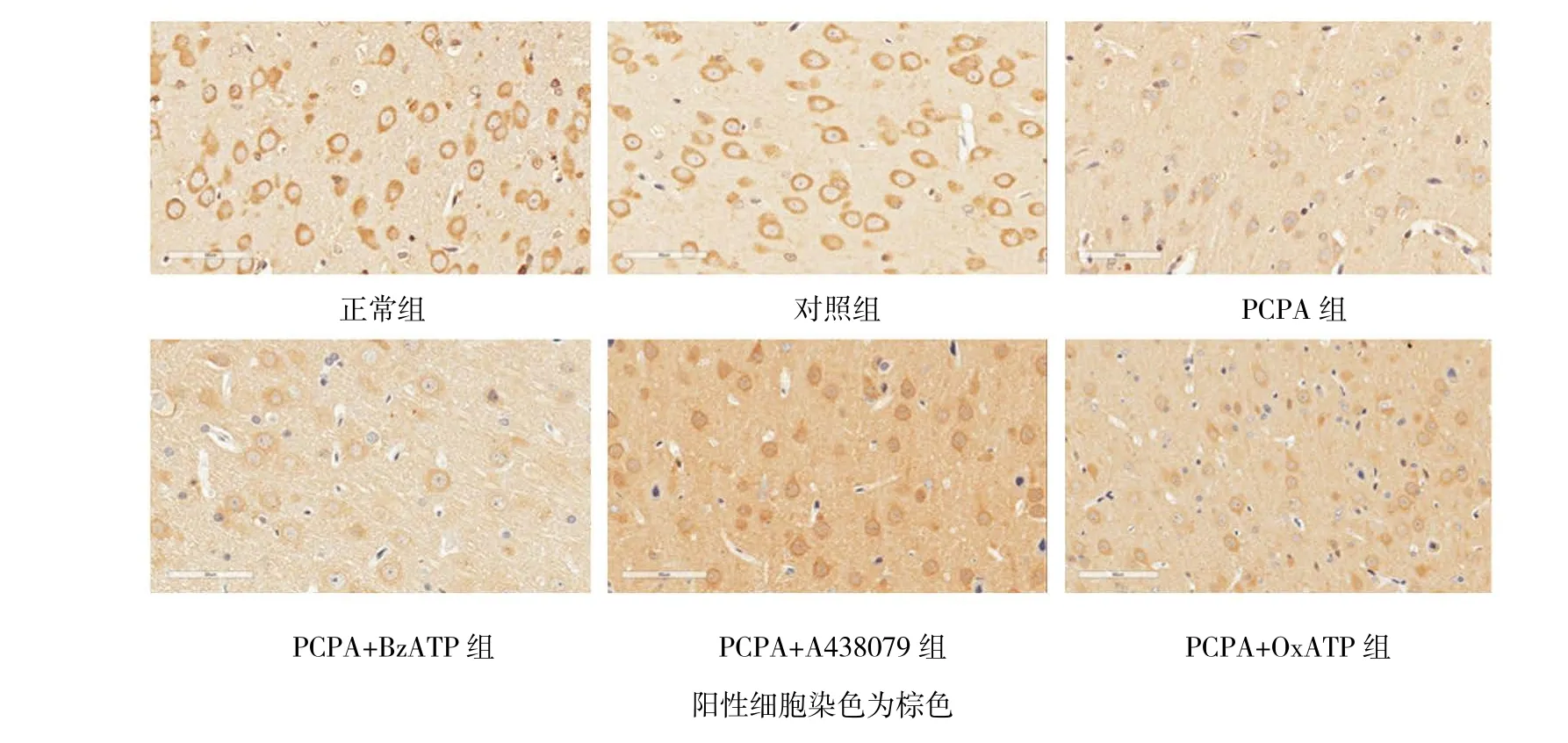
圖3 各組大鼠大腦皮質PKC蛋白的表達 (免疫組化,×400)
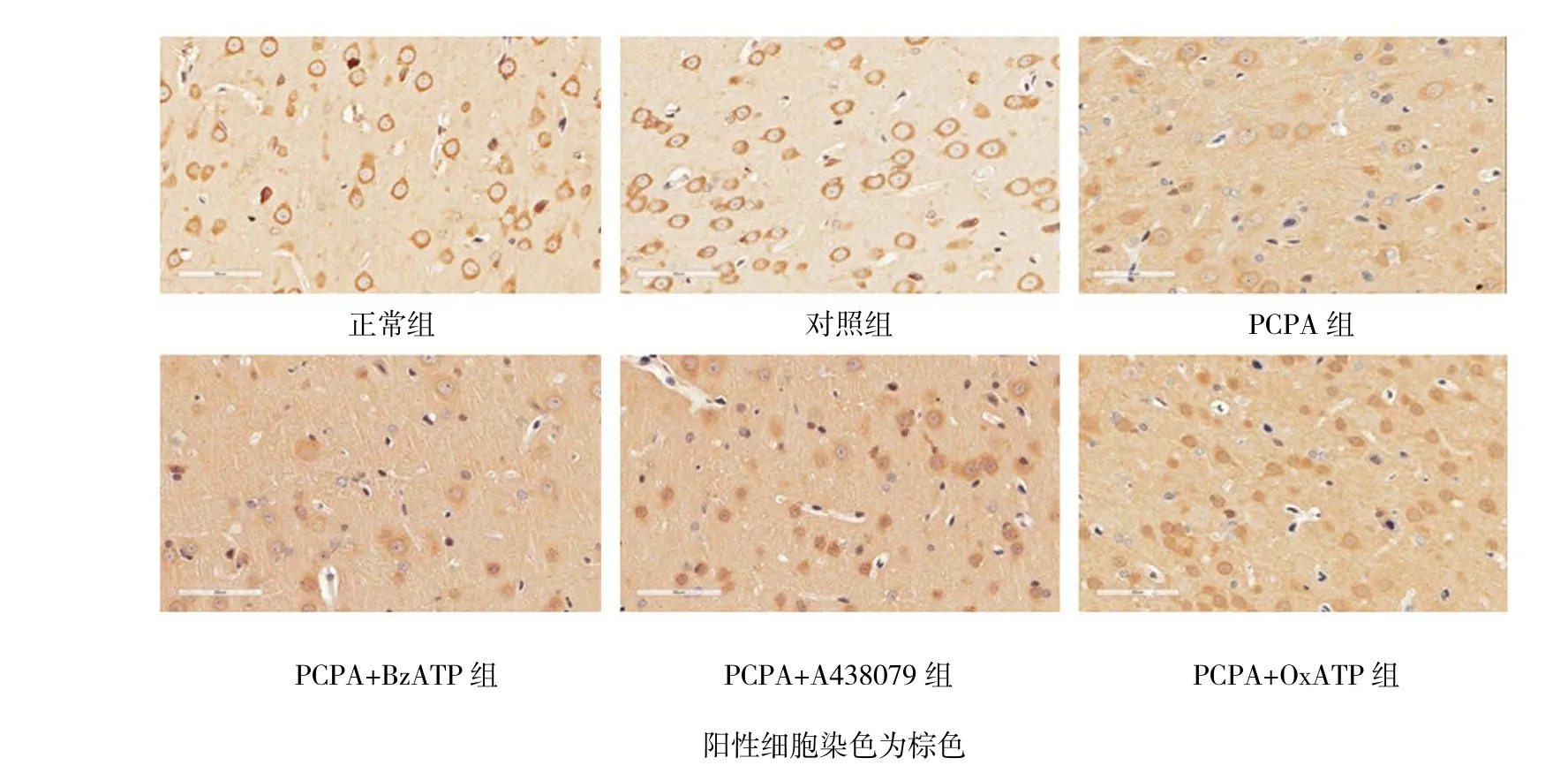
圖4 各組大鼠大腦皮質CaMKⅡ蛋白的表達 (免疫組化,×400)
2.3 P2X7受體在PCPA引起的受體后蛋白激酶mRNA表達改變中的作用
PCPA+OxATP組和A438079組P38 MAPK mRNA表達水平下降,BzATP組P38 MAPK mRNA表達水平上升。OxATP及A438079能引起PKC和CaMKⅡ mRNA表達水平上升,但BzATP引起PKC及CaMKⅡ mRNA表達水平下降。見表2。
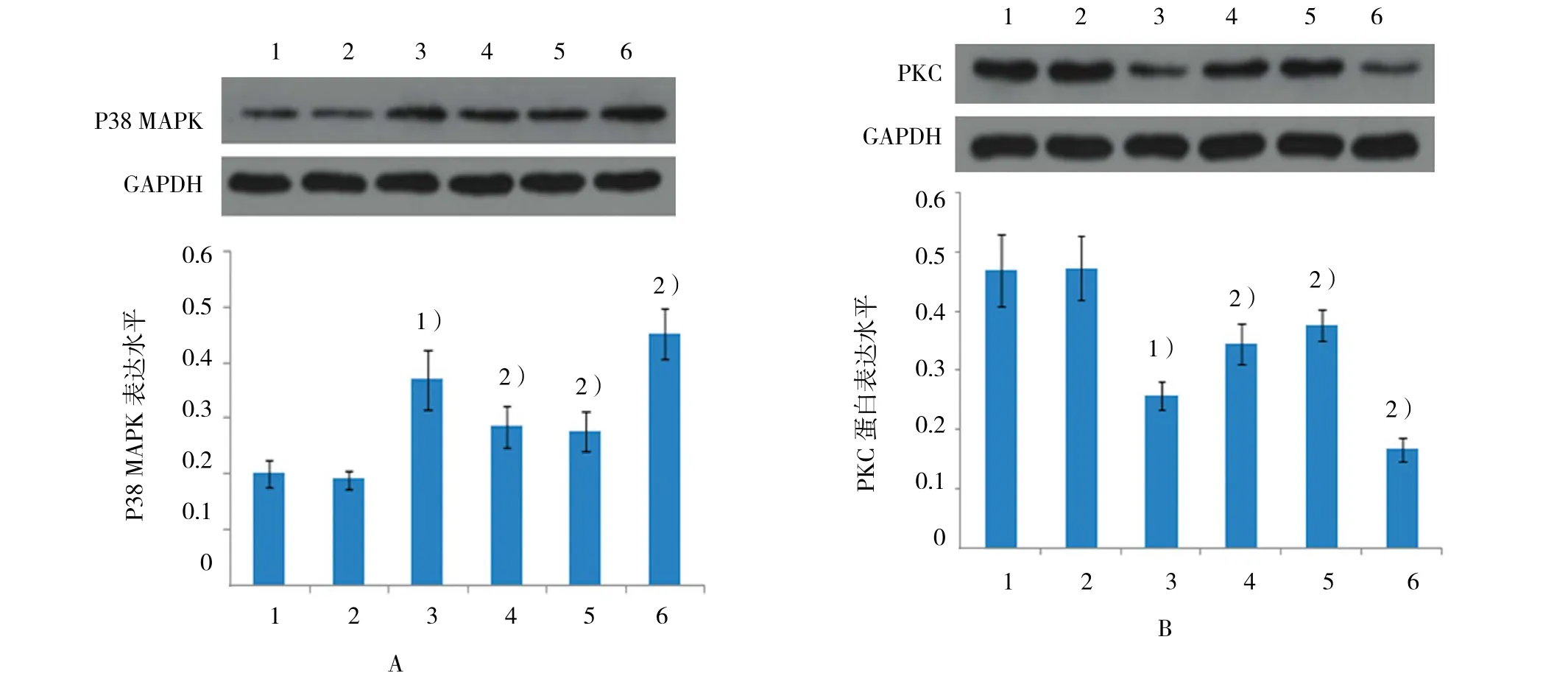
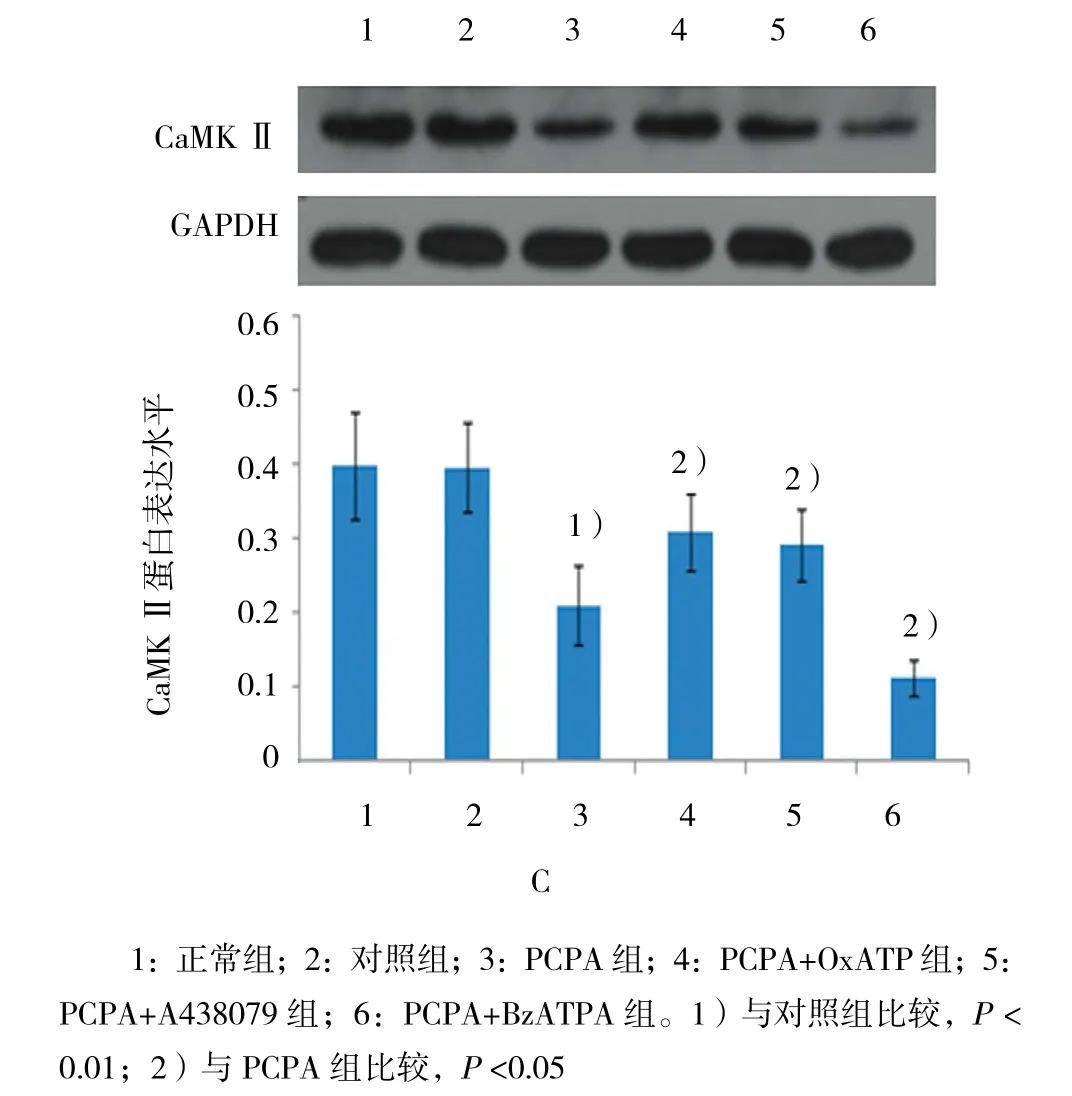
圖5 各組大鼠皮質P38 MAPK、PKC及CaMKⅡ蛋白的相對表達量
3 討論
睡眠障礙在臨床上十分常見,已經成為影響人們健康生活和工作的重要社會問題。眾所周知,5-HT是調節睡眠和覺醒重要的神經遞質,但5-HT是如何與腦內其他調節系統相互作用從而調節睡眠活動目前還不清楚。本實驗前期研究發現,腦內5-HT含量下降可導致神經膠質細胞激活,大腦皮質ATP含量下降,本研究發現,腦內5-HT含量下降能導致前額皮質細胞內蛋白激酶P38 MAPK蛋白及基因mRNA表達增加,PKC和CaMK Ⅱ蛋白及基因mRNA表達水平下降;進一步使用P2X7受體的激動劑和拮抗劑發現P2X7受體參與5-HT含量下降而導致的該細胞內信號蛋白激酶活動變化。

表2 各組大鼠大腦皮質P38 MAPK、PKC及CaMKⅡmRNA相對表達量 (n =6)
嘌呤P2X受體是一類以ATP為配體的離子門控通道,目前已知P2X受體分為8種亞型,即P2X、P2Y、P2T、P2S、P2N、P2U、P2Z和P2D,各種亞型的P2受體可以通過激活不同的細胞內信號轉導通路而執行特定的生理功能。研究發現,P2X7受體與睡眠和覺醒有密切的關系,P2X7受體蛋白水平能隨著睡眠周期的改變而改變[5]。在中樞神經系統內,P2X7R受體廣泛分布于神經元和神經膠質細胞上[7],P2X7受體興奮能引起Ca2+的內流,激活絲裂原活化蛋白激酶(mitogen activated protein kinase, MAPK)、蛋白激酶 C(protein kinase C, PKC)和鈣調蛋白(CaM),改變P38 MAPK、PKC及CaMK等激酶的活性,引起一系列的細胞內反應[8-9]。研究表明,細胞外液的ATP可作用于神經膠質細胞上的P2X7R引起睡眠的調節物質細胞因子如白細胞介素 1(IL-1β)、IL-6、腫瘤壞死因子 α(TNF-α)的釋放,該物質作用于鄰近的神經元,改變突觸后神經元的敏感性[10-13]。
PCPA選擇性抑制色氨酸羥化酶活性而抑制5-HT合成,導致腦內5-HT含量下降,實驗證實,腹腔注射PCPA能導致大鼠大腦皮質5-HT濃度下降約80%[14]。新近的研究發現,5-HT3受體和P2X2受體在同一神經元上共表達,5-HT3受體遠端軸突和樹突靶向信息傳遞依賴P2X2受體的表達,且這種5-HT受體還能與其他P2X受體家族成員發生相互作用[15]。本實驗室前期實驗也發現大鼠大腦皮質神經膠質細胞上5-HT受體和P2X7受體共表達。5-HT含量下降后,可能通過5-HT受體和P2X受體的相互作用,影響P2X7受體的活性及細胞內信號蛋白激酶的活動,改變細胞的功能狀態,影響睡眠調節物質如細胞因子的分泌,最終影響大腦皮質的興奮性活動。
綜上所述,腦內5-HT下降后,可通過P2X受體介導細胞內蛋白激酶P38 MAPK、PKC及CaMKⅡ蛋白及基因mRNA的表達變化,本研究有利于進一步明確促眠藥物的作用環節和作用的靶點,對新藥的研發具有重要的意義。

