褐苞薯蕷ISSR-PCR反應體系的建立與優化
高慧新, 封 毅, 王孝勛, 吳燕春, 戴忠華, 田 慧
(廣西中醫藥大學,廣西南寧 530200)
褐苞薯蕷來源于薯蕷科薯蕷屬植物褐苞薯蕷(DioscoreapersimilisPrain et Burkill),別稱廣山藥、廣西淮山,根莖入藥,主產于廣西桂平、玉林、靈山、陸川、平南等地,野生于海拔100~1 950 m的山坡、路旁、山谷雜木或灌叢中,我國南方各地也均有栽培。中醫用其“補脾養胃,生津益肺,補腎澀精”;壯醫用其“調谷道氣道水道,補肺腎”[1]。褐苞薯蕷在廣西、福建、海南等地被作為山藥地區習用品,藥用與食用由來已久[2]。有研究發現,褐苞薯蕷乙醇提取物各萃取層(石油醚層、乙酸乙酯層和正丁醇層)均表現出較好的抗炎和免疫調節活性[3]。褐苞薯蕷產量大,適應能力強,占領了藥材和食品市場上很重要的部分,是一種重要的藥用植物資源,有研究的必要性。
ISSR即簡單重復序列間擴增(inter simple sequence repeat),是近年應用較多的一種新型DNA分子標記技術,它以微衛星重復序列為引物,通常為16~18個堿基序列,由 1~4 個堿基組成的串聯重復序列和幾個非重復的錨定堿基組成,提高了PCR擴增反應的專一性。同時ISSR標記以其較低的成本、良好的穩定性及重復性、能較好地反映物種的遺傳結構和遺傳多樣性變化等特點,被視為理想的遺傳標記方法[4]。ISSR-PCR反應易受多種因素的影響,本試驗利用單因素結合正交設計的方法,旨在建立適合于褐苞薯蕷 ISSR-PCR 反應的最佳體系,為褐苞薯蕷種質資源遺傳多態性的研究奠定基礎。
1 材料與方法
1.1 試驗材料
1.1.1 供試材料 試驗材料為褐苞薯蕷新鮮葉片,采自廣西中醫藥大學仙葫校區,并由廣西中醫藥大學藥用植物教研室梁子寧副教授鑒定為薯蕷科薯蕷屬植物褐苞薯蕷(DioscoreapersimilisPrain et Burkill)。
1.1.2 試劑與儀器
1.1.2.1 試劑 新型植物基因組DNA提取試劑盒、TaqDNA聚合酶、dNTPs、DNA marker(D2000)、5×TBE均購自天根生化科技(北京)有限公司,瓊脂糖(西班牙),GelRed核酸染料(美國),其他所用試劑均為國產分析純,ISSR-PCR引物由生工生物工程(上海)股份有限公司合成。
1.1.2.2 儀器 Eppendorf移液槍(德國),電子分析天平(賽多利斯BSA224S),超純水機(法國MILIPORE),渦旋混合器(上海滬西XW-80A),高速冷凍離心機(德國Sigma Sartorius),紫外分光光度計(日本島津UV1780),梯度PCR儀(Bio-red T100),電泳儀(Bio-red),凝膠成像系統(Bio-red,gel Doc EZ)
1.2 試驗方法
1.2.1 褐苞薯蕷植物總DNA的提取 根據新型植物基因組DNA提取試劑盒的操作步驟對試驗材料進行植物總DNA的提取,并采用瓊脂糖電泳及紫外分光光度法檢測總DNA的純度及濃度,將其稀釋至30 ng/μL備用。
1.2.2 單因素條件考察 參照文獻[5-7],設定本次試驗ISSR-PCR基本反應體系組成為:總體積20 μL,TaqDNA聚合酶1.5 U,DNA模板量90 ng,dNTPs濃度 0.25 mmol/L,引物濃度0.5 μmol/L,Mg2+濃度1.5 mmol/L,10×Taqbuffer 2.0 μL,其余用ddH2O補齊。擴增程序為:95 ℃ 預變性 5 min;95 ℃變性40 s,52 ℃退火45 s,72 ℃延伸2 min,34個循壞;最后72 ℃延伸5 min,4 ℃保存。以初步篩選出的引物807(AGAGAGAGAGAGAGAGT)作為單因素及正交試驗的引物。對影響ISSR-PCR反應體系的5個因素:TaqDNA聚合酶用量、DNA模板量、dNTPs濃度、引物濃度、Mg2+濃度分別設置6個濃度梯度,采取改變單一因素的方法,來確定該因素對ISSR-PCR的影響,各因素水平如表1所示。將PCR所得產物置于1%瓊脂糖凝膠中,以電壓75 V電泳50 min。使用凝膠成像系統觀察并采集圖像。
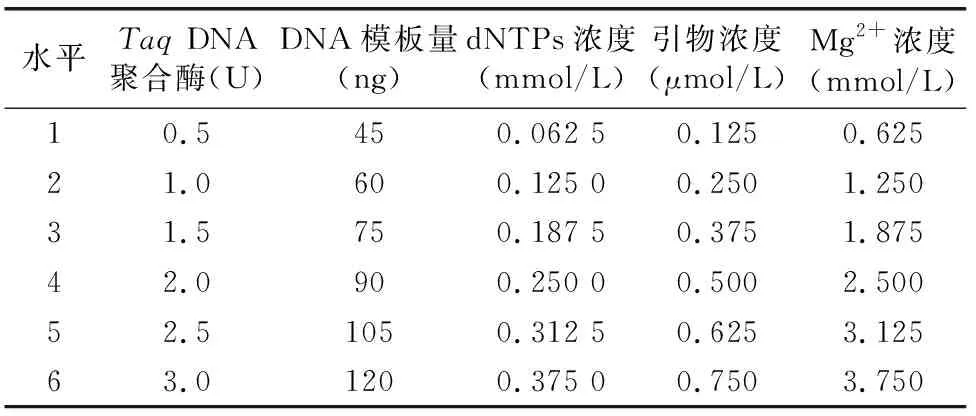
表1 單因素試驗設計
1.2.3 正交試驗設計 采用L16(45)正交試驗設計,根據單因素試驗結果分別確定5個相關因素的4個水平,共16個處理組(表2)。其基礎反應體系和反應程序與單因素試驗一致。
1.2.4 退火溫度的優化 利用PCR,以引物807的Tm值(50±5) ℃為范圍,自動生成8個溫度梯度以優化退火溫度。
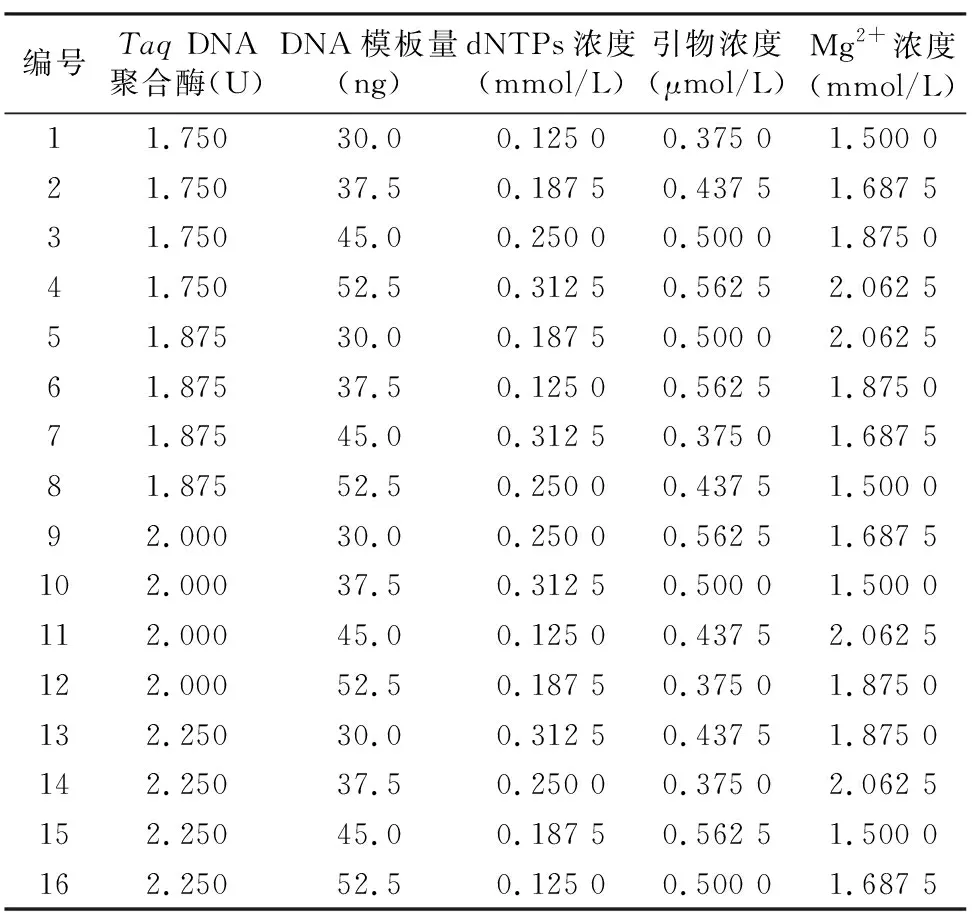
表2 正交試驗設計
2 結果與分析
2.1 Taq DNA聚合酶用量對ISSR-PCR反應體系的影響
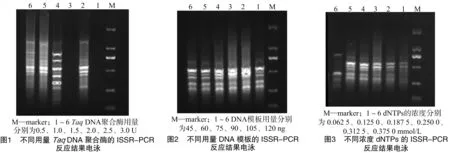
由圖1可知,TaqDNA聚合酶用量在0.5、1.5 U時,均無條帶;在1.0、2.5、3.0 U時,雖有條帶,但并不清晰,且拖尾嚴重;在2.0 U時,條帶清晰明亮,故體系中TaqDNA聚合酶用量應在2.0 U左右。
2.2 DNA模板量對ISSR-PCR反應體系的影響
由圖2可知,DNA模板量在45、105、120 ng時均能顯示清晰明亮的條帶,在60~90 ng時,條帶太亮不清晰,綜合考慮到試驗成本,故體系中的最佳DNA模板量應在45 ng左右,且不超過60 ng。
2.3 dNTPs濃度對ISSR-PCR反應體系的影響
由圖3可知,dNTPs的濃度為0.062 5、0.375 0 mmol/L時,擴增出的條帶少、不清晰;濃度在0.125 0~0.312 5 mmol/L 時,擴增出的條帶多且清晰穩定;故體系中dNTPs的濃度范圍為0.125 0~0.312 5 mmol/L。
2.4 引物濃度對ISSR-PCR反應體系的影響
由圖4可知,隨著引物濃度的增加,擴增條帶也逐漸增強、清晰,在濃度達到0.625 μmol/L時,條帶特異性減弱,引物二聚體增多;故設定體系中引物濃度范圍為0.375 0~0.562 5 μmol/L。

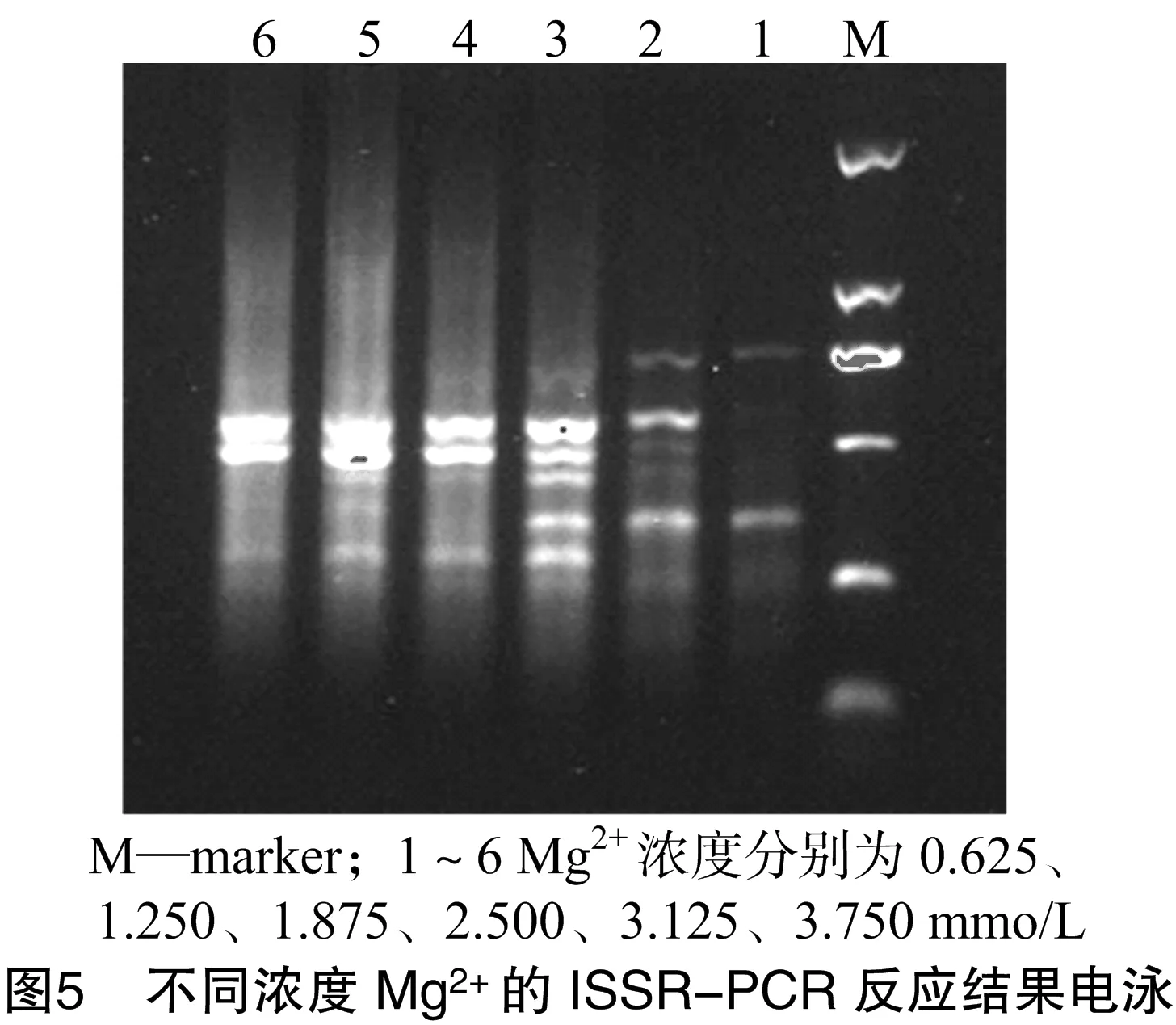
2.5 Mg2+濃度對ISSR-PCR反應體系的影響
由圖5可知,當Mg2+濃度為0.625、1.250 mmol/L時,擴增條帶少;濃度為1.875 mmol/L時,擴增條帶增多且明亮清晰;濃度再增大擴增條帶模糊;故體系Mg2+濃度應在 1.875 mmol/L 左右。
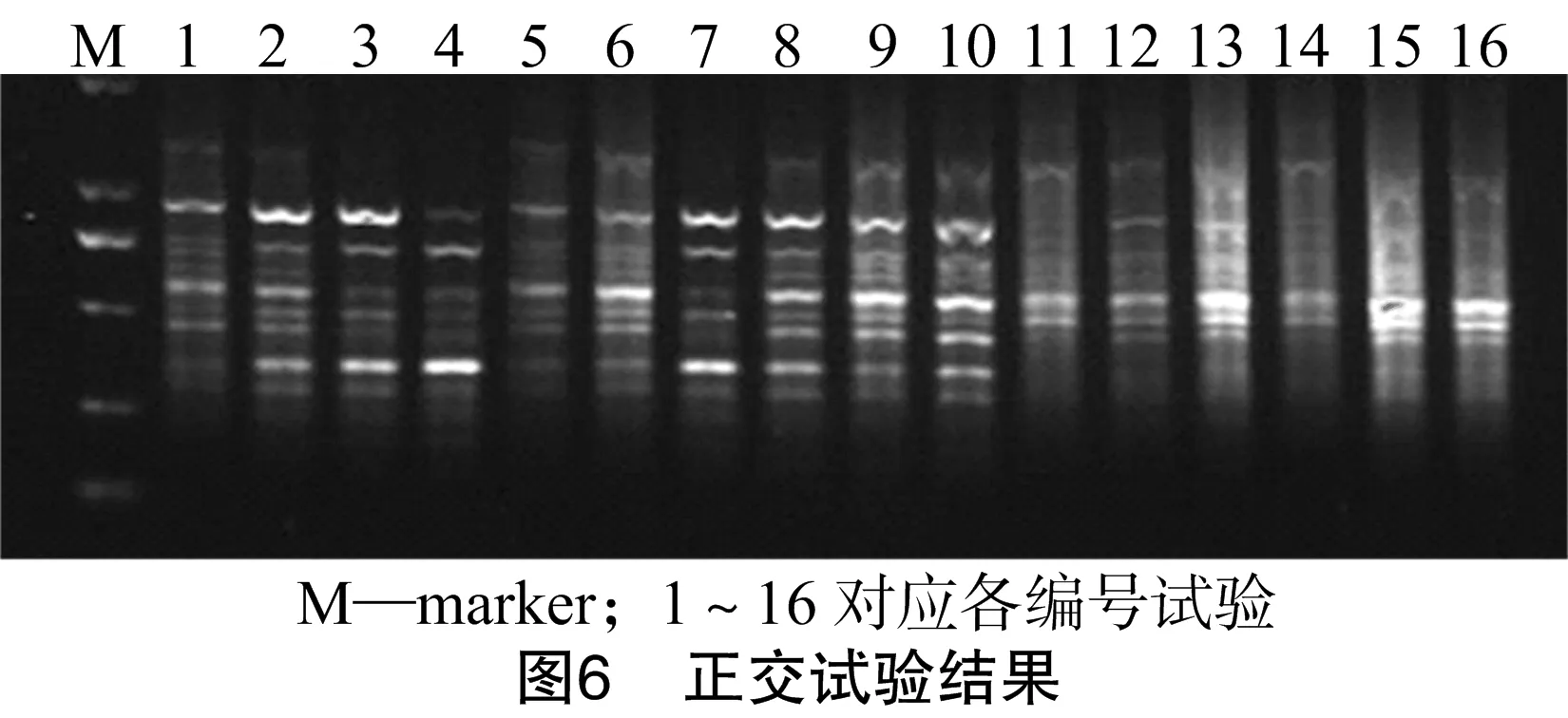
2.6 正交試驗
正交試驗結果如圖6所示,依據擴增條帶的強弱和雜帶的多少,對正交試驗PCR結果進行直觀分析。13號、15號和16號組合擴增條帶太過明亮且背景彌散嚴重,不易辨識;11號、12號和14號組合擴增條帶暗淡模糊,不易識別;1~10號組合擴增出的條帶數量多且清晰明亮,其中8號組合擴增條帶多且帶形清晰明亮,重復試驗發現其擴增效果穩定。故褐苞薯蕷ISSR-PCR最佳反應體系為:20 μL體系,其中10×TaqBuffer 2.0 μL,TaqDNA聚合酶1.875 U,DNA模板量52.5 ng,dNTPs濃度0.25 mmol/L,引物濃度0.437 5 μmol/L,Mg2+濃度 1.5 mmol/L,其余用ddH2O補齊。
2.7 退火溫度的優化
將退火溫度設定在45~55 ℃,PCR儀自動生成8個溫度梯度:55.0、54.2、52.9、51.2、48.9、46.9、45.7、45.0 ℃。由圖7可知,當溫度在52.9、51.2 ℃時,條帶數量相對較多且清晰,故本次試驗采用52 ℃作為退火溫度是合理的。

3 討論與結論
本試驗主要從影響PCR反應的TaqDNA聚合酶、模板DNA、dNTPs、引物、Mg2+為考察點,建立并優化褐苞薯蕷的ISSR-PCR體系。在PCR體系中,TaqDNA聚合酶濃度過高,會引起非特異性產物的擴增;模板DNA的純度和用量都會對PCR擴增有影響;dNTPs濃度過高可加快反應速度,同時也增加堿基的錯誤摻入率和試驗成本,低濃度的dNTPs會導致反應速率下降,但可提高試驗準確性;引物是保證PCR特異性的關鍵因素,濃度偏高會引起錯配和非特異性產物增加、引物之間易形成二聚體,濃度太低又可能得不到擴增結果或產量過低;最佳的Mg2+濃度對于不同的引物和模板都不相同,較高的濃度可以增加產量,但也會增加非特異性擴增,降低忠實度。
本試驗運用單因素結合正交設計的方法,首先確定各因素用量或濃度的有效范圍,再利用正交設計進行優化組合,確立適用于褐苞薯蕷的ISSR-PCR反應體系。試驗結果顯示,5個因素對褐苞薯蕷ISSR-PCR反應體系的影響大小為TaqDNA聚合酶>Mg2+>引物>DNA模板>dNTPs。
本試驗選出的褐苞薯蕷最佳20 μL ISSR-PCR反應體系為:TaqDNA聚合酶1.875 U,DNA模板量52.5 ng,dNTPs濃度0.25 mmol/L,引物濃度0.437 5 μmol/L,Mg2+濃度 1.5 mmol/L,10×TaqBuffer 2.0 μL,其余用ddH2O補齊。

