抗性和非抗性哈薩克羊人工感染包蟲蟲卵早期小腸免疫指標的差異分析
王緒海,蔣 松,李 鑫,張永生,李超程,營瑞文,賈 斌
(新疆石河子大學動物科技學院,新疆 石河子 832003)
1 材料與方法
1.1 試驗材料
1.1.1 試驗動物
試驗哈薩克羊:選擇規模化哈薩克羊場——新疆第九師165團羊場,提供300只哈薩克羊,佩戴耳號,頸靜脈采血于肝素鈉抗凝管,按照要求提取基因組DNA,設計MHC-DBR1基因第二外顯子引物,PCR擴增,PCR產物分別用MvaⅠ,SacⅡ,Hin1 Ⅰ三個內切酶切割,酶切產物用2%瓊脂糖凝膠電泳檢測,進行MHC-DRB1:MvaⅠbc-SacⅡ ab-Hin1 Ⅰ ab抗包蟲病單倍型分析;同時經過B超和深圳康百得ELISA免疫試劑盒檢測確認未感染包蟲病,購買7只健康的綿羊,其中用于人工感染試驗的綿羊6只(抗性組和非抗性組各3只),以及非抗性對照綿羊1只。MHC抗性組綿羊(KSP-AI)記為A組,MHC非抗性組綿羊(KSN-AI)記為B組,對照組綿羊(KSN-UAI)記為C組。購買飼養于大學動物養殖實驗房,再人工攻蟲感染試驗。
試驗犬:從新疆生產建設兵團第八師牧區團場購買哈薩克牧羊犬5只,購買后飼養于石河子大學動物科技學院動物試驗站隔離犬舍。
經過檢測確定為綿羊包蟲病的病變肝、肺20個,均由烏魯木齊屠宰場和新疆第八師石河子市獸醫衛生監督所提供。
1.1.2 試劑與儀器
1.1.2.1 試劑
試驗檢測包蟲病和其他常規所需的試劑:綿羊包蟲病ELISA診斷試劑盒(深圳康百得公司);B超耦合劑、十二烷基硫酸鈉(SDS)、Tris飽和酚、無水乙醇、氯仿、異戊醇(石河子北生物商貿有限公司);溴酚(藍天津市魯鑫化工科技有限公司);檸檬酸鈉、檸檬酸、葡萄糖、EDTA(石河子聯華商貿有限公司);DNA Marker DL2000、DNA Marker DL500、Taq酶、限制性內切酶MvaI、SacII、Hin1I、HaeIII(寶生物有限公司);瓊脂糖Merck(西班牙);蛋白酶K(Sigma,美國);DNA green view(北京天恩澤基因有限公司);MHC-DRB1 exon2引物(上海生工生物工程公司)。
利用綿羊包蟲病變肝臟囊液人工感染哈薩克犬獲取蟲卵試驗所用的試劑:吡喹酮(獸藥字(2012)310021174);地塞米松(獸藥字(2012)290112530);靜松靈(獸藥字(2009)280031579);丙硫苯咪唑(新獸藥字(2012)X 048745)購買于石河子大學動物科技學院動物醫院;氯化鈉(NaCl)、硫酸鎂(MgSO4)、“84”消毒液、新潔爾滅消毒水、堿石灰(鈉石灰)等購自石河子北生物商貿有限公司。
哈薩克羊人工感染細粒棘球絳蟲后早期腸道免疫指標測定試驗所用的試劑:綿羊血清抗體(IgM、IgE、IgG、SigA)、細胞因子(TNF-α、IFN-γ、IL-2、IL-4)及趨化因子(CCL8)ELISA試劑盒均購自上海藍基生物科技有限公司。
1.1.2.2 儀器
便攜式獸用B超儀,50 S Tringa Vet_Pie Medical(荷蘭);電熱恒溫水浴鍋,DKB-501A型(上海精密試驗設備有限公司);電子天平BL310(Sartorius公司,德國);NANODROP1000核酸蛋白分析儀(Thermo,美國);電熱恒溫鼓風干燥箱,GZX-9240MBE(上海博迅醫療設備廠);臺式高速離心機(Thermo,美國);PCR擴增儀,PTC-100TM型,BIO RAD凝膠成像分析系統(BIO RAD公司) 。
1.2 試驗方法
1.2.1 哈薩克羊MHC-DRB1 exon2包蟲病抗性、非抗性基因型個體的篩選
1.2.1.1 試驗綿羊包蟲病的診斷
根據WHO-IWGE推薦診斷包蟲病的方法[1],采用影像學(B超)和血清學(ELISA)相結合的方法對300只哈薩克羊包蟲病檢測。
影像學(B超)檢測:先肝臟區(右側9~11肋間)被毛,涂抹耦合劑,B超顯像,對圖像凍結、測量分析,同時記錄羊耳號。
按照ELISA試劑盒說明書檢測包蟲病,采用包蟲囊液抗原作固相抗原對羊血清中的特異性包蟲抗體檢測。該試劑盒具有操作簡便、準確、實用。
陽性判定:先肉眼觀察,顯黃色可判為陽性。用酶標儀于450 nm(620 nm作參比波長)讀取OD值。以空白對照孔調零后測各孔OD值,待檢OD值大于陰性對照2.1倍者為陽性。
1.2.1.2 包蟲病抗性、非抗性的哈薩克羊個體篩選
采用新疆生產建設兵團第九師165團規模化羊場300只哈薩克羊作為試驗對象,參照前期建立方法[2]篩選出的包蟲病非抗性相關的遺傳標記MHC-DRB1 Mva I bb-SacII aa-Hin1 I aa和抗性相關遺傳標記MHC-DRB1 exon 2 Mva Ⅰ bc-SacⅡ ab-Hin1 Ⅰ ab,對其進行MHC-DRB1 exon2多態性與包蟲病抗性進行關聯性分析,具體方法如下:
(1)綿羊基因組DNA的提取及質量的檢測 先對300只哈薩克羊頸靜脈采集血液,肝素鈉抗凝,-20℃保存。從-20℃凍存抗凝全血中按照酚-氯仿抽提法提取基因組DNA,并溶解于滅菌去離子水,適當稀釋之后,4℃保存。
DNA 濃度和純度的測定:取待檢測DNA溶液約2μL置入一高壓滅菌的1.5 mL離心管中;在紫外分光光度計260 nm波長處,測定 OD 值;同時在 280 nm波長處測定OD值;DNA 濃度(μg/mL)= OD值×50;DNA 純度= OD 260 nm值/OD 280 nm值。比值在1.8~2.0為合格。
瓊脂糖凝膠電泳檢測試驗:對合格的DNA樣品進行瓊脂糖凝膠電泳檢測:取DNA 溶液2.5 μL和溴酚藍緩沖液2 μL混勻,點樣于0.8%的瓊脂糖凝膠,在電泳儀上120 V 電壓電泳35 min左右,取出膠置于凝膠成像系統中進行拍照。
再從電泳圖中看到條帶整齊、清晰,則說明DNA樣品濃度純度較好,保存在-20℃備用。
(2)引物設計及PCR擴增 利用巢式PCR技術從所提取的DNA中擴增MHC-DRB1片段,引物參照文獻[3]。
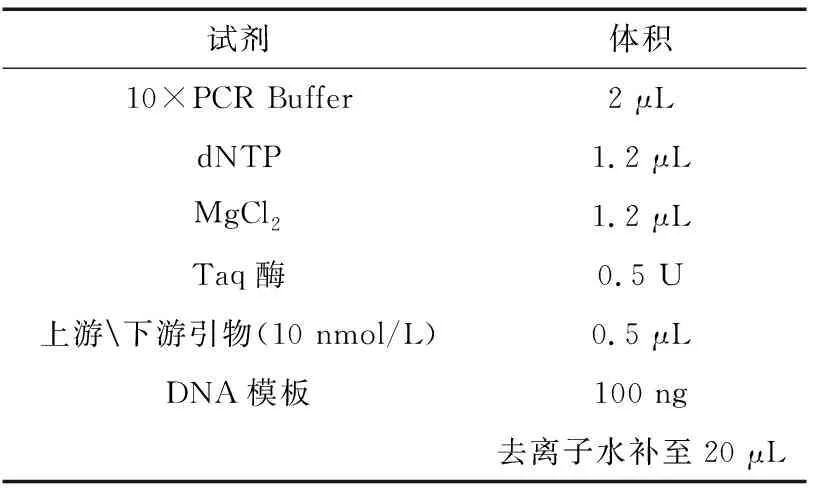
表1 一輪擴增反應體系(試劑及用量)Table 1 round amplification reaction system(Reagents and dosage)
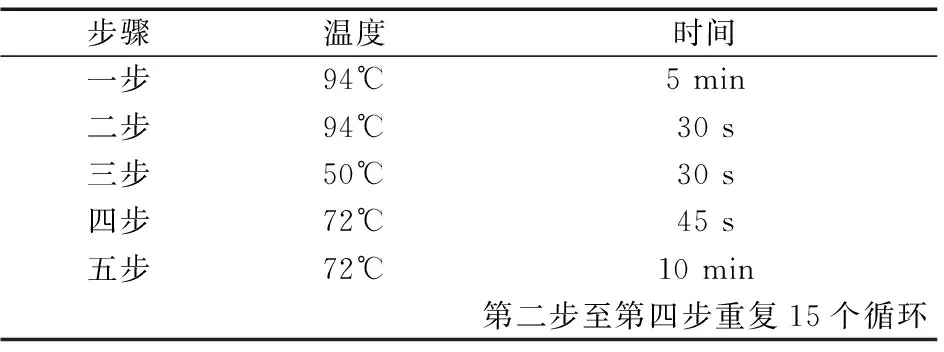
表2 一輪擴增體系(溫度及時間)Table 2 round amplification system(Temperature and time)
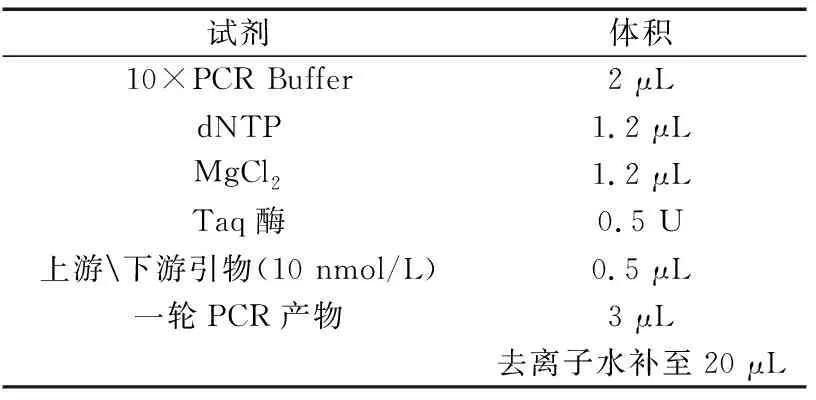
表3 二輪擴增反應體系(試劑及用量)Table 3 two round amplification reaction system (Reagents and dosage)
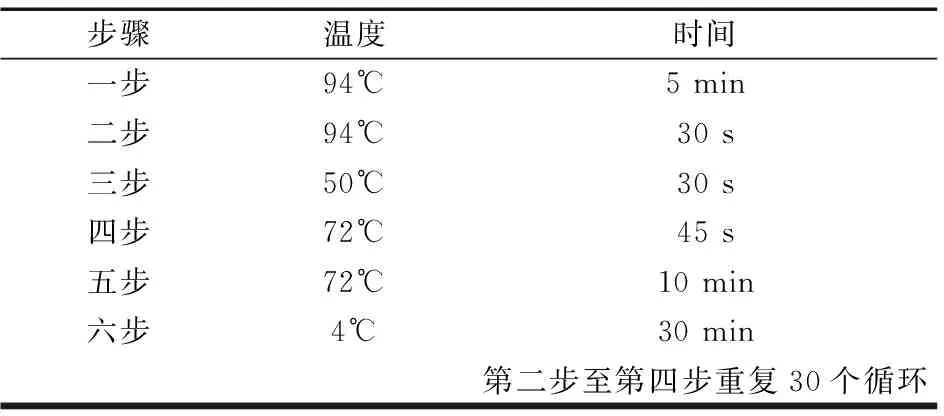
表4 二輪擴增體系(溫度及時間)Table 4 two round amplification system(Temperature and time)
PCR產物經2%瓊脂糖凝膠電泳分析驗證。
(3) PCR產物酶切 對2輪PCR產物分別進行MvaⅠ、SacII、Hin1I的單酶切反應。

表5 酶切反應體系Table 5 enzymatic reaction system
37℃水浴鍋內水浴4 h。酶切產物經2%瓊脂糖凝膠電泳后,進行凝膠成像系統分析統計酶切結果。
1.2.1.3 數據分析
采用PCR-RFLP法分析哈薩克羊MHC-DRB1酶切基因型與包蟲病抗性或易感性的關系。
1.2.2 試驗綿羊人工口服感染細粒棘球絳蟲模型的建立
1.2.2.1 細粒棘球絳蟲蟲卵的獲取及收集
購買5只2歲健康當地土犬,飼養于石河子大學動物科技學院動物試驗站隔離犬舍,用阿苯達唑片和吡喹酮驅蟲2次,驅除腸道寄生蟲;攻蟲前1天肌肉注射地塞米松磷酸鈉降低犬的抵抗力。同時收集有包蟲病包囊的羊肝,用50 mL注射器抽出包囊液口服飼喂給犬,肝臟一并飼喂。飼養大約42~48天后,采集犬的糞便,涂抹在載玻片上,用顯微鏡檢測犬的糞便,觀察到有蟲卵后,立即安樂死處死犬。取犬的十二指腸和空腸前半段裝入干凈的袋子,將腸道組織剪開立即放到37℃的裝有生理鹽水的燒杯中約2~3 h,同時將處死的犬深埋。待腸道組織完全展開,細粒棘球絳蟲成蟲露出后,用1 mL槍頭吸取成蟲到裝有生理鹽水37℃的干凈瓶子中。將成蟲搗碎,收集蟲卵(圖1)。用percoll液純化蟲卵。保存在-4℃。全部過程都在嚴密防護的條件下進行。
圖1細粒棘球絳蟲形態(A)及孕節(B)
Fig 1 Modality of Echinococcus granulosus
獲取及收集細粒棘球絳蟲蟲卵的整個試驗操作過程要嚴格遵照試驗安全要求,試驗操作人員均穿實驗服、外穿一次性防護服,戴口罩、帽子、手套,穿長筒膠鞋和膠套;試驗結束后對隔離飼養試驗犬舍進行全面消毒,地面、墻面及污染的地方噴灑3%燒堿液,再用高錳酸鉀和甲醛熏蒸;試驗完所有試驗器材噴灑2%新潔爾滅消毒液和10%次氯酸鈉,殺滅可能殘留的蟲卵;最后整個試驗中用到的防護用品全部焚燒銷毀和深埋,以免對周圍環境造成污染。
1.2.2.2 人工感染試驗
將收集分離得到的細粒棘球絳蟲(帶孕節)和蟲卵進行人工感染試驗,試驗哈薩克羊采用口服感染蟲卵的方法,分別挑取25個細粒棘球絳蟲放入盛有生理鹽水的培養皿中,然后用20 mL的注射器抽取,并用生理鹽水反復沖洗培養皿,確保25個蟲子都吸取到注射器里,抗性組和非抗性組每只羊口服25個成蟲孕卵節片(蟲卵約1萬~1.5萬枚),對照組口服生理鹽水。將所有試驗羊隔離編號飼養于石河子大學動科院試驗站試驗羊舍。
1.2.3 哈薩克羊不同MHC-DRB1基因型個體人工感染細粒棘球絳蟲后早期腸道免疫指標的測定
1.2.3.1 樣品采集
攻蟲后6 h、8 h、10 h分別處死抗性組和非抗性組綿羊各1只(總共6只),并在最短時間內采集綿羊小腸組織(包括十二指腸段、空腸段(空腸前段、空腸中段、空腸后段)、回腸段),每個組織采取1 g勻漿所加1 mL PBS,分離勻漿離心腸道黏膜組織取上清液測定相關抗體的水平,同時頸靜脈采血5 mL,3000 g/min離心10 min,分離血清,分裝保存于-80℃備用。
1.2.3.2 抗體、細胞因子及趨化因子的檢測
按照ELISA試劑盒說明書檢測綿羊抗體(IgM、IgE、IgG)、細胞因子(IL-2、IL-4、 SigA、TNF-α、IFN-γ)及趨化因子(CCL8)。
1.3 試驗數據處理
1.3.1 哈薩克羊抗性、非抗性基因型篩選
參照前期團隊方法對MHC基因型與包蟲病關聯性進行篩選。
1.3.2 侵染期腸道免疫指標數據處理及分析
上述免疫因子檢測數據用SPSS19.0軟件分析,采用單因子方差分析(one-way ANOVA,LSD)統計結果顯著性檢驗,所有數據均用平均數±標準差(±SD)表示,當P<0.05,表示差異顯著;P<0.01,表示差異極顯著。
2 試驗結果與分析
2.1 篩選出的包蟲病抗性、非抗性哈薩克羊個體
進行MHC-DRB1:MvaI bb-SacII aa-Hin1 I aa非抗性單倍型分析;MHC-DRB1:MvaI bc-SacII ab-Hin1 I ab抗包蟲病單倍型分析,根據基因分型結果,返回羊場選擇綿羊個體。
2.2 人工模型的建立
本試驗采用綿羊包蟲病病變的肝臟囊液,口服飼喂感染試驗哈薩克犬,45天后從犬糞便中檢測蟲卵是否感染,從犬小腸收集大量的細粒棘球絳蟲成熟孕節,其感染力強,可以滿足后續試驗。
2.3 抗性和非抗性哈薩克羊個體人工感染細粒棘球絳蟲早期腸道免疫指標差異分析
2.3.1 抗體的差異分析
包蟲病抗性、非抗性基因型綿羊在人工感染細粒棘球絳蟲后,表現出的抗體分泌水平不同,圖2顯示了兩組綿羊在感染細粒棘球絳蟲6 h、8 h、10 h,機體小腸中IgE、IgG、IgM的表達水平。
綿羊小腸細粒棘球絳蟲早期感染過程中,總體來看,IgE抗性組高于非抗性組,且在空腸后段有顯著差異(P<0.05)(圖2.A)。IgG抗體在感染過程中,整體上抗性組低于非抗性組,在空腸前段有顯著性差異(P<0.05)(圖2.B)。IgM抗體在感染過程中,總體上抗性組高于非抗性組,在回腸抗性組明顯高于非抗性組(P<0.01)。抗性組IgM分泌呈逐步上升趨勢,而非抗性組IgM分泌不規律(圖2.C)。
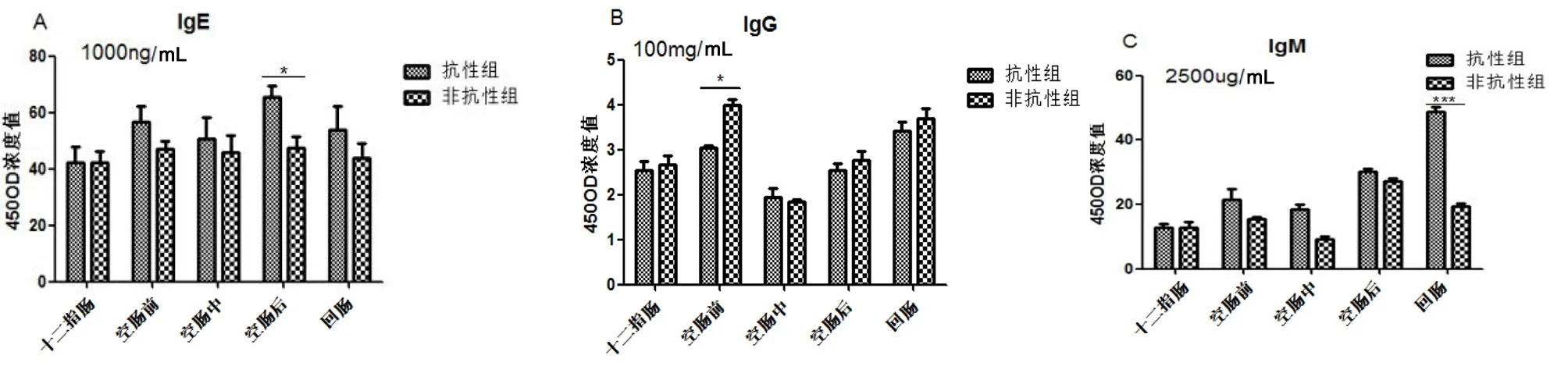
圖2免疫球蛋白IgE、IgG、IgM在抗性組和非抗性組的分泌情況
(***表示:P<0.01,差異極顯著)
Fig 2 the secretion of immunoglobulin IgE, IgG, IgM in the resistance group and non-resistant group
(*** indicates:P<0.01, the difference was significant)
2.3.2 Th1和Th2細胞因子的差異分析
2.3.2.1 Th1細胞因子
哈薩克羊人工感染細粒棘球絳蟲蟲卵早期,回腸抗性組IL-2水平顯著低于非抗性組(P<0.05),其他腸段,抗性組與非抗性組基本持平。抗性組IL-2的含量在感染早期有逐步上升的趨勢, 非抗性組更加明顯(圖3.A)。
對于TNF-α,抗性組小腸TNF-α的含量均低于非抗性組,但差異不顯著。兩組TNF-α的分泌先在空腸前升高,后逐步降低(圖3.B)。
就IFN-γ而言,總體上,抗性組小腸IFN-γ的分泌均高于非抗性組,且在十二指腸和空腸前段差異顯著(P<0.05)。兩組IFN-γ的分泌在感染早期開始上升,在空腸前達到峰值隨后呈下降趨勢(圖3.C)。

圖3細粒棘球絳蟲蟲卵感染哈薩克羊后Th1細胞因子在抗性組和非抗性組的分泌
(*表示:P<0.05,差異顯著)
Fig 3 the secretion of Th1 cytokines after Kazakh sheep infected with E.granulosus tapeworm eggs in the resistance group and non-resistant group
(* Indicates:P<0.05, significant difference)
2.3.2.2 Th2細胞因子
圖4顯示兩組小腸IL-4分泌水平在十二指腸和空腸前先升高隨后呈現下降趨勢,差異不顯著。
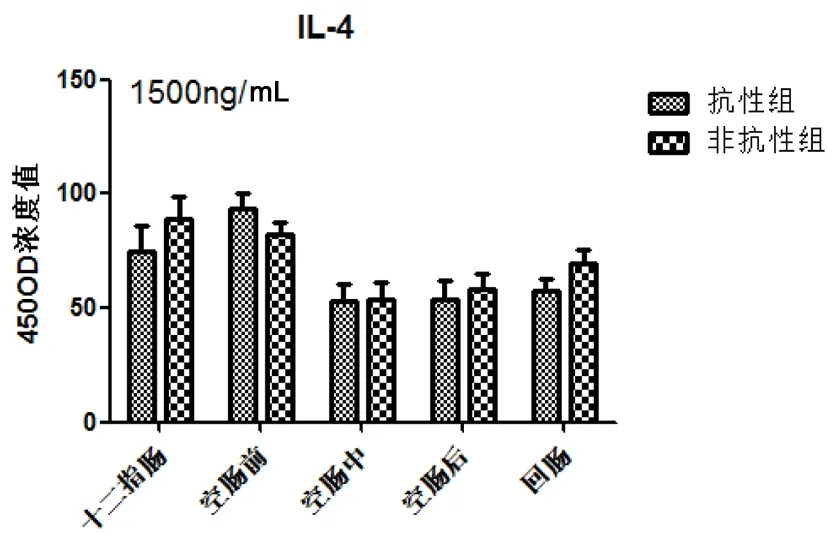
圖4 細粒棘球絳蟲蟲卵感染哈薩克羊后
圖5顯示抗性組和非抗性組SigA在十二指腸和空腸前分泌升高,隨后呈現下降趨勢,且抗性組高于非抗性組,且在十二指腸和空腸有差異顯著(P<0.05)。
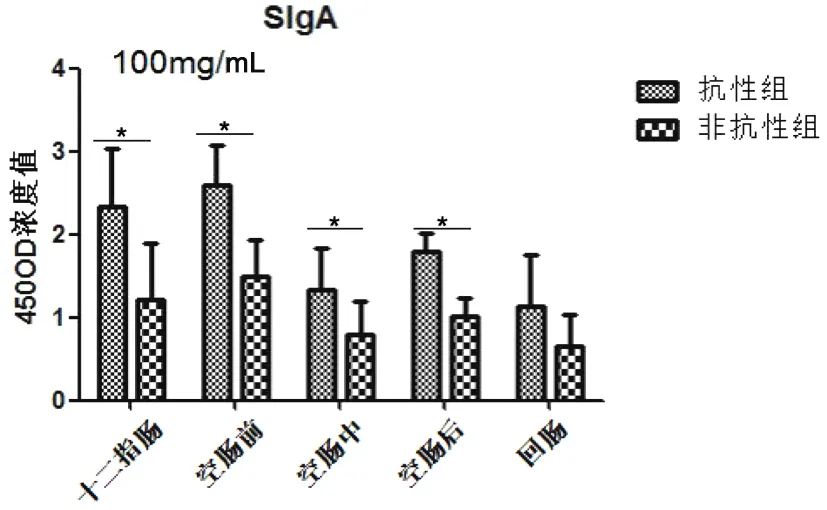
圖5 細粒棘球絳蟲蟲卵感染哈薩克羊后
2.3.3 趨化因子的差異分析
抗性組和非抗性組在人工感染細粒棘球絳蟲,趨化因子(CCL8)在總體上抗性組低于非抗性組。在十二指腸分泌水平升高,而后呈下降趨勢,兩組間差異不顯著(圖6)。
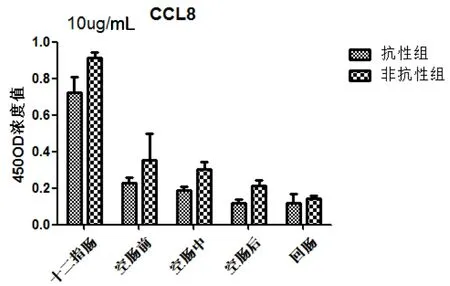
圖6 細粒棘球絳蟲蟲卵感染哈薩克羊后CCL8在抗性組和非抗性組的表達
3 討論
研究表明,遺傳因素影響著生命活動的多種過程。免疫應答發生與否及其發生的強弱均受控于遺傳因素。對于特定抗原的刺激,不同的個體所產生的免疫應答水平是有差異的。個體間免疫應答能力的差異由特定的MHC等位基因決定。因為免疫應答的強度或有無受MHC多態性控制T細胞對抗原的識別影響。MHC等位基因不同的個體,其免疫應答能力存在差異。群體中不同個體所攜帶的MHC等位基因型也是不同的,因此所編碼的MHC分子結合特定抗原肽的能力就有差異。MHC分子的多態性制約著T細胞的激活,因為T細胞所識別的抗原肽必須是與MHC I類或MHC II類分子結合的抗原肽,從而使不同個體表現出不同的免疫應答效應[4]。
宿主感染細粒棘球絳蟲后,可分為兩個階段:包囊形成前(六鉤蚴侵入階段)和包囊形成后,其界限為蟲卵引起6天左右的原發感染。宿主對包囊完全形成的抵抗是很微弱的[5],因此研究六鉤蚴侵染早期的機制非常重要。目前,對六鉤蚴侵染早期的免疫研究不多,尤其是包囊形成前這一階段。因此本研究通過讓細粒棘球絳蟲人工感染抗性和非抗性綿羊試驗,探索這兩種基因型綿羊在感染細粒棘球絳蟲后早期機體的免疫變化。惠文巧等報道,通過對單倍型Mva I bc-Sac II ab -Hin1 I ab綿羊抗細粒棘球蚴和非抗細粒棘球蚴感染小腸測序發現,在抗性和非抗性的綿羊中有195個差異表達基因,其中105個基因是與免疫相關的。這些基因中,大多數上調基因,與先天免疫有關,包括先天免疫細胞(巨噬細胞、NK細胞、肥大細胞和嗜堿性粒細胞)和先天免疫分子(細胞因子、趨化因子、補體、溶解酶和內凝集素—2)[6]。更好地了解宿主對包蟲在小腸組織早期免疫應答。
本研究對小腸組織中的免疫球蛋白和部分細胞因子、趨化因子進行了ELISA試驗,發現抗性、非抗性綿羊人工感染細粒棘球絳蟲后表現出不同的免疫應答能力。抗性組綿羊以抗體IgE、IgM,細胞因子SIgA分泌水平升高,而非抗性組則表現出以抗體IgG、細胞因子IL-2、IFN-γ分泌水平升高。
3.1 抗體的差異分析
研究報道,血清中IgE抗體在感染細粒棘球絳蟲的病人腸道免疫中起著重要作用[7],特別是在殺傷六鉤蚴過程中發揮重要作用[8]。本研究發現,小腸IgE抗體在細粒棘球絳蟲感染10 h后,抗性組高于非抗性組,且有差異顯著(P<0.05)。據報道,蟲卵經口服感染進入動物經胃腸道孵化為六鉤蚴約需2 h[9],因此在蟲卵感染后10 h有可能為六鉤蚴穿越腸壁進入血液的過程,并且抗性組綿羊小腸各段IgE抗體分泌水平顯著高于非抗性組,并與抗原結合后會促使肥大細胞釋放大量的趨化因子和炎性介質,募集大量補體和吞噬細胞抵抗六鉤蚴的侵入,損傷六鉤蚴和減少六鉤蚴的存活數量,從而阻止其進入肝臟形成包囊,這有可能之所以抗性組綿羊抵抗包蟲病能力強于非抗性組綿羊。
小腸中IgG抗體水平在抗性組低于非抗性組,且高于IgE表達水平。另外發現抗性組小腸IgG含量在空腸前段達到峰值,推測IgG在腸道抵抗六鉤蚴的早期侵入過程中不發揮主要作用。Pater等[9]發現在C57BL/6J小鼠腹腔注射多房棘球絳蟲囊泡,IgG抗體在感染后2周檢測到穩定增加,在感染后14周,總的IgG濃度占到92%。
小腸IgM抗體:IgM在早期感染中發揮重要的免疫防御作用[4],本研究發現,綿羊感染細粒棘球絳蟲后10 h,IgM抗體在總體來看,抗性組高于非抗性組,在回腸差異顯著,而在其他小腸各段差異不明顯。另外發現非抗性組小腸IgM含量在感染后10h內空腸中段顯著下降。Pater等[9]通過口服多房棘球絳蟲蟲卵感染Balb/C小鼠(包蟲病易感小鼠)后發現早期機體血清IgM水平顯著下降,直到感染后第8周才開始上升。Pater等[9]推測這種早期機體分泌的IgM水平較低可能與易感性有關,據此,推測推測抗性組綿羊因其自身分泌相對較高的IgM抗體在蟲體的早期感染中發揮了重要的免疫防御作用。
在抗體水平上,IgE、IgM的分泌在抗性組都高于非抗性組,其中IgE的分泌趨勢都比較一致,而IgM分泌從十二指腸到空腸再到回腸依次逐步增加,IgG在抗性組的分泌水平低于非抗性組。據此推測,綿羊在人工感染細粒棘球絳蟲后,IgE、IgM在綿羊小腸發揮著重要的免疫作用。
3.2 細胞因子的差異分析
本試驗通過對抗性和非抗性哈薩克羊人工感染細粒棘球絳蟲蟲卵后,使用ELISA試劑盒檢測了小腸分泌的Th1、Th2細胞因子,發現兩種細胞分泌的細胞因子含量有所差異。以Th1細胞因子IFN-γ、TNF-α、IL-2為代表,抗性組IFN-γ含量高于非抗性組,而IL-2、TNF-α正好相反。Th2細胞因子中SigA分泌在抗性組高于非抗性組,而IL-4分泌水平相當。由于不同的MHC基因型個體會表現出不同的抗病力,而兩組綿羊在相同劑量細粒棘球絳蟲的刺激下,血清中Th1細胞因子含量有差異,這種差異很可能與動物機體的MHC基因型有關。
3.2.1 Th1細胞因子
IL-2由活化的CD4+Th1細胞產生,具有廣泛的生物活性。可以促進Th0和CTL的增殖,因此是重要的調控免疫應答的因子。IL-2參與T細胞的增殖和活化[10],前期研究中,IL-2在抗性綿羊是上調的[11]。而在本研究中,IL-2在抗性組的表達低于非抗性組。
TNF-α由巨噬細胞、樹突狀細胞,中心粒細胞和Th1細胞產生主要參與炎癥前信號通路,比如細胞因子產生和細胞凋亡[12-13]。TNF抑制在克羅恩病治療中起重要作用[12]。有研究報道,細胞因子γ干擾素(IFN-γ)水平可以作為依賴巨噬細胞的原頭節殺傷效應[14]。前期研究發現,哈薩克羊人工感染細粒棘球絳蟲后,抗性組綿羊血清IFN-γ、TNF-α的含量高于非抗性組綿羊,尤其是IFN-γ在感染后4 h、9 h、1 d和7 d,差異是比較顯著的,TNF-α在感染后4 h,組間差異顯著[15]。本研究中,TNF-α在抗性組綿羊中的十二指腸和回腸表達上升,在空腸前段表達下降分泌低于非抗性組。結果表明TNF-α在小腸可能促進了表皮細胞和Th1細胞的凋亡,從而減輕了免疫應答。而IFN-γ在十二指腸、空腸前分泌水平顯著高于非抗性組,表明IFN-γ可能在小腸前端參與了細粒棘球絳蟲蟲卵感染的免疫應答。
在本研究中,抗性組相對較高的IFN-γ細胞因子分泌量,很可能與含有MHC抗性基因型有關。這與Godot等[16]在人類上的研究一致,他發現帶有MHC抗性等位基因的人血清中TNF-α等細胞因子含量高于帶有MHC易感性等位基因的人群。有文獻報道,在抵抗棘球絳蟲侵入機體的早期,IFN-γ在幼蟲形成的初始階段發揮著重要的作用,其分泌量越高,清除病原能力越強[16]。因此本試驗中抗性組綿羊感染細粒棘球絳蟲早期高的IFN-γ分泌量可能在蟲體殺傷力或阻止蟲體的進一步發育方面發揮了重要作用。A/J小鼠感染AE后產生較高水平的IFN-γ,提示與包蟲病的抗性有關[17]。本試驗證實了Th1細胞因子參與宿主抵抗包蟲病的保護性免疫這一觀點[18]。
3.2.2 Th2細胞因子
人類和小鼠IL-4分別主要由活化的T細胞和Th2亞群產生。IL-4對T細胞、B細胞和巨噬細胞發揮免疫調節作用。有報道,IL-4在人類黏膜固有層單核細胞產生,在有炎癥的腸道細胞產生的IL-4低于正常細胞產生的。當加入植物凝集素到新鮮的LPMCs,IL-4抑制了IL-2誘導增殖。IL-4 在炎癥性腸病的減少可能引起缺陷性的免疫抑制和抗炎癥機制,有助于疾病病理發生。IL-4 差異性調節LMPC活性可能影響黏膜免疫內穩態[19]。在本研究中,IL-4在抗性組和非抗性組分泌水平都上升且相當。這可能暗示細粒棘球絳蟲蟲卵感染后,IL-4抗性和非抗性綿羊都發揮了免疫作用,但不是其發揮作用的主要差別。Emery等報道,BALB/c小鼠感染泡球蚴(AE)后產生高水平的IL-4,暗示與包蟲病的易感性有關[17]。
sIgA 在腸道黏膜免疫中起關鍵作用,是阻止細菌、病毒等入侵黏膜的第一道有效防線。包含2 個外加的多聚多肽鏈J鏈和多聚Ig受體單位和分泌片段(SC),其分泌后與上皮細胞緊密連接在一起,分布于黏膜或漿膜表面而發揮免疫作用。sIgA 主要通過免疫排除、阻抑黏附、溶解細菌、中和病毒、介導ADCC等機制發揮作用[20-21]。在本研究中,sIgA在抗性組均高于非抗性組,且在十二指腸和空腸前有顯著差異(P<0.05),表明SIgA可能在小腸前端發揮主要的黏膜免疫作用。據報道,小鼠在游泳訓練中,sIgA在回腸中的表達上升,參與了應激反應。而且溫和的訓練顯著增加了先天性免疫細胞因子(包括TNF-α,IL-12,IL-6和IL-10)以及適應性免疫細胞因子(含有IL-2,IL-4,TGF-β和IFN-γ)的表達水平[22]。
本研究發現IL-4為代表的Th2細胞因子分泌水平在非抗性組綿羊小腸中均低于抗性組綿羊,但兩組間差異不顯著。這表明Th2細胞因子在細粒棘球絳蟲侵入機體的早期,在抗性組綿羊機體中并無優勢,那么,Th2細胞因子是否與包蟲病的抗性有關有待進一步研究。目前,有關宿主口服感染細粒棘球絳蟲蟲卵后早期機體Th細胞因子的活性研究較少[23]。
總之,在哈薩克羊感染細粒棘球絳蟲蟲卵后,小腸中的sIgA和IFN-γ分泌增加,而大部分細粒棘球蚴病患者的IL-4、IL-6、IL-5和IL-10水平增高,IgG4、IgG、IgE類型抗體水平也升高,說明Th2細胞被活化[5]。
3.3 趨化因子的差異分析
本研究檢測了兩組綿羊在感染細粒棘球絳蟲蟲卵后小腸中的CCL8為代表的Th1趨化因子,結果顯示抗性組小腸組織水平低于非抗性組。
CCL8是一個小的細胞因子屬于趨化因子家族。可以利用多個細胞受體吸引和激活人的白血球。CCL8在結腸炎的CD169+巨噬細胞選擇性表達,是表皮受損誘導黏膜炎癥的一個重要調節因子[24]。CCL8可以激活很多免疫細胞,包括肥大細胞、嗜酸性粒細胞、嗜堿性粒細胞、單核細胞、T細胞和NK細胞參與炎癥反應。本研究中,抗性組CCL8分泌均低于非抗性組,在十二指腸均表現出高水平的分泌,表明在感染細粒棘球絳蟲早期,CCL8在抗性和非抗性綿羊的十二指腸都發揮了重要的免疫作用。表明了CCL8可能受到某些因子的影響沒有激活了T細胞和單核細胞參與炎癥反應。

