雌激素調節Th17/Treg細胞免疫平衡抑制腎臟缺血再灌注損傷①
張 洋 冀 偉 周奧飛 常越辰 張 亮 馬克濤 李 麗 司軍強 王 洋
(石河子大學醫學院生理教研室,石河子832002)
腎臟缺血再灌注損傷(Ischemia reperfusion injury,IRI)通常發生在腎大部切除、腎移植和主動脈-血管手術等臨床情況下,是造成急性腎衰竭(Acute renal failure,ARF)的常見原因,也是腎移植預后的重要影響因素[1]。以往研究發現,IRI作為一種急性的組織損傷病變,能夠刺激和興奮固有免疫系統,激活其中的抗原非特異性免疫細胞(如巨噬細胞、中性粒細胞、單核細胞等)并產生相應的免疫應答反應[2,3]。近年來研究發現,作為經典的適應性免疫細胞——CD4+T淋巴細胞被認為是連接固有免疫和適應性免疫的重要橋梁,參與和介導了腎臟IRI[4-6]。CD4+T淋巴細胞不僅包括Th1和Th2細胞,還包括新定義的Th17和Treg細胞[7,8],研究發現Th17/Treg的免疫穩態破壞是很多自身免疫性和炎癥性疾病發生發展的關鍵因素[9,10]。
類固醇激素尤其是性激素在各種炎性疾病中發揮著重要作用[11,12]。人體和動物實驗已發現,女性比男性更易耐受由IRI引起的腎損傷,說明雌激素在IRI引起的腎臟炎性過程中扮演著重要角色,且其作用機制復雜[13,14]。雌激素是否通過調節Th17/Treg的免疫平衡來抑制腎臟炎癥反應,尚未見報道。因此,本研究將從Th17/Treg免疫平衡的角度,以去卵巢大鼠為研究對象,進一步探討雌激素對腎臟IRI的免疫調控機制,為臨床上治療腎臟IRI提供新的研究思路。
1 材料與方法
1.1主要試劑和儀器 E2(Sigma,美國);紅細胞裂解液(BD,美國);FITC標記的抗大鼠CD3單克隆抗體、APC標記的抗大鼠CD4單克隆(eBioscience,美國);FACSAriaⅢ型流式細胞儀(BD,美國);大鼠IL-17 ELISA Kit、大鼠IL-10 ELISA Kit(Elabscience,中國)。
1.2方法
1.2.1實驗動物及分組 健康清潔級雌性SD大鼠24只,體質量220~300 g,8~12周齡,由新疆醫科大學實驗動物中心提供(許可證編號 SCXK 新2003-0001)。購進大鼠后先進行為期1周的適應性飼養,飼養溫度為20~25℃,濕度為50%~55%,所有大鼠均自由飲水攝食。24只雌性SD大鼠隨機分為4組:對照組(Control group)、去卵巢組(OVX group)、去卵巢后缺血再灌注損傷組(OVX+IRI group)和雌激素干預組(OE+IRI group)。
1.2.2模型制備 去卵巢模型制備和雌激素干預:將除Control group之外的18只SD大鼠以30 mg/L戊巴比妥(50 mg/kg)腹腔注射麻醉成功后,經鼠背面切口切除雙側卵巢,手術后恢復14 d,在此期間要做好大鼠傷口的消毒和墊料清潔等工作,防止傷口感染。自術后14 d,將其中的6只SD大鼠皮下給予E2干預(100 μg/kg·d),連續3 d,并做好標記。
1.2.3腎臟缺血再灌注損傷模型制備 各組SD大鼠分別于末次給藥30 min后,再次用30 mg/L戊巴比妥(50 mg/kg)腹腔注射,麻醉成功后按照本實驗室常用方法[15]切除右側腎臟,用無創動脈夾夾閉左側腎蒂,持續缺血45 min后,恢復血流。各組分別于連續再灌注6 h后取血,剝離腎臟組織。
1.2.4全血生化指標檢測 各組大鼠待腎臟缺血再灌注6 h后,予以30 mg/L的成巴比妥腹腔注射,麻醉成功后,行腹主動脈穿刺取全血,送往石河子大學醫學院第一附屬醫院檢驗科采用ROCHE羅氏COBASINTEGRA 800全自動血生化分析儀進行血尿素氮(Blood urea nitrogen,BUN)和血肌酐(Serum creatinine,SCr)檢測,評估其腎功能變化。
1.2.5腎臟病理學檢測 將再灌注6 h后剝離的腎臟組織經固定、包埋、切片后行常規HE染色,光學顯微鏡下觀察腎臟組織病理形態學的變化,并由兩名專業的病理科醫師對其進行Paller評分。
1.2.6流式細胞術檢測外周血CD3+CD4+T細胞變化 ①在5 ml EP管中分別加入100 ml抗凝全血,設立單標管和同型對照管,加入抗體(FITC-CD3、APC-CD4、PE-CD25)1 μl,于常溫下避光孵育20 min。②加入1×紅細胞裂解液2 ml裂解紅細胞8~10 min。③裂紅結束后加入1 ml PBS終止裂解。③于1 000 r/min離心5 min,離心后棄掉上清,用500 μl的PBS重懸細胞后,上流式細胞儀進行檢測。
1.2.7炎癥因子IL-17和IL-10的表達 取凍存于-20℃的血清樣品, ELISA法檢測 IL-17 和 IL-10 表達水平,操作嚴格按照試劑盒說明書進行。
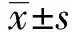
2 結果
2.1雌激素對腎功能的影響 正常大鼠BUN和SCr的水平分別為(6.35±1.26) mmol/L和(30.27±4.82) μmol/L。OVX+IRI組BUN和SCr的水平升高,明顯高于OVX組(21.85±3.54 vs 7.15±1.41;115.16±13.27 vs 34.31±6.64),差異有統計學意義(P<0.01)。而OE+IRI組BUN和SCr的水平顯著降低,明顯低于OVX+IRI組(15.08±2.89 vs 21.85±3.54;68.89±12.65 vs 115.16±13.27),差異有統計學意義(P<0.05)。見表1。
2.2雌激素對腎臟病理組織結構的影響 HE病理染色顯示,Control組和OVX組腎小球腎小管清晰可見,未見明顯的形態學改變;OVX+IRI組近端及遠端腎小管明顯擴張,部分上皮細胞的核碎裂壞死、脫落,刷狀緣脫落,腎小管管腔阻塞,有大量的蛋白管型,腎小球血管管腔閉塞,腎間質有大量的炎性細胞浸潤;OE+IRI組腎小管輕度擴張、細胞水腫、蛋白質管型、腎間質炎性浸潤均明顯減輕,刷狀緣有損害但損害較輕(圖1A)。采用Paller評分方法計算腎臟病理組織評分[16],結果顯示OVX+IRI組Paller評分顯著高于OVX組(45.67±2.99 vs 11.33±2.50),差異有統計學意義(P<0.01);而OE+IRI組Paller評分顯著低于OVX+IRI組(31.17±3.96 vs 45.67±2.99),差異有統計學意義(P<0.05),見圖1B。
2.3雌激素對外周血中CD3+CD4+T細胞表達的影響 流式細胞術檢測結果顯示,與OVX組比較,OVX+IRI組中CD3+CD4+T細胞的比例顯著增高(76.23±2.40 vs 64.95±5.42),差異有統計學意義(P<0.01);經雌激素補充治療后OE+IRI組中CD3+CD4+T細胞的比例顯著降低(69.75±2.56 vs 76.23±2.40),差異有統計學意義(P<0.01),見圖2。
表1各組大鼠血尿素氮和血肌酐的水平
Tab.1Bloodureanitrogenandserumcreatininelevelsineachgroup

GroupsBUN(mmol/L)SCr(μmol/L)Control6.35±1.2630.27±4.82OVX7.15±1.4134.31±6.64OVX+IRI21.85±3.542)115.16±13.272)OE+IRI15.08±2.891)2)68.89±12.651)4)

2.4雌激素對細胞因子IL-17和IL-10表達影響 OVX+IRI組大鼠血清中 IL-17的表達濃度顯著高于OVX組大鼠(1066.79±99.37 vs 434.09±162.69)pg/ml,差異有統計學意義(P<0.01), 而IL-10的表達濃度顯著低于OVX組大鼠(33.27±11.06 vs 81.47±24.29)pg/ml,差異有統計學意義(P<0.05);經雌激素補充治療后OE+IRI組中IL-17的濃度顯著降低(643.14±270.74 vs 1 066.79±99.37),差異有統計學意義(P<0.01),而IL-10的濃度顯著升高(65.36±16.12 vs 33.27±11.06),差異有統計學意義(P<0.05),見圖3。
2.5細胞因子IL-17和IL-10與腎臟損傷指標的相關性分析如圖4A~C所示,腎臟缺血再灌注損傷中IL-17的表達水平與腎功能指標BUN(r=0.691,P=0.000)、Scr(r=0.721,P=0.000)和腎小管Paller評分(r=0.769,P=0.000)均呈現正相關性。

圖1 各組大鼠腎臟組織病理學變化Fig.1 Renal histopathological changes of rats in each groupNote: A.Pathological images of kidney in each group(HE staining,bar:200 μm);B.Paller score bar graph of HE staining of kidney in each group.*.P<0.05,**.P<0.01 vs OVX group;#.P<0.05 vs OVX+IRI

圖2 各組大鼠外周血中CD3+CD4+ T細胞的表達水平Fig.2 Expression of CD3+CD4+ T cells in peripheral blood of rats in each groupNote: A.Representative flow cytometric scatter plot of CD3+CD4+ T cell expression;B.Bar graph of the positive expression rate of CD3+CD4+ T cells in each group.*.P<0.05,**.P<0.01 vs OVX group;##.P<0.01 vs OVX+IRI

圖4 血清中炎癥因子IL-17和IL-10分別與BUN、SCr和Paller評分的相關性分析Fig.4 Correlation analysis of serum IL-17 and IL-10 levels with BUN,SCr and Paller scoresNote: The concentration of IL-17 were positively correlated with BUN(A),Scr(B) and (C)Paller score.The concentration of IL-10 were negatively correlated with BUN(D),Scr(E) and (F)Paller score.Each symbol represents a single individual(n=6).

圖3 ELISA檢測各組大鼠血清中IL-17和IL-10的表達水平Fig.3 Serum levels of IL-17 and IL-10 in each group were detected by ELISANote: A.IL-17 was measured in serum taken at 6 h post reperfusion;B.IL-10 was measured in serum taken at 6 h post reperfusion.*.P<0.05,**.P<0.01 versus OVX group;#.P<0.05,##.P<0.01 vs OVX+IRI
而IL-10的表達水平與腎功能指標BUN(r=-0.603,P=0.002)、Scr(r=-0.519,P=0.009)和腎小管Paller評分(r=-0.556,P=0.005)均呈現負相關性(圖4D~F)。
3 討論
腎臟IRI的發病機制十分復雜,涉及鈣超載、氧化應激、微循環障礙、內皮功能紊亂和過度炎癥反應等[17],目前在臨床上尚缺乏有效的防治手段。許多研究表明IRI存在性別差異,男性比女性更易發生IRI。流行病學和Meta分析顯示女性絕經期后由于卵巢功能衰退,雌激素水平下降,較易發生心、腦、腎的IRI。因此,雌激素替代療法已經成為一種新興的防治IRI的方法[18,19]。本研究采用經典的圍絕經期模型——去卵巢大鼠模型為研究對象,實驗結果顯示,OVX+IRI組中BUN、SCr和腎小管Paller評分均高于OVX組;而補充雌激素至正常水平后,上述指標均下降。說明雌激素可以通過調節腎功能和改善腎組織損害程度對腎臟IRI起到保護作用,此結果與以往的研究一致[20]。
腎臟IRI是一種由適應性免疫和固有免疫共同介導的炎性疾病[21]。有研究表明,CD4基因敲除的小鼠,可以耐受由IRI誘導的腎損傷,而CD8基因敲除的小鼠卻無此作用,由此可知CD4+T細胞是其致病的關鍵因素[22,23]。因此,靶向干預CD4+T細胞成為近年來研究的熱點。本研究同樣發現,腎臟IRI后外周循環中CD3+CD4+T細胞比例升高,腎臟損傷加劇。以往研究發現,雌激素可通過抗氧化、抗凋亡等途徑,減少再灌注區中性粒等細胞的浸潤及炎癥因子的分泌,對腦、腎等器官的IRI具有保護作用[19,24]。本研究發現經雌激素補充治療后,外周循環中CD3+CD4+T細胞比例降低,腎損傷減輕,說明雌激素也可通過降低外周循環中的CD3+CD4+T細胞的表達從而減輕由IRI誘導的炎癥反應。然而CD4+T細胞亞群在腎臟缺血再灌注損傷中的作用及雌激素對CD4+T細胞亞群的影響尚不明確。
在炎癥因子的作用下,CD4+T淋巴細胞可分為不同種類的輔助性T細胞。最初人們認為在腎損傷時,Th1細胞被活化并加劇炎癥反應,而Th2細胞則對腎急性損傷具有保護作用,Th1/Th2的平衡在腎臟IRI的發生發展中發揮著重要作用[25,26]。近年來汪泉等[27]研究發現,在一些腎損傷模型(如腎小球腎炎、狼瘡腎炎和IRI)中,外周循環中的Th17細胞及其細胞因子被激活[28]。Treg細胞是CD4+T淋巴細胞的另一種輔助性T細胞,可抑制過度免疫反應。研究發現,CD4+CD25+Treg細胞可通過直接接觸或釋放抗炎細胞因子(如IL-10和TGF-β1),來維持免疫耐受從而對抗由IRI誘發的腎臟炎性反應[29]。此外,在肝臟IRI中,CD4+CD25+Treg細胞可通過負性調控Th17細胞的生成、功能及IL-17的分泌來發揮其抗炎作用[30]。眾多研究表明Th17/Treg的免疫平衡破壞是導致炎性免疫相關性疾病、自身免疫性疾病、中樞炎性疾病、器官移植等疾病發生發展的關鍵因素[31]。本研究結果顯示:在OVX+IRI組中,Th17細胞所分泌的炎癥因子IL-17濃度升高,CD4+CD25+Treg所分泌的炎癥因子IL-10的濃度下降,提示Th17/Treg平衡存在失衡,腎損傷加劇。此外,相關性分析結果顯示:IL-17與腎損傷相關指標呈現正相關性,IL-10則呈現負相關性,提示該免疫平衡與腎臟IRI同步、關聯,此免疫調節失衡進一步導致機體過度炎癥反應的持續存在,使IRI的易感性增加。
Patil等[6]研究表明,減少IL-17細胞因子的分泌,能夠減弱心肌、肺及腎組織的IRI誘導的炎癥反應,提示靶向抑制Th17細胞,阻斷其細胞因子IL-17的分泌可減輕由IRI誘發的炎癥級聯反應[32]。Koo等[30]研究發現,運用P2X7受體拮抗劑可通過擴增Treg的表達進而促進腎損傷的恢復。因此,通過對Th17/Treg多層面的免疫干預,維持Th17/Treg的免疫平衡,可能具有抑制由缺血腎組織誘發的局部炎癥及全身炎性反應的作用,從而減輕腎臟IRI。本實驗發現,雌激素可通過降低IL-17細胞因子的分泌,靶向抑制Th17細胞的活化,通過提升IL-10細胞因子的分泌,靶向激活CD4+CD25+Treg細胞,從而調節Th17/Treg的免疫平衡,降低由IRI誘導的炎性損傷。
綜上所述,腎缺血再灌注損傷后大鼠體內可能存在著Th17/Treg穩態的破壞,Th17/Treg免疫穩態隨著腎損傷相關指標變化而改變,表明該免疫穩態與腎缺血再灌注損傷的發生發展密切相關;雌激素可通過調節和維持Th17/Treg的穩態,有望成為治療腎臟IRI的新靶點。

