H2S調節miR-21表達抑制內質網應激介導肺成纖維化細胞凋亡①
趙 紅 姚平波
(南華大學護理學院,衡陽421001)
成纖維細胞增生在肺纖維化形成過程中扮演著重要的角色。目前認為:基質金屬蛋白酶(ADAMTS-1)、血管緊張素1-7(Ang1-7)、內質網應激反應等信號通路能夠誘導肺成纖維細胞凋亡介導成纖維細胞增生[1-3]。如何有效減少內質網應激誘導肺纖維化細胞的凋亡、拮抗肺成纖維化細胞的增殖,目前仍然是肺纖維化靶向藥物研究的熱點。我們前期研究發現:H2S能介導PD-1/PD-L1信號通路對實驗性大鼠肺纖維化具有潛在內源性的保護作用[4];同時,本課題組研究還發現:miR-21在小鼠肺成纖維化細胞模型中可介導ADAMTS-1/TGF-β1信號通路促肺纖維化[5]。近年來研究發現,TGF-β1誘導肺纖維化可介導內質網應激(Endoplasmic reticulum stress,ERS),過度ERS可誘導細胞凋亡介導肺纖維化的病理生理過程[6]。Beermann等[6,7]研究發現:通過調控lncRNA的表達,亦可減少ERS介導的小鼠肺成纖維化細胞凋亡及增殖,從而起到保護肺細胞的作用。因此,本研究通過細胞實驗進一步觀察H2S是否能夠抑制內質網應激誘導肺纖維化的細胞凋亡?假如是,是否H2S調控miR-21表達抑制內質網的應激起到保護肺纖維化的作用?
1 材料與方法
1.1主要試劑與藥品 DMEM培養液(Sigma-Aldrich);胎牛血清(20%FBS,Gibco);化學修飾的miR-21 agomir、miR-21 antagomir、蛋白提取試劑盒、CCK-8細胞增殖檢測試劑盒(廣州市銳博生物科技有限公司);NaHS(美國Sigma);TGF-β1、GRP78、caspase-12、CHOP及甘油醛-3-磷酸脫氫酶(GAPDH)等抗體(Santa Cruz,USA)。
1.2方法
1.2.1成纖維化細胞培養 NIH3T3(購自中國典型培養物保藏中心),其培養內容詳細見本課題組前期的報道[1]。
1.2.2分組 對照組:不加入TGF-β1,普通細胞培養箱(37℃,5%CO2及95%空氣)孵育24 h;TGF-β1組:NIH3T3加入TGF-β1(5 μg/L)培養24 h;NaHS干預組:NIH3T3加入TGF-β1(5 μg/L)培養24 h前1 h給予NaHS(40 μmol/L)預處理。為進一步觀察miR-21是否參與H2S抑制ERS介導的小鼠成纖維化細胞凋亡,將其分為如下3組:陰性對照組: 轉染miR-21陰性對照片段(50 μmol/L)24 h后,給予NaHS(40 μmol/L)預處理, 再行TGF-β1處理;miR-21 agomir組:轉染miR-21模擬劑(50 μmol/L)24 h后,NaHS(40 μmol/L)預處理,再行TGF-β1處理;miR-21 antagomir組:轉染 miR-21拮抗劑(50 μmol/L)24 h后, 給予NaHS(40 μmol/L)預處理,再行TGF-β1處理。miR-21陰性對照片段、miR-21 agomir及miR-21 antagomir轉染方法詳細見試劑盒說明書操作。
1.2.3凋亡及增殖的檢測 流式細胞儀和CCK-8分別檢測NIH3T3細胞凋亡率及其增殖。
1.2.4Western blot 募集細胞后PBS洗滌3次,加入裂解液裂解懸浮細胞,然后置于冰上半小時后,將其在4℃下離心(10 000 r/min,10 min),提取上清液,用BCA法測定蛋白質濃度,隨后電泳(SDS-PAGE),采用硝酸纖維素(PVDF)電轉膜;5%脫脂牛奶封閉1 h后,加入一抗(miR-21、GRP78、CHOP、caspase-12及β-actin),4℃12 h TBST洗膜20 min加入辣根過氧化物酶標記的二抗,室溫孵育2 h TBST洗膜10 min,然后用化學發光法顯色,采集圖像(UVP 型凝膠圖像分析系統),分析條帶積分吸光度(Imag J 軟件)。計算目的蛋白(miR-21、GRP78、CHOP及caspase-12)相對量。
1.2.5qRT-PCR 提取其RNA(TRIzol法),逆轉錄得到cDNA,然后行PCR循環取RT-PCR產物電泳(1.2%瓊脂糖凝膠),miR-21、GRP78、caspase-12及CHOP等加樣后溴化乙錠染色,電泳條帶采用UVP型凝膠圖像分析系統做積分吸光度測定和分析。取逆轉錄產物10 μl,在熒光實時定量PCR儀上進行PCR循環反應,經溶解曲線分析PCR反應產物為單獨的雙鏈DNA。采用ΔΔCt值法, 以GAPDH為內參定量miR-21、GRP78、caspase-12及CHOP mRNA表達。基因引物序列由上海生物工程有限公司合成。引物序列見表1。
1.3統計學方法 采用SPSS18.0軟件包,計量資料兩組比較采用t檢驗,多組數據比較采用F檢驗或單因素方差分析,計量資料采用卡方檢驗,P<0.05為差異有統計學意義。
2 結果
2.1NaHS對細胞凋亡率、增殖率、miR-21蛋白和mRNA的影響 與對照組比較,TGF-β1組細胞凋亡率、增殖率、miR-21蛋白和mRNA均明顯升高(P<0.01);與TGF-β1組比較,NaHS干預組細胞凋亡率、增殖率、miR-21蛋白和mRNA均明顯降低(P<0.05)。見表2。
表1熒光實時定量PCR所用引物序列
Tab.1Primersequencesusedbyreal-timefluorescencequantitativePCR
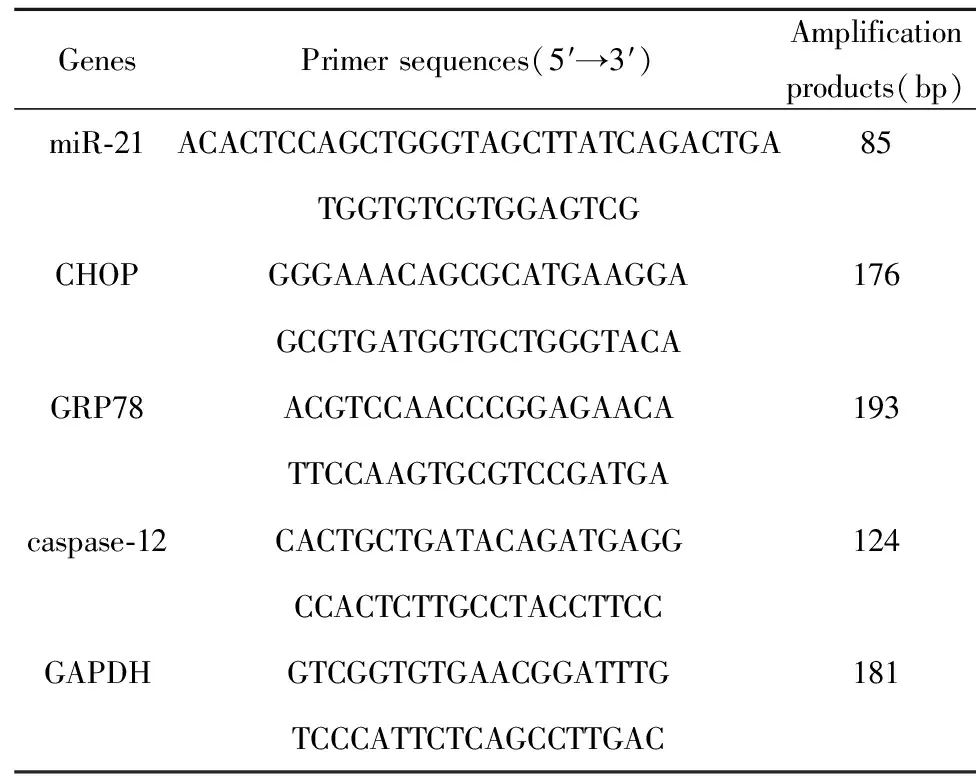
GenesPrimer sequences(5′→3′)Amplificationproducts(bp)miR-21ACACTCCAGCTGGGTAGCTTATCAGACTGA85TGGTGTCGTGGAGTCGCHOPGGGAAACAGCGCATGAAGGA176GCGTGATGGTGCTGGGTACAGRP78ACGTCCAACCCGGAGAACA193TTCCAAGTGCGTCCGATGAcaspase-12CACTGCTGATACAGATGAGG124CCACTCTTGCCTACCTTCCGAPDHGTCGGTGTGAACGGATTTG181TCCCATTCTCAGCCTTGAC
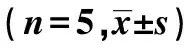
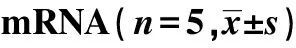

GroupsThe rate of cell apoptosisThe rate of cell proliferationmiR-21 ProteinsmRNAControl5.64±1.2212.48±1.231.14±0.071.00±0.05TGF-β124.31±2.791)27.89±1.661)4.12±0.231)3.15±0.131)NaHS6.72±1.902)13.28±1.412)1.36±0.112)1.17±0.092)
Note:1)P<0.01 vs control; 2)P<0.05,3)P<0.01 vs TGF-β1.
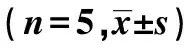
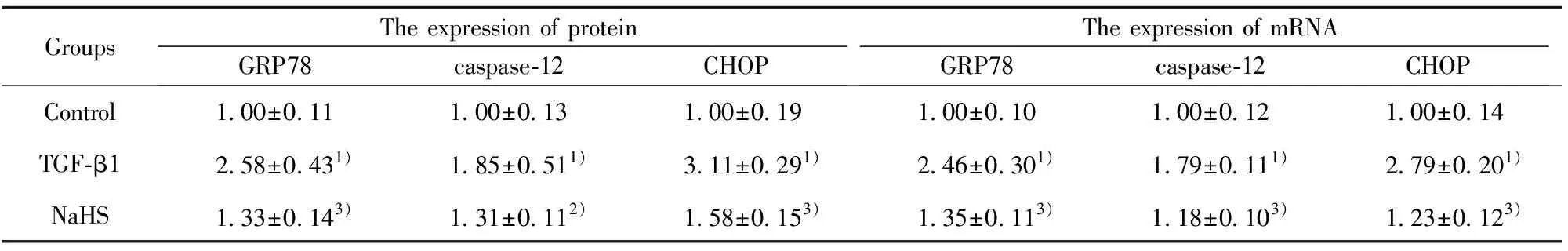
GroupsThe expression of proteinGRP78caspase-12CHOPThe expression of mRNAGRP78caspase-12CHOPControl1.00±0.111.00±0.131.00±0.191.00±0.101.00±0.121.00±0.14TGF-β12.58±0.431)1.85±0.511)3.11±0.291)2.46±0.301)1.79±0.111)2.79±0.201)NaHS1.33±0.143)1.31±0.112)1.58±0.153)1.35±0.113)1.18±0.103)1.23±0.123)
Note:1)P<0.01 vs control;2)P<0.05,3)P<0.01 vs TGF-β1 .
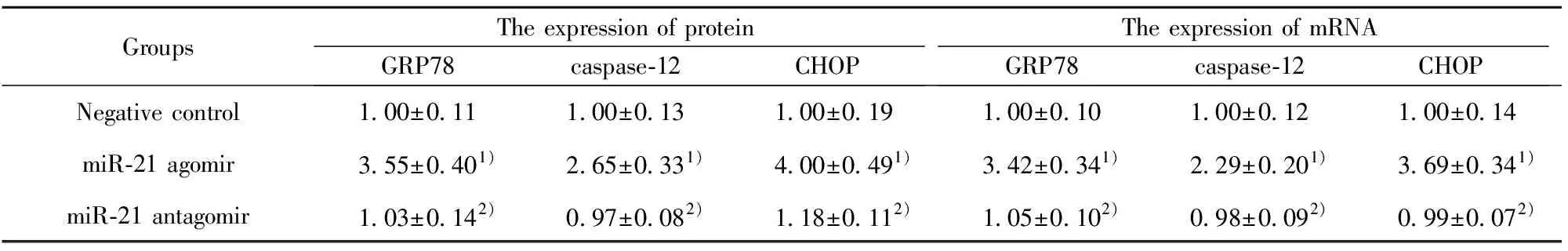
GroupsThe expression of proteinGRP78caspase-12CHOPThe expression of mRNAGRP78caspase-12CHOPNegative control1.00±0.111.00±0.131.00±0.191.00±0.101.00±0.121.00±0.14miR-21 agomir3.55±0.401)2.65±0.331)4.00±0.491)3.42±0.341)2.29±0.201)3.69±0.341)miR-21 antagomir1.03±0.142)0.97±0.082)1.18±0.112)1.05±0.102)0.98±0.092)0.99±0.072)
Note:1)P<0.01 vs control;2)P<0.01 vs TGF-β1 .
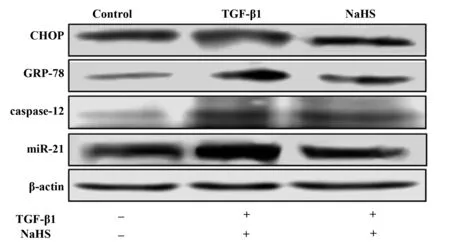
圖1 Western blot檢測不同組NIH3T3細胞的內質網應激蛋白表達Fig.1 Detection the expression of proteins of ERS in NIH3T3 cells of different groups by Western blot method

圖2 Western blot檢測miR-21對NIH3T3細胞的內質網應激蛋白表達的影響Fig.2 Detection the effect of miR-21 on expression of proteins of ERS in NIH3T3 cells by Western blot method
2.2內質網應激相關因子的蛋白和mRNA表達的比較 與對照組比較,TGF-β1組內質網應激相關因子GRP78、caspase-12及CHOP蛋白和mRNA均明顯升高(P<0.01);與TGF-β1組比較,NaHS干預組內質網應激相關因子GRP78、caspase-12及CHOP蛋白和mRNA均明顯降低(P<0.05)。見表3及圖1。
2.3miR-21對NIH3T3細胞的內質網應激蛋白和mRNA表達的影響 與對照組比較,miR-21 agomir組內質網應激相關因子GRP78、caspase-12及CHOP蛋白和mRNA均明顯升高(P<0.01);與miR-21 agomir組比較,miR-21 antagomir組內質網應激相關因子GRP78、caspase-12及CHOP蛋白和mRNA均明顯降低(P<0.05)。見表4及圖2。
3 討論
本課題組前期研究還證實:外源性H2S介導TGF-β1/Smad信號通路下調α-SMA及抑制ColⅠ、ColⅢ合成從而起到抗肺纖維化作用[8]。近年來證據表明:H2S可誘導內質網應激-自噬信號通路介導凋亡相關酶的去泛素化修飾或磷酸化修飾來調控ERS的穩態,起到改善糖尿病大鼠心肌纖維化的作用[9]。因此,本研究進一步探討H2S是否調控內質網應激穩態,減輕細胞凋亡抑制肺纖維化;是否與miR-21的調控密切相關將是本研究的新視角。
內質網是重要的細胞器之一,許多疾病的發生發展都與內質網的功能穩態息息相關。大量研究表明:內環境失衡,如缺血/再灌注損傷、炎癥介質爆炸性釋放、氧化應激、細胞自由基失衡、Ca2+穩態失衡等可引起內質網功能障礙,導致內質網應激[10]。內質網應激可啟動細胞凋亡信號通路(標志物如caspase-12)、內質網未折疊蛋白反應(標志物如GRP78、CHOP)和炎性信號通路[11-13]。研究也證實:適度的ERS可通過磷酸化或去泛素化修飾未折疊/錯誤折疊蛋白,恢復機體內環境穩態,維持細胞的正常生命活動,一旦有害的ERS持續進行可導致細胞凋亡[11-14]。因此,內質網應激可能是參與肺纖維化發生發展過程中的關鍵的病理生理機制之一。本實驗結果證實:GRP78、CHOP與caspase-12表達趨勢反映了ERS凋亡信號通路的細胞活性。
本研究結果提示:NaHS預處理體外培養的小鼠成纖維化細胞,可顯著減少TGF-β1誘導NIH3T3細胞肺纖維化過程中的細胞凋亡率及增殖率。證實了外源性H2S對TGF-β1損傷的小鼠成纖維化細胞具有內源性保護作用;同時還證實:外源性H2S可減少TGF-β1損傷的小鼠成纖維化細胞GRP78、CHOP與caspase-12的表達,表明外源性H2S可減少TGF-β1誘導的ERS性細胞凋亡。另外,外源性H2S可降低TGF-β1損傷的小鼠成纖維化細胞miR-21的表達水平,更進一步證實miR-21可誘導ERS激活細胞凋亡信號通路促肺纖維化。
本課題組前期研究發現:miR-21可在轉錄后水平特異性靶向甄別靶點基因如ADAMTS-1等因子,以不同的修飾方式抑制或加速降解靶點基因而發揮促纖維化的作用[5]。Sun等[2]研究表明:miR-21調控JNK/AP-1/STAT1/STAT3信號通路介導凋亡因子caspase-12的激活,也可調控內質網應激-自噬信號轉導機制加重臟器的損傷,故調控miR-21的表達可減輕上述病理生理過程[15,16]。鑒于miR-21廣泛參與生物學效應及調控肺臟的生理病理過程的事實。因此,我們推測miR-21可能參與了外源性H2S抑制ERS介導NIH3T3細胞凋亡的調控。
為此,我們對小鼠肺成纖維化細胞的miR-21基因的表達予以調控。研究表明:miR-21高表達的miR-21 agomir組GRP78、CHOP與caspase-12的表達均明顯上調,提示上調miR-21增加ERS介導的內質網應激性細胞凋亡, 高表達miR-21降低H2S的保護性作用。而miR-21 antagomir組GRP78、CHOP與caspase-12的表達均明顯下調,提示下調miR-21可減少ERS介導的細胞凋亡,低表達miR-21增加H2S的肺細胞保護作用。上述研究結果提示:miR-21參與了H2S保護損傷的肺成纖維化細胞。本研究從miR-21轉錄后調控這一新視角揭示H2S精準調控ERS凋亡相關基因的可能信號轉導機制,這將為臨床上的靶向藥物研發提供新的證據。但H2S如何調控miR-21的表達,進而調節ERS凋亡的機制及信號通路尚須更進一步深入的研究。

