基于生物信息學(xué)方法分析甲酰肽受體1在膠質(zhì)瘤中的表達(dá)及臨床意義
董 強(qiáng),解琪琪,胡建宏,王茂林,袁國(guó)強(qiáng),潘亞文,,*
(1. 蘭 州大學(xué)第二醫(yī)院神經(jīng)外科,甘肅 蘭州730030;2. 蘭州大學(xué)第二醫(yī)院骨科,甘肅 蘭州730030;3. 蘭州大學(xué)第二醫(yī)院神經(jīng)病學(xué)研究所,甘肅 蘭州 730030)
膠質(zhì)瘤是中樞神經(jīng)系統(tǒng)中最常見(jiàn)的惡性腫瘤,發(fā)病率占顱內(nèi)腫瘤的46%,大約占人類(lèi)惡性腫瘤的1%~3%[1]。目前,膠質(zhì)瘤的治療主要以手術(shù),以及結(jié)合手術(shù)后放化療為主[2-3]。雖然綜合治療的方式延緩了腫瘤的復(fù)發(fā)和延長(zhǎng)了患者的生存期,但是患者預(yù)后仍較差。膠質(zhì)瘤5年生存率小于30%,膠質(zhì)母細(xì)胞瘤中位生存期只有12~15個(gè)月[4]。當(dāng)前,對(duì)膠質(zhì)瘤前期診斷只能依靠影像學(xué)的方法,缺乏有效的腫瘤標(biāo)記物進(jìn)行早期診斷和預(yù)后監(jiān)測(cè)[5]。所以,尋找有效的膠質(zhì)瘤分子標(biāo)記物,對(duì)膠質(zhì)瘤患者進(jìn)行早期生存期預(yù)測(cè)和指導(dǎo)臨床治療有著重要意義。
甲酰肽受體1(formyl peptide receptor 1,F(xiàn)PR1)基因位于染色體19q13.3上,其蛋白產(chǎn)物是一種G蛋白偶聯(lián)受體,屬于FPR家族蛋白(包括FPR1、FPR2/FPRL1和FPR3/FPRL2)。據(jù)報(bào)道,F(xiàn)PR1結(jié)合含N-甲酰甲硫氨酸的寡肽而被激活,激活的FPR1可以介導(dǎo)白細(xì)胞和吞噬細(xì)胞殺死病原微生物,在先天性免疫反應(yīng)中具有重要作用[6]。FPR1/nox1依賴(lài)的氧化還原信號(hào)通路參與促進(jìn)腸道黏膜創(chuàng)傷修復(fù)[7]。大量研究顯示,F(xiàn)PR1在多種癌癥中異常表達(dá),在腫瘤的形成和發(fā)展中起著重要作用,如胃癌、乳腺癌、結(jié)腸癌、黑色素瘤和膠質(zhì)瘤等[8-12]。
本研究通過(guò)下載GEO數(shù)據(jù)庫(kù)中原始數(shù)據(jù),利用R語(yǔ)言對(duì)膠質(zhì)瘤基因芯片表達(dá)譜數(shù)據(jù)進(jìn)行差異基因篩選,通過(guò)DAVID數(shù)據(jù)庫(kù)對(duì)差異表達(dá)的基因進(jìn)行基因本體論(gene ontology consortium,GO)功能富集,京都基因和基因組百科全書(shū)(Kyoto encyclopedia of genes and genomes,KEGG)信號(hào)通路分析。STRING數(shù)據(jù)庫(kù)及Cytoscape軟件進(jìn)行蛋白相互作用網(wǎng)絡(luò)(PPI)可視化分析篩選網(wǎng)絡(luò)調(diào)控的關(guān)鍵基因。再結(jié)合Oncomine及GEPIA數(shù)據(jù)庫(kù)分析FPR1在膠質(zhì)瘤組織中的表達(dá)及預(yù)后情況,為膠質(zhì)瘤分子機(jī)制的進(jìn)一步研究提供線(xiàn)索和思路。
1 資料與方法
1.1 資料來(lái)源
通過(guò)NCBI的GEO數(shù)據(jù)庫(kù)中下載膠質(zhì)瘤患者的基因表達(dá)譜數(shù)據(jù)集GSE15824。在GSE15824數(shù)據(jù)集中我們選取30例不同級(jí)別的膠質(zhì)瘤組織樣本和5例正常組織樣本進(jìn)行分析。
1.2 方法
1.2.1 數(shù)據(jù)處理及差異基因篩選 利用R語(yǔ)言(3.3.0;https://www.r-project.org)“affty”包對(duì)GSE15824數(shù)據(jù)集中每個(gè)樣本探針表達(dá)值進(jìn)行背景校正標(biāo)準(zhǔn)化處理。通過(guò)“l(fā)immar”包對(duì)膠質(zhì)瘤組織和正常組織中每個(gè)探針進(jìn)行t檢驗(yàn)和貝葉斯檢驗(yàn),以log2(Fold change)的絕對(duì)值>2.0和調(diào)整的P<0.01為篩選標(biāo)準(zhǔn)定義差異表達(dá)探針。最后通過(guò)GPL570 平臺(tái)將探針轉(zhuǎn)換成基因名稱(chēng)。
1.2.2 GO和KEGG分析 DAVID(the database for annotation,visualization and integrated discovery)是一個(gè)生物信息數(shù)據(jù)庫(kù),提供系統(tǒng)綜合的生物功能注釋信息[13]。為了分析差異表達(dá)基因的生物學(xué)功能和富集的信號(hào)通路,使用DAVID數(shù)據(jù)庫(kù)進(jìn)行GO和KEGG分析,利用R語(yǔ)言“ggplot2”包進(jìn)行GO和KEGG可視化分析。
1.2.3 構(gòu)建蛋白互作網(wǎng)絡(luò) STRING數(shù)據(jù)庫(kù)(https://string-db.org)是一種預(yù)測(cè)蛋白之間相互作用的系統(tǒng),包括蛋白之間間接相互作用的相關(guān)性[14]。將差異基因?qū)隨TRING數(shù)據(jù)庫(kù),輸出蛋白相互作用的網(wǎng)絡(luò)文件,通過(guò)Cytoscape軟件進(jìn)行可視化蛋白互作網(wǎng)絡(luò)分析。利用cytoscapehubba插件把網(wǎng)絡(luò)調(diào)控中心的基因定義為關(guān)鍵基因(hub gene)。
1.2.4 利用Oncomine和GEPIA數(shù)據(jù)庫(kù)分析FPR1在膠質(zhì)瘤中的表達(dá)及預(yù)后 Oncomine數(shù)據(jù)庫(kù)是癌癥基因芯片數(shù)據(jù)庫(kù)和整合數(shù)據(jù)挖掘平臺(tái),旨在挖掘癌癥基因信息,可用于比較癌癥和正常組織的差異表達(dá)分析[15]。基因表達(dá)譜數(shù)據(jù)動(dòng)態(tài)分析(gene expression profilling interactive analysis,GEPIA)是由北京大學(xué)研發(fā)的用于腫瘤與正常組織差異基因分析的在線(xiàn)分析工具。可以進(jìn)行差異基因與臨床病理分級(jí)、分期及生存期的相關(guān)性分析。利用Oncomine 和GEPIA數(shù)據(jù)庫(kù)驗(yàn)證FPR1在膠質(zhì)瘤中的表達(dá)情況。利用Kaplan-Meier方法進(jìn)行FPR1與膠質(zhì)瘤患者生存期的相關(guān)性分析。
2 結(jié) 果
2.1 差異表達(dá)基因
根據(jù)GEO數(shù)據(jù)庫(kù)正常組織與膠質(zhì)瘤組織的mRNAs矩陣數(shù)據(jù),以log2(Fold change)的絕對(duì)值>2.0和P<0.01為篩選標(biāo)準(zhǔn),總共有648個(gè)差異表達(dá)的mRNAs,其中包括471個(gè)表達(dá)上調(diào)mRNAs,177個(gè)表達(dá)下調(diào)mRNAs(圖1A),上調(diào)和下調(diào)最顯著的前10個(gè)基因如表1。我們選取表達(dá)差異較明顯的82個(gè)mRNA[log2(Fold change)絕對(duì)值>3.0] 進(jìn)行聚類(lèi)熱圖分析(圖1C)。同時(shí),我們把不同級(jí)別的膠質(zhì)瘤分別與正常腦組織比較,差異基因取交集,發(fā)現(xiàn)總共有274個(gè)不同級(jí)別膠質(zhì)瘤共同的差異基因(圖1B)。
2.2 GO和KEGG分析
通過(guò)對(duì)差異表達(dá)基因GO和KEGG分析顯示,這些差異基因富集的生物學(xué)過(guò)程主要包括T細(xì)胞的激活、調(diào)節(jié)白細(xì)胞的黏附、調(diào)節(jié)細(xì)胞的吞噬、細(xì)胞的遷移和甘油三酯的代謝有關(guān)(圖2A)。KEGG通路分析顯示,主要富集的通路包括PI3K?Akt信號(hào)通路,MAPK信號(hào)通路和鈣離子信號(hào)通路以及細(xì)胞衰老、自噬和調(diào)節(jié)肌動(dòng)蛋白細(xì)胞骨架(圖2B)。這些信號(hào)通路都跟腫瘤的發(fā)生進(jìn)程相關(guān)。
2.3 PPI分析和hub基因

圖1 膠質(zhì)瘤組織與正常組織中差異表達(dá)的基因
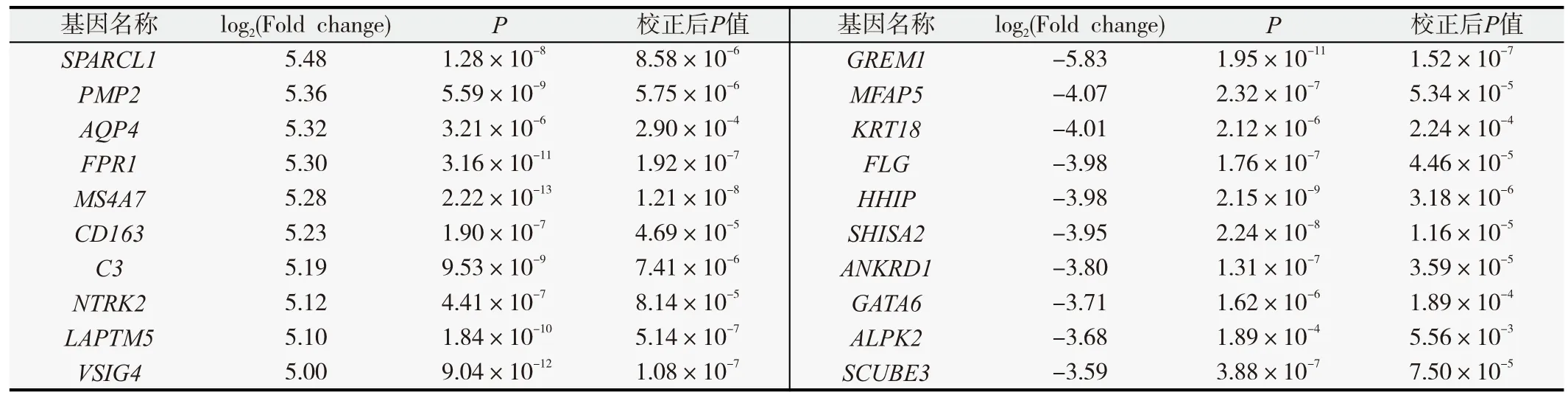
表1 膠質(zhì)瘤組織與正常組織中差異表達(dá)基因中上調(diào)和下調(diào)最顯著的前10個(gè)基因
為了進(jìn)一步了解膠質(zhì)瘤和正常組織中差異基因的蛋白調(diào)控關(guān)系,尋找蛋白調(diào)控的關(guān)鍵基因,我們構(gòu)建了蛋白調(diào)控的互作網(wǎng)絡(luò)圖。通過(guò)在線(xiàn)分析工具STRING網(wǎng)站,根據(jù)interaction score>0.7為閾值,分析得到648個(gè)蛋白互作網(wǎng)絡(luò)節(jié)點(diǎn),然而在Cytoscape軟件上進(jìn)行蛋白互作網(wǎng)絡(luò)可視化分析(圖3)。利用cytoscapehubba插件定義前10個(gè)關(guān)鍵基因(GNG4、LPAR5、AGT、ADCY8、ADCY2、FPR1、C3、CCR1、 CXCL16、APLNR)進(jìn)行進(jìn)一步分析,我們發(fā)現(xiàn)FPR1和膠質(zhì)瘤患者的生存預(yù)后相關(guān)。
2.4 FPR1的表達(dá)水平與膠質(zhì)瘤患者的預(yù)后
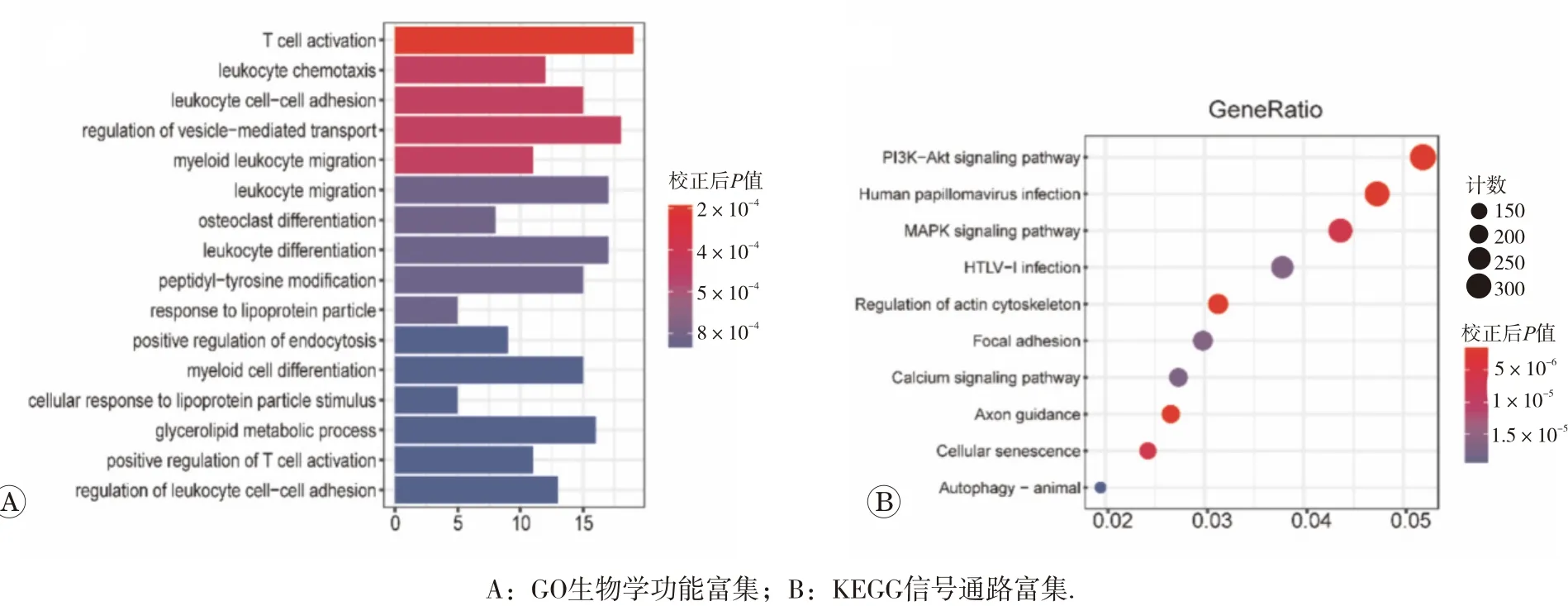
圖2 差異表達(dá)基因的GO生物學(xué)功能和KEGG信號(hào)通路富集
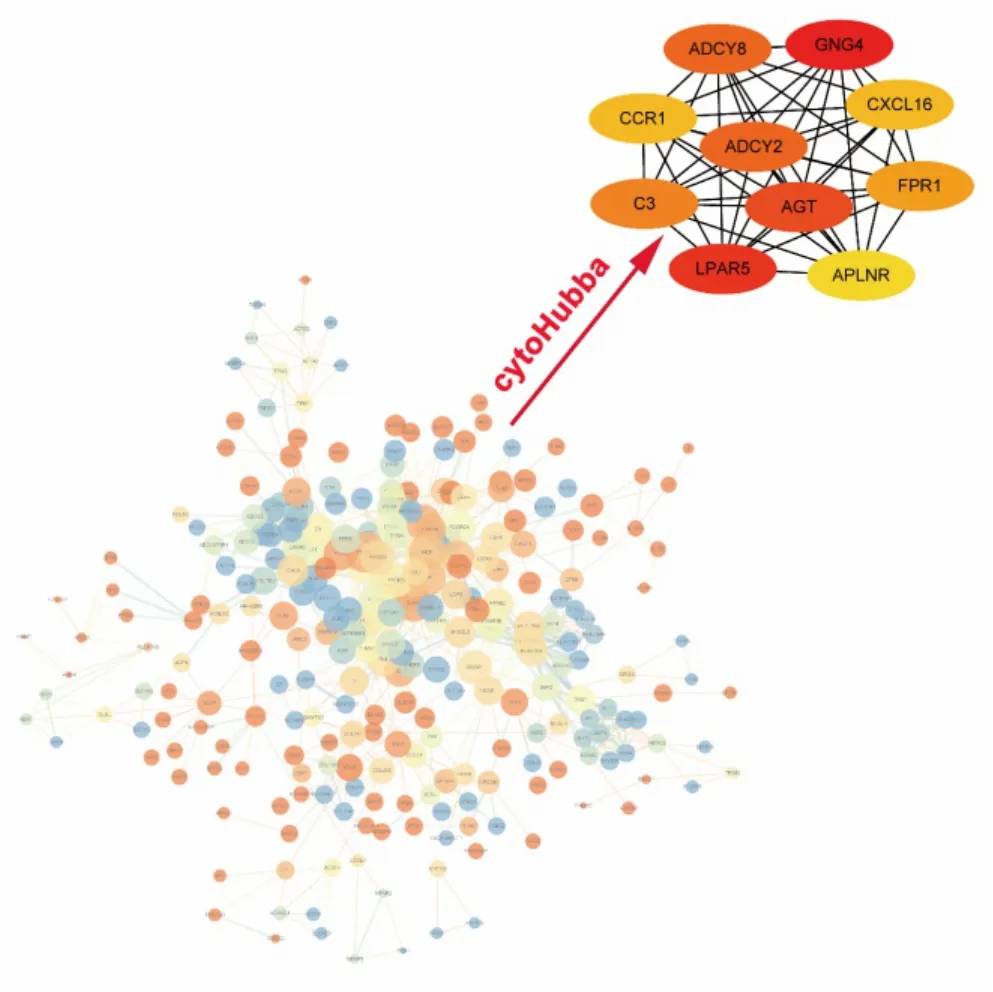
圖3 蛋白互作網(wǎng)絡(luò)和hub基因
利用GEPIA數(shù)據(jù)庫(kù)對(duì)每個(gè)關(guān)鍵基因Kaplan-Meier曲線(xiàn)進(jìn)行分析。我們發(fā)現(xiàn)FPR1表達(dá)水平跟膠質(zhì)瘤患者預(yù)后相關(guān),F(xiàn)PR1在膠質(zhì)瘤高表達(dá)總體生存率低于低表達(dá)患者(|HR|=2.8,P<0.01)(圖4A)。同時(shí),通過(guò)對(duì)Oncomine 數(shù)據(jù)庫(kù)數(shù)據(jù)進(jìn)行非配對(duì)t檢驗(yàn)分析發(fā)現(xiàn),F(xiàn)PR1在膠質(zhì)瘤高表達(dá)(P=1.71×10-6),與基因芯片篩選的結(jié)果一致(圖4B)。
3 討 論
膠質(zhì)瘤是神經(jīng)系統(tǒng)中惡性程度最高,預(yù)后較差的原發(fā)性顱內(nèi)腫瘤。由于呈侵襲性生長(zhǎng)的特性,腫瘤與周?chē)X組織邊界不清,手術(shù)不能完全切除腫瘤組織[16]。然而,一些患者對(duì)化療和放療存在抵抗,使患者預(yù)后較差[17-19]。所以,探索膠質(zhì)瘤的發(fā)病機(jī)制,尋找跟膠質(zhì)瘤早期診斷和預(yù)后相關(guān)的分子標(biāo)志物是目前急需解決的問(wèn)題。近年來(lái),基因組學(xué)、轉(zhuǎn)錄組學(xué)和蛋白質(zhì)組學(xué)方法成為腫瘤在分子水平進(jìn)行機(jī)制研究的主要方法之一[20-22],而基因芯片、高通量測(cè)序等現(xiàn)代生物技術(shù)的快速發(fā)展以及生物信息學(xué)方法的應(yīng)用為我們從分子水平探索膠質(zhì)瘤的發(fā)生、發(fā)展提供了很好的手段。本研究通過(guò)采用生物信息學(xué)方法比較分析了膠質(zhì)瘤組織和正常組織中差異表達(dá)的基因,定義了648個(gè)差異表達(dá)的基因,然后采用DAVID在線(xiàn)分析工具對(duì)差異基因進(jìn)行GO功能注釋及KEGG通路分析,通過(guò)PPI網(wǎng)絡(luò)進(jìn)行膠質(zhì)瘤的可視化分析和定義相關(guān)的關(guān)鍵基因。對(duì)篩選出的10個(gè)關(guān)鍵基因利用GEPIA數(shù)據(jù)庫(kù)進(jìn)行生存分析,我們發(fā)現(xiàn)只有FPR1表達(dá)水平跟患者預(yù)后明顯相關(guān)。
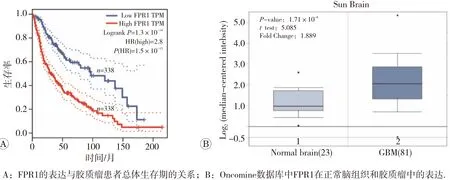
圖4 FPR1在正常腦組織和膠質(zhì)瘤中的表達(dá)和生存曲線(xiàn)
在648個(gè)差異表達(dá)的基因中(包括471個(gè)表達(dá)上調(diào),177個(gè)表達(dá)下調(diào)),進(jìn)行GO功能富集和KEGG信號(hào)通路分析顯示,這些差異基因富集的生物學(xué)過(guò)程主要富集于T細(xì)胞的激活、調(diào)節(jié)白細(xì)胞的黏附、調(diào)節(jié)細(xì)胞的吞噬和細(xì)胞的遷移。細(xì)胞免疫的異常可以促進(jìn)腫瘤的發(fā)生,細(xì)胞遷移能力增強(qiáng)促進(jìn)了腫瘤細(xì)胞的侵襲[23-24]。KEGG通路主要富集于PI3K/Akt,MAPK和鈣離子信號(hào)通路。之前研究顯示,這些信號(hào)通路跟腫瘤的增殖,侵襲和遷移,細(xì)胞凋亡密切相關(guān)[25-26]。在膠質(zhì)瘤發(fā)生發(fā)展中起著重要作用。Snapkov等[27]研究顯示,F(xiàn)PR1在神經(jīng)母細(xì)胞瘤中高表達(dá),F(xiàn)PR1激動(dòng)劑能夠促使細(xì)胞內(nèi)鈣動(dòng)員,并激活MAPK/Erk、PI3K/Akt和P38-MAPK信號(hào)通路,促進(jìn)神經(jīng)母細(xì)胞瘤的增殖。此研究發(fā)現(xiàn)與我們預(yù)測(cè)的結(jié)果一致。利用GEPIA數(shù)據(jù)庫(kù)對(duì)篩選出的10個(gè)關(guān)鍵基因進(jìn)行生存分析顯示,只有FPR1表達(dá)水平跟患者預(yù)后明顯相關(guān),且FPR1在膠質(zhì)瘤組織中明顯高表達(dá),和Oncomine數(shù)據(jù)庫(kù)分析結(jié)果一致(如圖4)。Logrank分析顯示FPR1的表達(dá)水平可以作為潛在的膠質(zhì)瘤患者的預(yù)后標(biāo)志物。
近年來(lái)研究表明,F(xiàn)PR1在多種癌癥均異常表達(dá)。FPR1在胃癌組織中比正常組織中表達(dá)量明顯增加,且與患者生存期密切相關(guān),表達(dá)量越高患者總體生存率越低[8]。 然而Prevete等[28]認(rèn)為在胃癌中FPR1是一種抑癌基因,可以抑制腫瘤血管的生成,增高FPR1的表達(dá)可以明顯抑制胃癌移植瘤的增長(zhǎng),跟之前的結(jié)果不一致。Chen等[12]研究發(fā)現(xiàn),F(xiàn)PR1可以促進(jìn)膠質(zhì)母細(xì)胞瘤U87的侵襲和腫瘤血管形成,降低FPR1的表達(dá),可以抑制裸鼠移植瘤的增長(zhǎng)。Liu等[11]在黑色素瘤中發(fā)現(xiàn),F(xiàn)PR1可以促進(jìn)NK細(xì)胞的遷移,抑制黑色素瘤細(xì)胞的增長(zhǎng)。
綜上所述,基于生物信息學(xué)的方法,通過(guò)分析GSE15824數(shù) 據(jù)集數(shù)據(jù),我們發(fā)現(xiàn)FPR1的表達(dá)水平與膠質(zhì)瘤患者總體生存期明顯相關(guān),F(xiàn)PR1高表達(dá)的患者預(yù)后較差。FPR1可以作為潛在的預(yù)后判斷分子標(biāo)志物,為進(jìn)一步研究膠質(zhì)瘤發(fā)生發(fā)展的分子機(jī)制提供了新思路。

