紫外-化學誘變篩選高產莫納可林K或色素的紅曲菌株
吳雙雙,劉文龍,鄧雪菲,石 鶴,馮艷麗*
(1.湖北師范大學 食用野生植物保育與利用湖北省重點實驗室,湖北 黃石 435002;2.湖北師范大學 生物學國家級實驗教學示范中心,湖北 黃石 435002;3.湖北師范大學 生命科學學院,湖北 黃石 435002)
紅曲菌又叫紅曲霉,是一種小型絲狀真菌,營腐生,屬真菌門(Eumycophyta),子囊菌綱(Ascomycetes),真子囊菌亞綱(Euascomycetes),散囊菌目(Eurotiales),紅曲菌科(Monascaceae)紅曲霉屬(Monascus)[1-2]。紅曲菌的種類有20多種,主要有紫色紅曲菌(Monascuspurpureus)、紅色紅曲菌(Monascus ruber)、叢毛紅曲菌(Monascus pilosus)等[3]。紅曲菌是我國重要的藥食同源微生物,其發酵產物紅曲最早發現于中國,已有近兩千年的生產、應用歷史。紅曲是由紅曲菌接種于大米經發酵而來,在古代既是一種食品,又可做藥用[4-5]。據研究發現,紅曲菌在發酵過程中可產生多種次級代謝產物,其中主要的代謝產物有紅曲色素(Monascus pigments,MPs)、莫納可林K(Monacolin K,MK)、γ-氨基丁酸、麥角固醇等,部分紅曲菌還可產生真菌毒素——桔霉素[6-7]。上述代謝產物中,研究和應用較為廣泛的為MPs和MK。
MPs具有熱穩定性好,蛋白著色力強,對pH穩定,安全無毒等特點,在食品工業中被用作天然食品著色劑[6-7]。MK是1979年日本學者遠藤章從紅色紅曲菌(Monascusruber)的發酵物中分離出來的活性物質,研究發現,在膽固醇生物合成途徑中,羥甲基戊二酰單酰輔酶A(HMG-CoA)的還原酶是控制膽固醇合成的關鍵酶,而MK是這種酶的競爭性抑制劑,可以有效的減少或阻斷內源性膽固醇的合成,調節人體的血脂血壓[8-10]。桔霉素是紅曲菌目前所發現的唯一一種真菌毒素,對腎臟有毒害作用,還可能誘發腫瘤,致畸,致突變等[11-13],但并不是所有的紅曲菌都會產生桔霉素。
然而,桔霉素對紅曲類產品的污染嚴重影響了該產業的健康發展。篩選高產MPs及MK且不產或低產桔霉素的紅曲菌顯得尤為重要,而紫外誘變及化學誘變因操作簡便、效果好等原因得到廣泛應用[14-15]。本研究以MS-1為出發菌株,采用紫外誘變、LiCl誘變及復合誘變的方法,篩選高產MPs和MK且遺傳穩定的紅曲菌株。該研究結果對安全、高效的紅曲菌株篩選及應用具有一定的借鑒意義。
1 材料與方法
1.1 材料與試劑
1.1.1 菌株
叢毛紅曲菌(Monascuspilosus)MS-1(CCTCCM 2013295):由紅曲產品中分離所得。
1.1.2 培養基
馬鈴薯葡萄糖瓊脂(potato dextrose agar,PDA)培養基:去皮馬鈴薯200g切塊,加入1300mL的蒸餾水煮20 min,待土豆熟軟后經4層尼龍布過濾,取濾液定容至1 L,加入20 g葡萄糖及20 g瓊脂粉攪拌溶解,分裝后于121℃滅菌20 min待用。
洛伐他汀抗性培養基:在PDA培養基中加入一定量的洛伐他汀(lovastatin),使培養基中洛伐他汀的質量濃度分別為1.1 mg/mL、1.3 mg/mL、1.5 mg/mL、1.7 mg/mL、1.9 mg/mL和2.1 mg/mL,滅菌待用。
種子培養基:在干凈的空三角瓶中加入葡萄糖80 g/L,蛋白胨10 g/L,NH4H2PO42 g/L,MgSO4·7H2O 0.5 g/L,CaCl20.1 g/L,以土豆汁代替蒸餾水溶解上述藥品,定容后分裝滅菌,制成種子培養基待用。
固態培養基:優化后的培養基米粉和豆粉比例為3∶2[17],原始培養基為純米粉。將培養基加入250 mL三角瓶中,用蒸餾水溶解一定量的乙酸和MgSO4·7H2O,平均分裝后攪拌混勻,滅菌冷卻后再加入12.5 mL無菌水,使培養基初始含水量、乙酸含量及MgSO4·7H2O濃度分別為35%,6 g/L和0.004 mol/kg。
1.1.3 試劑
葡萄糖粉劑:重慶和平制藥有限公司;七水硫酸鎂、無水氯化鈣、無水氯化鋰、磷酸二氫銨、冰乙酸、蛋白胨、瓊脂粉、無水乙醇(均為分析純或生化試劑)、乙腈(色譜純)、磷酸(色譜純):國藥集團化學試劑有限公司。MK標準品(純度≥98%):阿拉丁公司;怡寶純凈水:市售。
1.2 儀器與設備
BCM-1300A生物潔凈工作臺:蘇州安泰空氣技術有限公司;CP114電子天平:奧豪斯儀器有限公司;BSA2202S電子天平:賽多利斯科學儀器有限公司;UV-5100 B紫外分光光度計:上海元析儀器有限公司;Agilent 1260高效液相色譜(high performance liquid chromatography,HPLC)儀:安捷倫科技有限公司;LRH-80生化培養箱、DHG-9070A電熱恒溫鼓風干燥箱:武漢一恒蘇凈科學儀器有限公司;HZQ-F160振蕩培養箱:哈爾濱市東聯電子技術開發有限公司。
1.3 方法
1.3.1 孢子懸液的制備
將紅曲菌MS-1接種于裝有PDA培養基的茄子瓶中,在30℃條件下靜置培養10 d。取15 mL無菌水洗脫上述茄子瓶中的紅曲菌孢子,倒入裝有玻璃珠的無菌錐形瓶內,充分振蕩后經3層無菌擦鏡紙過濾,制成均一的孢子懸液。根據需要將孢子懸液稀釋至105~106CFU/mL。
1.3.2 種子液培養及固態發酵
茄子瓶培養的紅曲菌,用15 mL無菌水洗脫菌絲,倒入帶有玻璃珠的無菌錐形瓶內振蕩打散,吸取菌液加入種子培養基中,在130 r/min、30℃條件下培養36 h。固態發酵時,種子液接種量為130g/L,在30℃條件下培養2~3d,待培養基變紅后調節培養箱溫度為25℃,培養至14 d。將培養好的紅曲米于55℃條件下烘干12 h后粉碎,制得紅曲粉末。
1.3.3 紅曲發酵產物中色價的測定
采用紫外分光光度法測定紅曲產品的色價。取50mL離心管,加入0.3 g紅曲粉和10 mL體積分數75%乙醇,充分振蕩后超聲提取1 h,靜置15 min,分別取上層清液3 mL和4 mL于離心管,8 000 r/min離心10 min,放冰箱冷藏待用。取3 mL提取液,用體積分數75%的乙醇稀釋適當倍數,以體積分數75%乙醇在波長505 nm處的吸光度值(OD值)為0作為對照組,調整紫外分光光度計,測定紅曲粉末中色素的吸光度。紅曲色素的色價計算公式如下:

1.3.4 紅曲發酵產物中MK的測定
采用已優化的高效液相色譜法檢測紅曲產品中MK[17-18]。取保存的4 mL提取液,用體積分數為75%乙醇稀釋至適當倍數,經孔徑0.22μm的有機濾膜過濾,用HPLC法測定MK含量。HPLC系統為Agilent1260,色譜柱為Inertsil ODS-3,流動相為乙腈∶水∶0.5%磷酸=60∶37∶3(V/V),流速1.0 mL/min,柱溫25℃,檢測波長238 nm,進樣量20μL。紅曲樣品中MK含量的計算公式如下:

1.3.5 紫外條件下誘變紅曲菌
取5mL孢子懸液于無菌培養皿中,置于15 W紫外燈下15 cm處[19],照射30 s。按10倍梯度稀釋法將經UV處理過的孢子懸液依次稀釋至10-3~10-7濃度,立即浸入冰水中暗室保存15 min備用。
取稀釋至10-3~10-7冰浴后的誘變懸液0.5 mL于平板中,倒入冷卻至室溫的PDA培養基,搖勻冷卻,凝固后制成計數平板,倒置于30℃條件下培養4~5 d,每一濃度取三個平行。記錄平板菌落數,計算誘變致死率。

取稀釋到10-3~10-7冰浴后的誘變孢子懸液0.2 mL于平板中,倒入Lovastatin抗性培養基,搖勻冷卻制成Lovastatin抗性平板,每組3個平行,于30℃條件下避光培養4~5 d。挑取菌落生長速度較快的誘變菌落于試管培養7 d后轉至茄子瓶擴培10 d。
在以上條件下,調節照射時間分別為60 s、90 s,進行紫外誘變,計算致死率。
1.3.6 紅曲菌的化學誘變
取稀釋到10-3~10-7濃度的MS-1原始孢子懸液0.2 mL于平板中,搖勻,倒入含有0.8‰LiCl的Lovastatin抗性培養基,制成含LiCl的Lovastatin抗性平板,每組三個平行,于30℃條件下避光培養4~5 d,挑取菌落生長速度較快的誘變菌落于試管培養7 d后轉至茄子瓶擴培10 d。
1.3.7 紅曲菌的復合誘變
取稀釋到10-3~10-7冰浴后的誘變孢子懸液0.2 mL于平板中,搖勻,倒入含有0.8‰LiCl的Lovastatin抗性培養基,制成含LiCl的Lovastatin抗性平板,每組三個平行,于30℃條件下避光培養4~5 d。挑選菌落生長速度較快的誘變菌落于試管培養7 d后轉至茄子瓶擴培10 d。
1.3.8 誘變紅曲菌的復篩
將上述三個初篩實驗中保留的16株誘變菌種繼續做優化后培養基固態發酵,發酵方法同1.3.2,14 d后檢測其產MPs和MK含量,與初篩時固態發酵相比較,復篩出產MPs或MK較高的誘變菌。
1.3.9 高產MK誘變菌株的遺傳穩定性實驗及高產MPs誘變菌株的驗證
將復篩得到的高產MK的誘變菌株接種于茄子瓶斜面培養基上,30℃培養10 d,按照1.3.2的方法進行重復性固態發酵實驗,連續傳代5次,測定紅曲米中MK的含量,測定方法同1.3.4。此外在固態發酵過程中,發現兩株誘變菌在優化后高產MK的配方(米粉∶豆粉=3∶2),培養方式為30℃條件下發酵3 d變溫至25℃培養至14 d固態發酵,產生大量MPs。為驗證這一現象,將這兩株菌ZWS1和ZWS5與MS-1以純大米為基質進行固態發酵,在30℃恒溫培養14d。
2 結果與分析
2.1 紫外誘變的結果分析
2.1.1 15 cm 30 s紫外條件下誘變對紅曲菌產MPs和MK的影響
研究發現,在低濃度的Lovastatin抗性平板下培養均長出大量誘變菌落,而在2.1 mg/mL條件下菌落相對較少,經15 cm 30 s紫外誘變和2.1 mg/mL Lovastatin抗性平板下培養選育后,選出7株誘變菌,于固態培養基發酵14 d,以出發菌株MS-1產MPs和MK為對照組,其實驗結果如圖1所示。

圖1 15 cm 30 s紫外誘變條件下各菌株與對照菌株MS-1產紅曲色素色價(A)和莫納可林K含量(B)的比較Fig.1 Comparison of Monascus pigment value(A)and monacolin K contents(B) of different strains and control strain MS-1 at ultraviolet mutagenic condition of 15 cm 30 s
由圖1可知,在15 cm 30 s紫外誘變下,與出發菌株MS-1產MPs及MK含量相比,所有菌株均呈現正突變。其中菌株ZWT3、ZWT5、ZWT6的MPs和MK產量增加最為顯著。MPs產量分別增加了290.41%、293.50%和291.34%,MK產量分別增加了178.51%、175.25%和161.45%,故保留誘變菌株ZWT3、ZWT5、ZWT6這3株菌做復篩實驗。
2.1.2 15 cm 60 s紫外條件下誘變對紅曲菌產MPs和MK的影響
為提高突變率,將誘變時間提至60 s,經質量濃度2.1mg/mLLovastatin抗性平板培養選育后,選擇9株誘變菌在固態培養基上發酵14 d,以出發菌株MS-1為對照組,其產MPs和MK結果如圖2所示。
如圖2A所示,出發菌株經過15 cm 60 s紫外照射誘變后,誘變菌株ZWS1和ZWS5的MPs產量較出發菌株MS-1提高,分別提高了398.69%、400.07%,菌株ZWS2降低了61.1%,其他菌株無明顯變化。如圖2B所示,與出發菌株MS-1相比,誘變菌株ZWS1和ZWS5固態發酵后MK產量提高,分別提高了34.07%、21.65%,菌株ZWS2、ZWS4、ZWS9的MK產量降低了23.51%、38.71%、30.72%,為負突變。綜合圖2A、B,選擇誘變菌株ZWS1、ZWS5這兩株菌做下一步復篩實驗。

圖2 15 cm 60 s紫外誘變條件下各菌株與對照菌株MS-1產紅曲色素色價(A)和莫納可林K含量(B)的比較Fig.2 Comparison of Monascus pigment value(A)and monacolin K contents(B) of different strains and control strain MS-1 at ultraviolet mutagenic condition of 15 cm 60 s
2.1.3 15 cm 90 s紫外條件下誘變對紅曲菌產MPs和MK的影響

圖3 15 cm 90 s紫外誘變條件下各菌株與對照菌株MS-1產紅曲色素色價(A)和莫納可林K含量(B)的比較Fig.3 Comparison of Monascus pigment value(A)and monacolin K contents(B) of different strains and control strain MS-1 at ultraviolet mutagenic condition of 15 cm 90 s
為提高誘變效果,將誘變時間提至90 s,經質量濃度2.1 mg/mL Lovastatin抗性平板下培養選育后,選擇3株誘變菌在固態培養基上發酵14d,以出發菌株MS-1為對照組,其MPs和MK產量結果如圖3所示。
如圖3A所示,經15 cm 90 s紫外照射誘變篩選出的誘變紅曲菌與出發菌株MS-1相比,誘變菌株ZWN1、ZWN2產MPs能力分別提高了129.65%和74.87%。如圖3B所示,ZWN1產MK能力提高了40.93%。結合圖3A、圖3B,保留菌株ZWN1和ZWN2做復篩實驗。
2.2 氯化鋰化學誘變對紅曲菌產MPs和MK的影響
由于誘變的不定向性,為提高突變率,采用0.8‰氯化鋰化學誘變對原始菌株MS-1進行處理,所得菌株通過固態發酵產MPs和MK情況如圖4所示。
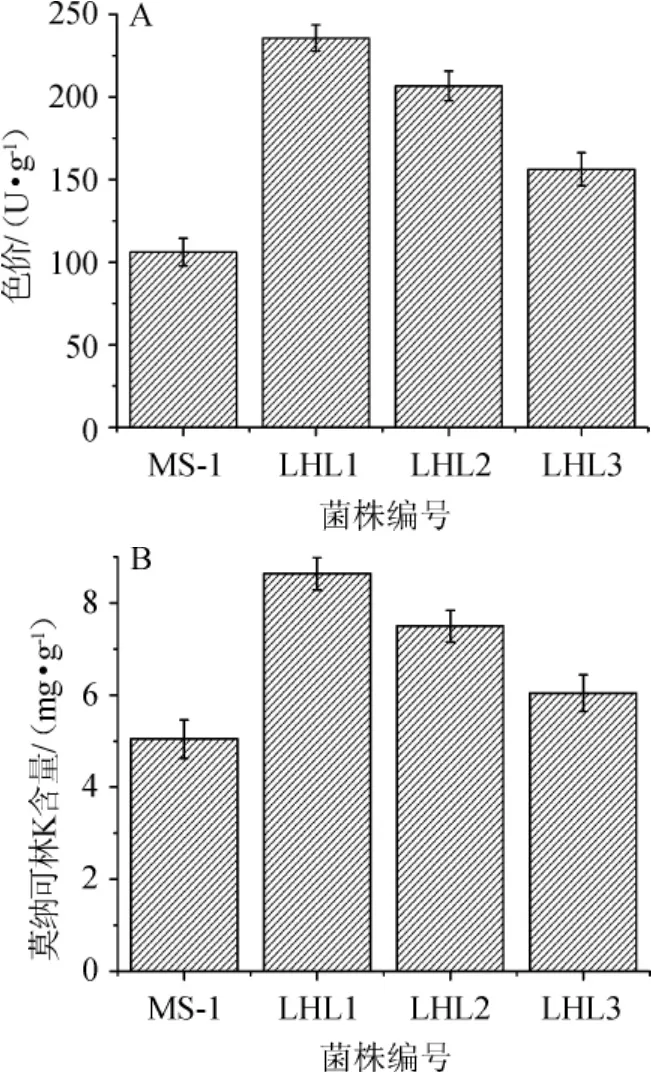
圖4 LiCl化學誘變條件下各菌株與對照菌株MS-1產紅曲色素色價(A)和莫納可林K含量(B)的比較Fig.4 Comparison of Monascus pigment value(A)and monacolin K contents(B) of different strains at the condition of LiCl chemical mutagenesis
如圖4A所示,與出發菌株MS-1相比,誘變菌株LHL1、LHL2產MPs能力分別提高了122.11%和94.72%,如圖4B所示,菌株LHL1、LHL2產MK能力分別提高了71.21%和48.63%。結合圖4A、圖4B,保留菌株LHL1、LHL2做復篩實驗。
2.3 紫外-氯化鋰復合誘變對紅曲菌產MPs和MK的影響
為提高突變的多樣性,采用0.8‰氯化鋰及15 cm 90 s紫外的復合誘變對原始菌株MS-1進行處理,所得菌株通過固態發酵產MPs和MK情況如圖5所示。
如圖5A所示,與出發菌株MS-1相比,誘變菌株FH3、FH5產MPs能力分別提高了76.76%和145.23%。如圖5B所示,菌株FH2、FH5產MK能力分別提高了35.74%和38.95%。結合圖5A、圖5B,保留FH2、FH3、FH5這3株菌做復篩實驗。

圖5 復合誘變條件下各菌株與對照組MS-1產紅曲色素色價(A)和莫納可林K含量(B)的比較Fig.5 Comparison of Monascus pigment value(A)monacolin K content(B) of different strains at the condition of complex mutagenesis
2.4 誘變菌株的復篩
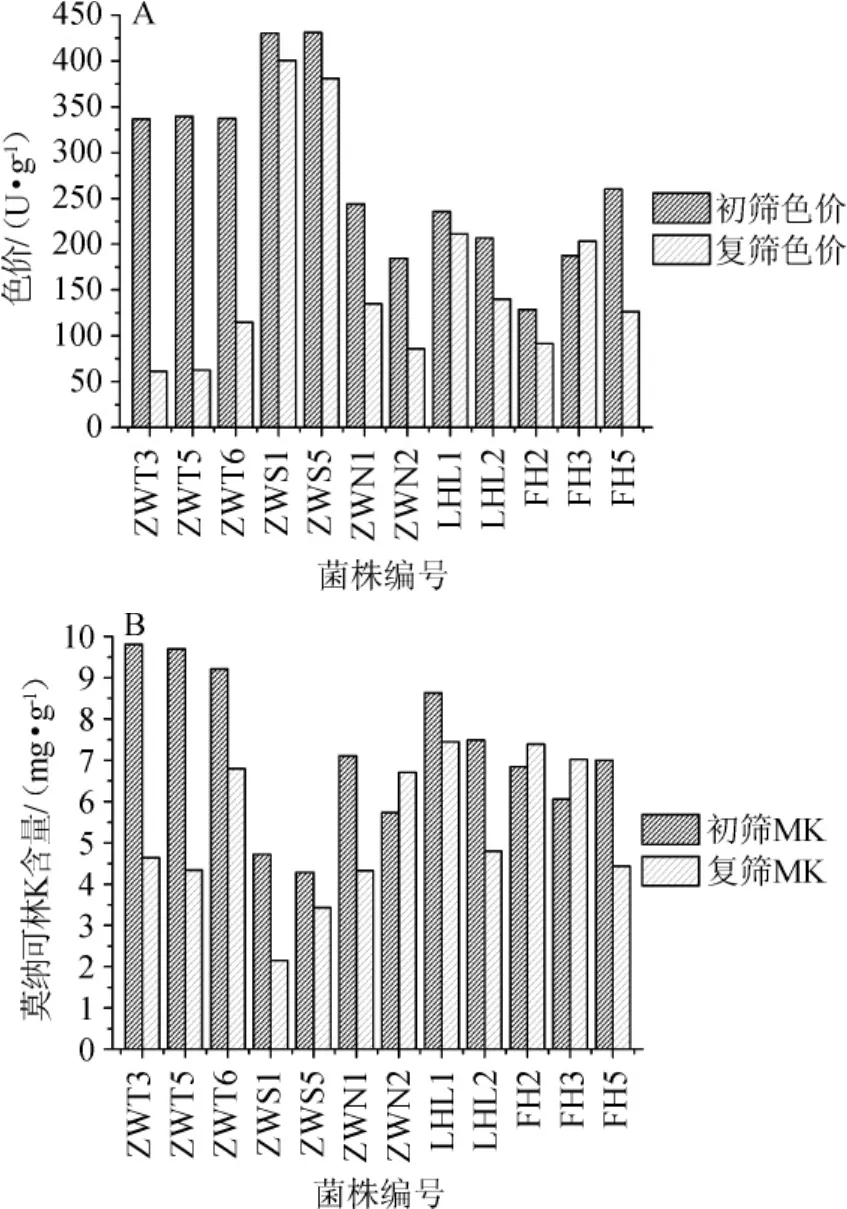
圖6 初篩和復篩后各菌株產紅曲色素色價(A)和莫納可林K含量(B)的比較Fig.6 Comparison of the Monascus pigment value(A)and monacolin K contents(B)in different strains of screening and secondary screening
將上述五個初篩實驗中保留的12株誘變菌種繼續做固態發酵,方法同1.3.2,14 d后檢測其MPs和MK產量,與初次獲得誘變菌時MPs和MK產量進行對比,結果如圖6所示。
由圖6A可知,復篩后的誘變菌產MPs與初篩時相比,產量較高且較穩定的菌株有菌株ZWS1和ZWS5,由圖6B可知,產MK含量較高且較穩定的菌株有菌株ZWN2、LHL1、FH2和FH3這4株菌。故保留這6株菌做遺傳穩定性和驗證實驗。
2.5 高產MK誘變菌株的遺傳穩定性實驗及高產MPs誘變菌株的驗證
將復篩得到的5株高產MK的誘變菌株接種于茄子瓶斜面培養基上,30℃培養10d,按照1.3.2的方法進行重復性固態發酵實驗,連續傳代5次,測定紅曲米中MK的含量,結果如表1所示。結果表明,菌株LHL1、ZWN2和FH2這三株誘變菌株產MK的能力每一代都相差不大,遺傳穩定性較好,而誘變菌株FH3產MK能力不穩定,因此選擇菌株LHL1、ZWN2和FH2這三株高產MK的誘變菌繼續做研究。

表1 誘變紅曲菌的遺傳穩定性Table 1 Genetic stability of mutant Monascus strains
在固態發酵過程中,使用的配方是優化后高產MK的配方(米粉∶豆粉=3∶2)變溫培養,但發酵過程中發現,兩株誘變菌ZWS1和ZWS5在高產MK固態培養基中產生大量MPs。為驗證這一現象,考慮到添加豆粉主要是促進MK的產生[17],在優化后配方中主要對MPs產生呈抑制作用。故將上述兩株菌ZWS1和ZWS5與MS-1以純大米為基質進行固態發酵,在30℃恒溫培養14 d,檢測其產MPs結果如圖7所示。

圖7 高產MPs誘變菌恒溫條件下產紅曲色素情況Fig.7 Production of MPs of mutagenic strains with high yield Monascus pigments at constant temperature condition
如圖7所示,菌株ZWS1產MPs能力較出發菌株MS-1有所下降,與之前結論相悖。說明該菌株在不同培養基中產MPs的能力相差較大,可在后續研究中進一步確定其產MPs的能力及最適培養條件。ZWS5菌株與出發菌株MS-1相比,產MPs能力提高了23.36%,具有后續研究的意義。
3 結論
對高產MPs和MK,不產桔霉素的原始菌株MS-1進行一系列單因素誘變和復合誘變初篩以及固態發酵復篩和遺傳穩定性實驗,分別得到1株高產紅曲MPs的誘變菌ZWS5和3株高產MK且遺傳穩定性良好的誘變菌ZWN2、LHL1和FH2,其中菌株ZWS5產MPs總色價為1 476.25 U/g,與出發菌株MS-1相比產MPs能力提高了23.36%;菌株ZWN2、LHL1和FH2的MK產量分別為7.34 mg/g、7.03 mg/g、和7.16 mg/g,比原始菌株MS-1產MK能力(5.75 mg/g)(第五代遺傳穩定性實驗結果)分別提高了27.65%、22.26%和24.52%。

