基于圖像灰度處理的谷氨酰胺轉氨酶產生菌半定量-高通量篩選
石 楠,張瑩瑩,陳海清,李志輝,劉 雙,于 凡,郭 璇,檀建新*
(1.河北農業大學 食品科技學院 河北省農產品加工工程技術研究中心,河北 保定 071001;2.河北大學 生命科學學院 河北省微生物多樣性研究與應用重點實驗室,河北 保定 071002;3.承德市農林科學院,河北 承德 067000;4.河北農業大學渤海校區 后勤管理辦公室,河北 滄州 061100)
谷氨酰胺轉氨酶(transglutaminase,TG)是一種食品行業中應用廣泛的添加劑,微生物來源的TG通常被稱為微生物谷氨酰胺轉胺酶(microbial transglutaminase,MTG),被譽為“21世紀超級粘合劑”[1],可應用于多種食品的加工過程中,例如肉類產品的重構、防止奶酪脫水收縮[2-4]、參與功能油脂的微膠囊化[5]等。MTG可以由多種微生物產生,如茂源鏈霉菌(Streptomyces mobaraensis)[6]、吸水鏈霉菌(Streptomyces hygroscopicus)[7]、環狀芽孢桿菌(Bacillus circulans)[8]等。
對MTG產生菌進行篩選和檢測時,通常采用經典的氧肟酸比色法[9],但是該方法中底物N-羧基苯甲酰基L-谷氨酰基甘氨酸(N-α-carboxybenzoyl-L-glutaminyl-glycine,N-CBZ-Gln-Gly)價格昂貴且用量較大,不適于菌株的大規模、高通量檢測篩選;因此,在菌種的初篩階段,人們通常會采用比較廉價的蛋白質交聯-絮凝沉淀法[10-11]或稱凝膠法[12],然而微生物的發酵液通常組成復雜,代謝產物中有很多成分可以使酪蛋白凝集或沉淀,很容易對凝膠現象的觀察造成干擾;BOURNEOWC等[13]曾建立了一種濾紙片(filter paper disc,FPD)檢測法,但這種方法獲得的陽性菌落需要事先復印在其他非顯色平板上,顯色后再對應菌落位置選擇接種,不利于后續復篩。
Image J是一種廣泛應用于各種科學圖像分析處理的開放軟件[14],如醫學影像分析[15-16]、真菌孢子觀察[17]等。因此,本研究將一株MTG產生菌擬無枝酸菌(Amycolatopsis sp.)109.5經紫外誘變后產生的突變株接種于含有固體培養基的96孔板中,在孔內進行酶活檢測反應,采用Image J軟件獲取各孔顯色結果的灰度均值,根據該值大小進行突變株的初篩,以期建立MTG產生菌的半定量-高通量篩選方法,為MTG高產菌株或新產生菌的快速半定量-高通量篩選提供技術支持。
1 材料與方法
1.1 材料與試劑
1.1.1 菌株
擬無枝酸菌(Amycolatopsis sp.)109.5:分離自河北省承德地區土壤樣本,分離純化后高氏斜面4℃保存。
1.1.2 試劑
N-CBZ-Gln-Gly、鹽酸羥胺、還原型谷胱甘肽、L-谷氨酸-γ-單羥肟酸:美國Sigma公司;谷氨酰胺轉氨酶-B(transglutaminase-B,TG-B)酶粉(酶活10 U/g):上海雪豐國際貿易有限公司;其余常規生化試劑:北京奧博星生物技術有限責任公司。
1.1.3 培養基
高氏培養基:可溶性淀粉20 g/L、KNO31 g/L、K2HPO40.5 g/L、MgSO4·7H2O 0.5 g/L、NaCl 0.5 g/L、FeSO4·7H2O 0.01 g/L、瓊脂粉12 g/L、蒸餾水1 L,pH 7.2~7.4。
營養瓊脂(nutrient agar,NA)培養基:牛肉膏1 g/L、酵母粉2 g/L、蛋白胨5 g/L、NaCl 5 g/L、瓊脂粉12 g/L、蒸餾水1 L,pH 7.4。
種子培養基:葡萄糖10g/L、蛋白胨10g/L、酵母粉10g/L、K2HPO40.7 g/L、KH2PO40.3 g/L、MgSO4·7H2O 0.5 g/L、蒸餾
水1 L,pH 7.0。
發酵培養基:葡萄糖25g/L、蛋白胨35g/L、酵母粉2g/L、NaCl 5 g/L、蒸餾水1 L,pH 7.2。
孢子萌發培養基:可溶性淀粉1 g/L、(NH4)2SO42 g/L、KH2PO41g/L、NaCl 1g/L、MgSO4·7H2O1g/L、微量元素溶液(FeSO4·7H2O 1 g/L、MnCl2·4H2O 1 g/L、ZnSO4·7H2O 1 g/L)1 mL,蒸餾水1 L,pH 7.0。
以上培養基中,種子培養基與發酵培養基滅菌條件為115℃,20 min;其余培養基滅菌條件均為121℃,15 min。
1.2 儀器與設備
Costar96孔板:美國Corning公司;軟件ImageJ2x(2.1.4.7):美國國家衛生研究院;756P紫外-可見分光光度儀:上海光譜儀器有限公司。
1.3 方法
1.3.1 突變株的獲得
取新鮮培養孢子成熟的菌株109.5高氏斜面,用孢子萌發培養基將斜面上的孢子洗下,無菌擦鏡紙過濾去除菌絲,置于含有50 mL孢子萌發培養基和適量玻璃珠的250 mL三角瓶中,調節孢子懸液濃度約為1×108CFU/mL,溫度30℃、轉速200 r/min條件下搖床振蕩2~3 h,使孢子萌發至菌絲長度約為孢子直徑的一半。將孢子懸液置于無菌平皿中進行紫外(ultra violet,UV)誘變,UV誘變條件:紫外燈20 W,照射距離25 cm,照射時間60 s。誘變后的孢子懸液經梯度稀釋(稀釋梯度10-3、10-4、10-5),將稀釋液涂布于高氏培養基平板,30℃避光倒置培養3 d,至單菌落長出。挑取生長迅速、菌落邊緣整齊、孢子豐富的單菌落轉接至高氏斜面,每個單菌落轉接1支高氏斜面。
1.3.2 96孔板反應體系的確定
酶活測定底物液:0.2 mol/L Tris-乙酸緩沖液(pH 6.0)中N-CBZ-Gln-Gly 30 mmol/L、鹽酸羥胺0.1 mol/L、還原型谷胱甘肽10 mmol/L。
酶活測定終止液:三氯乙酸-氯化鐵溶液,由5%FeCl3、12%CCl3COOH、3 mol/L HCl等體積混和。
選擇谷氨酰胺轉氨酶的商品酶制劑TG-B酶粉作為確立反應體系的標準參照物,以確定96孔板中酶顯色反應的適宜條件。配制TG-B酶粉酶活梯度溶液(0、0.01 U/mL、0.05U/mL、0.1U/mL、0.2U/mL、0.4U/mL、0.6U/mL、0.8U/mL),酶活測定參考氧肟酸比色法[9,12]并有所改進;考慮到接種到固體培養基上的突變株分泌的酶量未知但有限,故取10μL酶液(即酶量范圍為0.000 1~0.008 0 U)加入無菌96孔板的孔中,分別加入底物液10μL和30μL,37℃培養箱溫浴10 min后加等體積終止液顯色,根據顏色深淺確定適宜反應體系。
1.3.3 96孔板培養基的選擇
分別取高氏培養基、發酵固體培養基和營養瓊脂培養基于無菌96孔板中,每孔200μL;采用接種環從斜面菌種上刮取相同面積(0.3 cm×1.0 cm)的部分突變株和出發菌株分別接種至3種培養基,涂布涂勻;96孔板加蓋并用封口膜密封,置于30℃條件下培養3 d。取底物液加入培養好的菌體表面,37℃培養箱溫浴10 min,加終止液顯色,對比幾種培養基的顯色效果,確定最適培養基。
1.3.4 谷氨酰胺轉氨酶突變株的半定量-高通量篩選
制備含有適宜培養基的96孔板,將突變株自高氏斜面接種至培養基,保持接種量基本一致,且涂布均勻,每個菌株接種一個孔;同時接種出發菌株109.5作為對照(CK),30℃條件下培養3 d。
在軟件Image J中打開顯色結果圖片,轉換圖片類型為32-bit(32位)灰度圖像,從分析菜單欄的工具選項中調出目標區域(region of interests,ROI)工具,用橢圓取圖選中待分析的孔,調整取圖框邊界以適應孔內待測區域,加入到ROI工具中;重復以上操作至選擇完畢所有需要分析的孔,點擊ROI工具中的測量選項獲得計算結果。結果數值中以灰度平均值體現不同孔的顏色深淺差異。灰度值指黑白圖像中點的顏色深度,范圍在0~255之間,白色為255,黑色為0;故顏色越深則數值越小。
1.3.5 突變株的復篩
將篩選得到的正突變株從高氏斜面接種至裝有10 mL種子培養基的100mL三角瓶中,每株接種3瓶,30℃、200r/min條件下培養30h后按3%(V/V)接種量分別轉接至裝有60mL發酵培養基的300 mL三角瓶中,30℃、200 r/min條件下培養70 h后,9 000 r/min離心3 min,取上清液即為粗酶液,測定MTG活力。
參考經典氧肟酸比色法[9,12]測定MTG活力:取200μL粗酶液置于1.5mL離心管中,加入200μL底物液,37℃培養箱溫浴10min后加200μL終止液顯色,反應體系經12000r/min離心1 min,采用分光光度儀測定上清液在波長525 nm條件下的吸光度值,根據L-谷氨酸-γ-單羥肟酸生成的標準曲線(y=0.191 1x+0.017 1,R2=0.998 1)計算MTG酶活力;MTG酶活力單位:37℃條件下每分鐘催化形成1μmol的L-谷氨酸-γ-單羥肟酸所需要的酶量[8,18]。
2 結果與分析
2.1 擬無枝酸菌109.5的紫外誘變
菌株109.5是從土壤樣品中分離到的野生型菌株。有文獻報道[19],對于野生型菌株,誘變初始采用較高的劑量,容易引起遺傳物質發生較大幅度的變異,如此獲得的突變株不易回復突變,遺傳特性比較穩定。菌株109.5經紫外誘變60 s后,致死率達到99.75%,屬于較高劑量范圍;最終共獲得突變株334株,編號為1~334。
2.2 96孔板反應體系的確定
兩種反應體系的顯色結果見圖1。
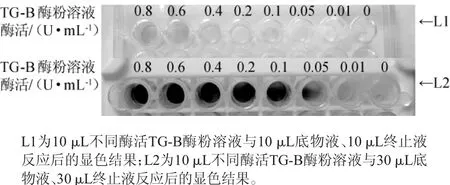
圖1 兩種反應體系的顯色結果Fig.1 Color results of two kinds of reaction systems
由圖1可知,L1反應體系中整體顏色偏淺,無法指示酶濃度的變化;而L2反應體系中隨著酶濃度的增加,反應體系顏色逐漸加深。說明在給定酶量的酶粉溶液中,L1反應體系中的反應物不足量,不足以完全指示酶活力大小;L2體系中的反應物足量,檢出限可達0.000 1 U酶量,可以通過顯色結果推斷酶的濃度。由此確定96孔板固體培養基篩選的反應體系為底物液和終止液各30μL。
2.3 96孔板篩選培養基的確定
隨機選取6株突變菌株(1編號為1~16),與出發菌株109.5(CK)同時接種在96孔板中的3種培養基上。培養3 d后,3種培養基中菌體均正常生長。加入30μL底物液和終止液顯色后結果如圖2所示。

圖2 96孔板中突變菌株在3種固體培養基上的顯色結果對比Fig.2 Color result comparison of mutants on three kinds of solid media in 96-well plates
由圖2可知,高氏培養基上生長的菌株未產生明顯的顏色反應,說明高氏培養基僅可供菌體生長而不利于菌種產MTG;發酵固體培養基與營養瓊脂培養基上的菌株有明顯的顏色反應,說明這兩種培養基適合菌株產MTG。

圖3 突變株在兩種固體培養基上的生長情況與顯色結果Fig.3 Growth situations and color results of mutants on two kinds of solid media
隨機選取38株突變株(編號為1~38)與出發菌株109.5(CK)分別接種到含有發酵固體培養基與營養瓊脂培養基的96孔板中,每孔含培養基200μL,30℃培養3d后進行顯色反應。同時取酶活分別為0、0.01U/mL、0.05U/mL、0.1 U/mL的TG-B酶粉溶液10μL加入空白未接種孔(內含相同培養基),其它生長菌落孔中加10μL Tris-乙酸溶液,以使每孔內的溶液終體積一致,一同進行顯色反應;以觀察低酶活的酶粉溶液在固體培養基上的顯色效果。結果見圖3。
由圖3可知,低酶活酶粉溶液在兩種培養基上均可以呈現肉眼可見的顏色變化,突變株也呈現了明顯的顏色差異;但相對而言,發酵固體培養基的本底顏色較深,有的突變株在生長過程中就使培養基出現了顏色變化;而營養瓊脂培養基被認為是對檢測時顏色干擾較少的培養基[13],本底淺,能突出顯色反應后的顏色差異。因此營養瓊脂培養基適宜作為突變株篩選的培養基。
2.4 產谷氨酰胺轉氨酶突變株的半定量-高通量篩選
將其余296株突變株及出發菌株109.5(CK)分別接種于含有營養瓊脂培養基的96孔板中,30℃條件下培養3 d后進行顯色反應。在Image J軟件中打開所要分析的顯色結果圖片,依次選取每個孔的顯色區域,測定所有突變株的灰度均值,部分灰度均值見表1。

表1 部分突變株的灰度均值Table 1 Grayscale averages of some mutants
以CK菌株的灰度均值85.883為參比,低于此值的即為正突變株。由表1可知,38株突變株中,正變株有24株,其中均值最小的是突變株19,灰度均值為54.684。按照這種方法,從334株突變株中初篩獲得6株灰度均值明顯減小的正突變株(P<0.01),菌株編號分別為19、80、118、127、227、229。
2.5 篩選結果驗證
將初篩獲得的6株正突變株進行搖瓶發酵復篩,同時隨機選取一株灰度均值>CK菌株的突變株212(即負突變株)同時進行搖瓶發酵作為對照。MTG酶活測定結果見表2。

表2 突變株的MTG活力測定結果Table 2 Determination results of MTG activity of mutants
由表2可知,6株正突變株的MTG活力確實>CK菌株;而負突變株212的MTG活力<CK菌株。其中突變株80的MTG活力最高,為0.803 U/mL,比出發菌株(0.323 U/mL)MTG活力提高148.6%,而負突變株212的MTG活力為0.241U/mL,下降25.3%。
由此可見,基于Image J的96孔板固體培養適用于產MTG擬無枝酸菌株109.5突變株的初篩,并實現突變株的半定量-高通量篩選。相比于搖瓶發酵,96孔板固體培養篩選簡化為一步接種在固體培養基上顯色對比灰度均值,節省了時間和培養基的用量,也節省了培養空間。另外,96孔板內每個孔的培養基體積都相等,在接種量保持基本一致的前提下,顯色結果可以體現突變株的產酶差異,且相比于肉眼直接觀察的無法定量的凝膠法篩選,可以通過灰度均值來實現半定量測定及產酶能力-高通量篩選。
3 結論
采用96孔板固體培養結合Image J圖像處理軟件獲取菌落顯色反應的灰度均值,實現了產MTG擬無枝酸菌(Amycolatopsis sp.)109.5紫外誘變突變株的半定量測定及產MTG酶能力的高通量篩選。通過該方法從擬無枝酸菌株109.5紫外誘變后獲得的334株突變株中成功篩選到一株MTG高活力突變株80,較出發菌株109.5的MTG活力提高148.6%。相對于傳統的搖瓶發酵篩選,這種半定量-高通量篩選方法大大節省了培養空間和程序,可以推廣應用至其它也需通過顯色反應進行篩選的菌株;可作為MTG突變菌株的高通量篩選方法,為進一步擴大MTG產生菌資源從而開發更好的食品用酶制劑提供技術支持。

