匍枝根霉誘變株β-葡萄糖苷酶結構功能研究及發酵優化
鄭賢金,湯斌
(安徽工程大學 生物與化學工程學院,安徽 蕪湖,241000)
β-葡萄糖苷酶(β-glycosidase,BG),又稱纖維二糖酶,在食物增香、減少大豆熟糖漿造成的苦味、糖尿病治療等方面具有重要作用[1-2]。尤為重要的是,在纖維素酶協同降解纖維素的過程中,BG可將纖維二糖分解成葡萄糖,因而可以有效解除降解過程中纖維二糖過度積累對外切酶和內切酶的限制[3],提高纖維素酶的利用效率。然而,除黑曲霉外,目前常用于生產的木霉、青霉等菌株中內切酶和外切酶所占比例較高,而BG則相對不足[4]。蘇龍等[5]對羅爾夫青霉HXL發酵條件進行優化,發酵7 d后BG酶活達到21.68 U/mL(等同于21.68 IU/mL);陳娜等[4]通過對黑曲霉TJ02進行誘變選育及發酵條件優化,BG酶活達到39 IU/mL。BG酶活的提高可有效促進纖維素向葡萄糖的轉化[6],因此提高BG產量對纖維素的降解具有重要意義。
本文所使用出發菌株匍枝根霉TZ-03為本實驗室對原菌TP-02誘變選育所得,其BG酶活較原菌提高1.52倍。且匍枝根霉具有發酵時間短的優勢,因此若能進一步提高BG產量則會有重要的工業應用價值。
本文初步分析了誘變后TZ-03菌株BG酶活提高的原因,并通過搖瓶優化培養基組分及10 L發酵罐放大培養TZ-03,顯著提高了BG酶活,為今后BG的工業化生產提供理論參考。
1 材料與方法
1.1 材料與試劑
匍枝根霉TZ-03,對本實驗室保藏菌株匍枝根霉TP-02進行紫外-甲基磺酸乙酯復合誘變所得。具體條件:濃度107~108個/mL的TP-02孢子懸浮液8 mL加入2 mL甲基磺酸乙酯,將其置于90 W紫外燈下照射5 min后用10% NaS2O3溶液終止反應。
匍枝根霉TP-02,E.coliJM109由安徽工程大學3R實驗室保藏;pUCM-T載體,上海生工生物有限公司;質粒提取試劑盒、DNA純化試劑盒、DNA膠回收試劑盒、T4DNA ligation、EcoR I、蛋白Marker等,寶生物(大連)有限公司。其他常用藥品購于國藥集團。
1.2 培養基
種子培養基:100 g/L麩皮浸出汁(100 g新鮮麩皮加入1 000 mL蒸餾水,煮沸30 min,6層紗布過濾并最終定容至1 000 mL),121 ℃滅菌20 min。
基礎發酵培養基:稻草粉(80目) 20 g/L、豆粕粉10 g、50 g/L麩皮浸出汁、CaCl22 g/L、MgSO4·7H2O 3 g/L、KH2PO43 g/L、PEG-4000 0.25 g/L、Tween 80 200 μL/L、微量元素液1 mL/L,121 ℃滅菌20 min。
微量元素溶液(mg/L):FeSO4·7H2O 5、MnSO4·H2O 1.6、ZnSO4·7H2O 1.4、CoCl2·2H2O 2。
LB液體培養基、LB固體培養基等參考文獻[7]。
1.3 儀器與設備
BIOTECH-10JSA-3000PLC自動發酵罐,上海保興生物設備工程有限公司;TC312 PCR儀,美國TECH公司;Allg642高速冷凍離心機,美國貝克曼公司;TL988實時熒光定量PCR儀,西安天隆科技有限公司。
1.4 實驗方法
1.4.1 誘變前后BG酶活及轉錄水平的比較
將匍枝根霉TZ-03斜面接種至種子培養基中,200 r/min,30 ℃條件下培養24 h后按10%接種量接種至發酵培養基,30 ℃,200 r/min條件下培養5 d,每12 h測定1次BG酶活;對培養24 h后的種子液進行預處理,利用Trizol法提取總RNA,試劑盒法去除基因組DNA并通過反轉錄合成cDNA,利用RT-PCR檢測bgl4的轉錄水平[8-9]。
1.4.2誘變株BG編碼基因bgl4的獲取
采用CTAB法提取基因組[8]。根據GenBank上已公布的相關BG基因序列的保守序列比對分析設計引物1-F和1-R(表1),以基因組為模板擴增目的條帶,PCR產物切膠回收,連接pUCM-T載體,轉化E.coliJM109,挑選陽性轉化子[9],送上海生工測序,其中PCR程序為95 ℃ 2 min,94 ℃ 50 s,45 ℃ 50 s,72 ℃ 90 s,35個循環,72 ℃延伸10 min。根據測序結果設計引物,利用熱不對稱PCR補全上下游片段,其中上游片段設計引物SP1、SP2、SP3;下游設計的引物SP4、SP5、SP6。再根據補全的完整基因序列設計引物2-F和2-R,以基因組為模板,擴增目的基因,測序進行驗證,PCR程序為95 ℃ 2 min,94 ℃ 50 s,53 ℃ 50 s,72 ℃ 90 s,35個循環,72 ℃延伸10 min。

表1 本研究所用引物Table 1 Primers used in this study
1.4.3 BGL IV生物信息學分析
利用DNAMAN軟件將匍枝根霉TZ-03的BG基因bgl4和TP-02的BG基因bgl序列翻譯成對應的氨基酸序列,并將氨基酸上傳至Swiss model數據庫(https://www.swissmodel.expasy.org/i),通過選取自由能最低的蛋白質結構模型為模板進行同源建模。并利用Discovery Studio 3.0軟件,以纖維二糖為配體進行分子對接,進行結構功能分析。
1.4.4 發酵條件優化
分別以質量分數為2%的玉米淀粉、蔗糖、葡萄糖、糊精、木糖、纖維二糖、乳糖、麩皮粉、微晶纖維素、CMC、可溶性淀粉、殼聚糖為碳源進行碳源優化,對照組為稻草粉,培養條件為250 mL錐形瓶裝液80 mL,30 ℃,200 r/min,接種量10%,以BG酶活為指標,確定最佳碳源;在上述優化基礎上,調整氮源種類為質量分數1%的硫酸銨、胰蛋白胨、氯化銨、大豆蛋白胨、魚粉蛋白胨、乳清粉、豆渣粉、酵母粉、玉米漿、黃豆粉和質量分數0.5%的尿素,以BG酶活為指標,確定最佳氮源;上述碳氮源優化的基礎上,向培養基中添加已過濾除菌的各種氨基酸,使其終濃度為0.1%,以不加氨基酸為對照組,確定最佳氨基酸添加種類。
1.4.5 10 L發酵罐放大實驗
培養基為搖瓶優化最優培養基,10 L發酵罐裝液量5 L,初始pH值4.8,溫度為30 ℃,接種量為10%,初始轉速300 r/min,初始罐壓0.06 MPa。在發酵過程中調節轉速、通氣量和罐壓維持溶氧在30%左右;調節磷酸和氨水控制pH值維持在4.8左右;發酵24 h后控制補料量(20%淀粉水解液),使發酵液中還原糖的含量在1.2 mg/mL左右。
1.4.6 BG酶活測定
取發酵液1.2 mL于1.5 mL離心管中,3 500 r/min離心10 s后,將上清液用0.05 mol/L pH值4.8檸檬酸-檸檬酸鈉緩沖液稀釋適當倍數用于酶活測定。以質量分數為1%水楊苷溶液1 mL為底物,按文獻的方法測定β-葡萄糖苷酶酶活[10]。
酶活定義:適當反應條件下,每分鐘水解底物生成1 μmol還原糖所需的酶量即為1個酶活單位,表示為IU/mL。
2 結果與分析
2.1 誘變前后BG及轉錄水平的比較
在基礎發酵培養基中,原始菌株TP-02和突變株TZ-03的BG酶活如圖1-a所示,TP-02的BG酶活在84 h達到4.12 IU/mL,誘變后TZ-03則在108 h達到BG酶活峰值10.53 IU/mL,酶活提高了1.52倍。TP-02的BG基因bgl和TZ-03的BG基因bgl4的轉錄水平如圖1-b所示,2個基因拷貝數分別為3.18×107和3.12×106,誘變后轉錄水平上調90.19%。轉錄水平的提高可導致蛋白表達量的提高,故而很可能引起BG酶活提高。
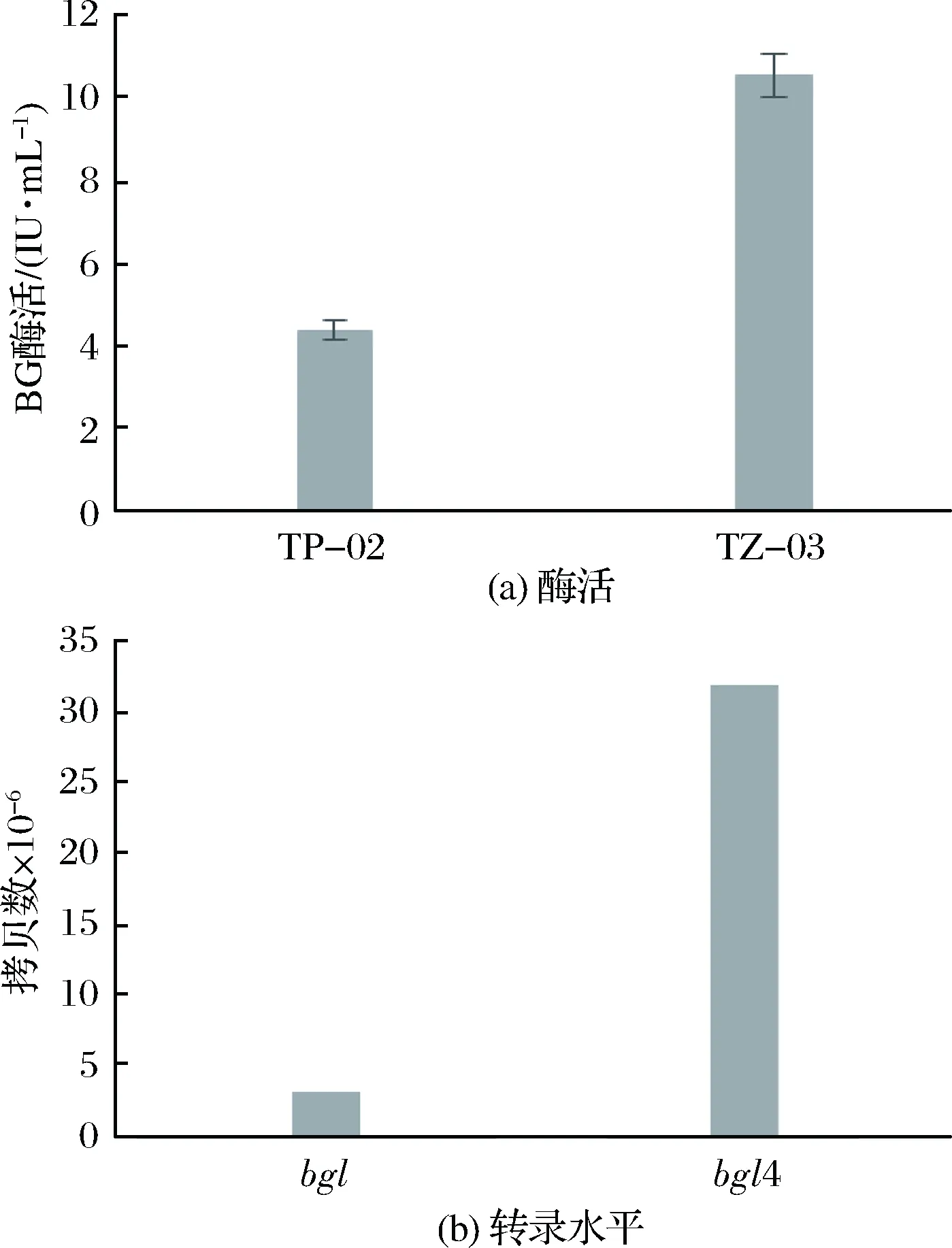
圖1 BG酶活(a)及轉錄水平比較(b)Fig.1 The comparison of β-glycosidase activity(a) and transcriptional level(b)
2.2 誘變株BG編碼基因bgl4的克隆
以基因組為模板,克隆得到的1條1 500 bp左右的條帶(圖2),經測序,結果顯示該目的基因全長為1 479 bp,共編碼492個氨基酸。

M-Marker;1,2-目的條帶圖2 bgl4基因的克隆Fig.2 Cloning of bgl4 gene
2.3 BGL IV生物信息學分析
利用CLUSTALW在線工具對BGL和BGL IV的氨基酸序列進行比對。結果如圖3所示,與BGL氨基酸序列相比,BGL IV頭尾的部分氨基酸發生了替換和缺失,此外在242~272位之間多了一段氨基酸序列。紫外誘變易引起堿基轉換、顛換、移碼突變或缺失,從而可能造成其編碼氨基酸的小范圍改變[11];而化學誘變劑則可能會與核苷結構的磷酸反應,形成酯類而將核苷酸從磷酸與糖分子之間切斷,造成染色體數量變化[12]。因此誘變后氨基酸序列的改變可能是紫外和甲基磺酸乙酯2種誘變方式共同作用的結果。

圖3 BGL氨基酸序列與BGL IV氨基酸序列的差異Fig.3 The difference of amino acid sequence between BGL IV and BGL
利用Swiss model對BGL和BGL IV進行同源建模,并以纖維二糖為底物,利用Discovery Studio 3.0軟件進行分子對接,從而對誘變前后結構功能的變化進行分析,其結果如圖4所示。圖4-a為突變前BGL的分子表面,可以看出酶分子內部形成了一個口袋,與底物相互作用,纖維二糖結合到口袋深處;圖4-b表示參與纖維二糖配體形成氫鍵的氨基酸殘基,突變之前,共有ASN242、TYR315、Glu384、Glu173和Trp442等5個氨基酸可以與纖維二糖,結合,形成6個氫鍵這些氨基酸是關鍵的氨基酸,在酶的催化過程中有著不可替代的作用。
誘變之后的分子表面圖4-c顯示,誘變后活性中心遷移,結合區域由口袋深處變淺,這種結構可能使得活性中心更大,一定程度上解決了原中心存在的受力不均、底物堆積等問題,可能使酶分子更快速高效地與底物發生相互作用。同時誘變之后,結合區域的關鍵氨基酸發生顯著變化。與纖維二糖形成氫鍵的氨基酸有Ala11,Gln70,Ala456,Tyr454,Ala71,Cys67,共形成9個氫鍵,氫鍵數量增加[13-14]。誘變后結構的改變可能更有利于酶與底物的結合,對酶活的提高也有一定的促進作用。

a-TP-02分子表面的結構;b-TP-02參與形成氫鍵的關鍵氨基酸;(c)-TZ-03分子表面的結構;d-TZ-03參與形成氫鍵的關鍵氨基酸。虛線表示氫鍵圖4 BGL和BGL IV與底物結合的結構Fig.4 Structure of BGL-cellobiose complex and BGL IV-cellobiose complex
2.4 培養基優化
2.4.1 碳氮源對BG酶活的影響
碳氮源在微生物的生長過程中具有重要作用,除提供基本營養物質以外,碳源還可提供細胞及產物合成的碳架,氮源則可提供微生物生長所需核苷酸、維生素和礦物質元素等物質合成的原料[15-16]。碳源對BG酶活的影響如圖5-a所示,對照組(稻草粉)酶活達到10.53 IU/mL,與其相比,葡萄糖、纖維二糖等糖類碳源的BG酶活普遍較低,而纖維素類碳源BG酶活較高,以麩皮粉為碳源的酶活達到11.47 IU/mL。當以2%微晶纖維素為碳源時,BG酶活在108 h達到峰值14.41 IU/mL,與對照組相比提高了36.8%。
確定碳源為微晶纖維素的基礎上,選取不同氮源進行發酵,結果如圖5-b所示。總體而言,與有機氮源相比,無機氮源發酵的整體效果較差,其中無機氮源中氯化銨最高酶活只有6.43 IU/mL,而有機氮源成分較為復雜,其中含有的維生素、微量元素、生長因子等可能會促進微生物繁殖和產酶,因此BG酶活普遍較高。當魚粉蛋白胨作為氮源時,其最高BG酶活可在108 h達到18.30 IU/mL,與氮源優化前相比,提高30.5%。

a-碳源優化;b-氮源優化圖5 碳氮源優化對BG酶活影響Fig.5 Effect of carbon sources and nitrogen sources on β-glycosidase activity
2.4.2 氨基酸添加對BG酶活的影響
通過往培養基中添加不同種類的氨基酸,研究氨基酸對BG酶活的影響,結果如圖6所示。半胱氨酸、谷氨酸、組氨酸的添加對BG酶活影響較大,其中以谷氨酸的提高為最,其BG酶活在108 h可達22.15 IU/mL。氨基酸的添加可能會影響金屬離子與相關蛋白質的結合[17],從而對蛋白質的結構起穩定作用,且氨基酸的加入可能會影響纖維素酶吸附結構域的結構,提高表面有效酶的濃度[18]。

圖6 氨基酸添加對BG酶活影響Fig.6 Effect of amino acid addition on β-glycosidase activity
2.5 10 L發酵罐放大實驗
根據搖瓶優化,確定最優培養基為:微晶纖維素20 g/L、魚粉蛋白胨10 g/L、麩皮浸出汁50 g/L、CaCl22 g/L、KH2PO43 g/L、MgSO4·7H2O 3 g/L、谷氨酸1 g/L、PEG-4000 0.2 g/L、Tween 80 200 μL/L、微量元素液1 mL/L,以上培養基進行10 L發酵罐直接放大實驗。同等條件下搖瓶發酵作為對照,比較發酵過程中BG酶活和殘糖的變化。如圖7(b)所示,0~3.5 h溶氧基本維持在95%左右,pH在4.3附近,這段時間菌體生長較為緩慢;4 h后溶氧和pH均快速下降,8.5 h溶氧下降到20.8%,9.5 h下降到9.85%,pH值下降到3.6,且還原糖快速下降,說明菌體在這段時間消耗糖類物質大量生長繁殖,其中產生的酸性物質使pH值下降;之后溶氧開始逐漸上升,13.5 h上升到18.72%,20.5 h溶氧為31%,期間pH值也略微上升,可能是產生的某些酸性物質被菌體生長所利用,40 h后pH值基本維持在4.2左右。直接進行放大實驗,BG酶活在72 h達到峰值27.15 IU/mL,同批次搖瓶發酵BG酶活在108 h達到峰值22.86 IU/mL。與搖瓶發酵相比,上罐發酵的酶活提高并不顯著,可能是因為發酵過程中的溶氧和pH值不合適所致[19]。不控制溶氧情況下中間有接近4 h溶氧低于10%,溶氧過低可能會產生對酶活造成嚴重影響的代謝物質,同時在過低的pH值條件下,BG酶活較不穩定,這些因素可能導致BG酶活偏低。
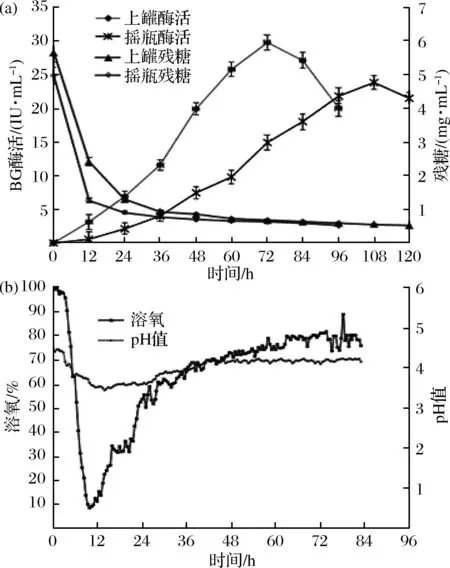
a-殘糖和BG酶活曲線;b-上罐過程中溶氧和pH值變化曲線圖7 搖瓶發酵與上罐發酵比較Fig.7 Comparison of fermentation process in shake flask and 10 L tank
在此基礎上,發酵過程中控制溶氧在30%左右,pH值控制在4.8左右,同時考慮到發酵后期發酵液中還原糖含量僅有0.5 mg/mL,因此在發酵24 h后通過往發酵液中補充質量分數為20%的淀粉水解液并控制其補料速率,使殘糖含量維持在1.2 mg/mL左右。其結果如圖8所示,BG酶活在84 h達到峰值41.62 IU/mL,與未調控的實驗組相比酶活提高了53.3%。

a-殘糖和BG酶活曲線;b-上罐過程中溶氧和pH值變化曲線圖8 最優條件下10L發酵罐放大實驗Fig.8 Fermentation tank amplification culture under optimum conditions
3 討論
本論文所使用出發菌株匍枝根霉誘變株TZ-03的BG酶活較原菌提高了1.52倍。誘變后bgl4基因的轉錄水平較初始提高90.19%,轉錄水平的提高可導致蛋白表達量的提高,很可能引起BG酶活的提高。對BGL和BGL IV的結構功能研究時發現,誘變后活性中心發生構象變化,一定程度上解決了原中心存在的受力不均、底物堆積等問題,可能對酶活的提高也有一定的促進作用。這些發現可為后續對BG結構功能改造及纖維素酶系組成優化提供一定的思路。為進一步提高BG酶活,對搖瓶發酵培養基組分、10 L發酵罐發酵參數進行優化,最終使BG酶活在84 h可達峰值41.62 IU/mL,為BG的工業化應用奠定了一定的基礎。本文對誘變后BG酶活差異內因進行初步分析并通過發酵優化提高了BG酶活,為后續對BG的研究提供一定的方向。

