乳酸菌性質與抑制變異鏈球菌生物膜能力的相關性分析
姚沛琳,徐禮生,蘇博,高貴珍
(宿州學院 生物與食品工程學院,安徽 宿州,234000)
齲病是發病率高、流行范圍廣的口腔疾病。微生物是齲病發生的最主要因素,其中變異鏈球菌是公認的致齲菌,原理是在牙面定植并形成牙菌斑生物膜[1]。牙菌斑生物膜是細菌在口腔中生存、代謝、致病的微生態環境,以生物膜狀態存在的細菌的生理特性與浮游狀態有顯著的不同,主要表現在抗藥性和各種生化代謝效率均顯著高于浮游狀態下的細菌[2-3]。
目前控制齲病的方法主要有機械法[4]和藥物法[5],但它們都有明顯的不足之處。以益生菌為主的細菌替代療法越來越受到關注。主要集中于探討益生菌與口腔微生物相互作用的生物化學性質,如生長抑制、細菌素的產生、共聚能力、生物膜的形成、胞外多糖的產生、對牙齒硬組織的黏附等[6]。篩選能夠預防齲病的益生菌也是基于上述理論基礎。NASE等[7]給1~6歲的兒童持續7個月服用含有益生菌的牛乳,發現能顯著降低口腔中變形鏈球菌和酵母菌的數量,蛀牙的發生率也明顯下降。AHOLA等[8]在研究短期食用含有LactobacillusrhamnosusGG和L.rhamnosusLC 705益生菌奶酪時,也發現益生菌可以減少口腔中齲齒病原菌的數量。TANZER等[9]研究發現,副干酪乳桿菌DSMZ16671與12株致齲性變異鏈球菌均有共聚能力,但與口腔中其他非致齲性的鏈球菌共聚能力較低,并對滅活后的副干酪乳桿菌DSMZ16671進行了動物實驗,實驗組動物齲齒的發生率與對照組相比降低了23%。同時發現副干酪乳桿菌DSMZ16671對唾液包被的羥基磷灰石的黏附能力極低,間接表明應用在口腔中的乳酸菌應該具有低黏附性能。KANG等[10]發現,來源于兒童唾液的2株食寇魏斯氏菌CMS1和CMS3能夠顯著抑制變異鏈球菌生物膜的形成,并且它們合成的水溶性葡聚糖也能夠抑制變異鏈球菌生物膜的形成。TAHMOURESPOUR等[11]發現,發酵乳桿菌產生的表面活性劑能夠抑制變異鏈球菌生物膜的形成,主要是由于該表面活性劑能夠抑制生物膜狀態下變異鏈球菌葡糖基轉移酶gifB/C的基因表達,從而減少水溶性和水不溶性葡聚糖的合成。
變異鏈球菌在口腔中形成生物膜是導致齲齒的第一步,因此在篩選對齲病有預防作用的乳酸菌方面,越來越多的研究者利用生物膜模型進行篩選,但是在篩選標準方面,更多的是根據乳酸菌的某一種性質,并沒做全面考慮,因此有必要確定比較全面的篩選標準來指導篩選工作。
1 材料方法
1.1 實驗菌株
變異鏈球菌(Streptococcusmutans)ATCC25175,中國微生物所菌種保藏中心。
乳酸菌來源:從唾液、泡菜、健康成人糞便、內蒙古奶酪、莧菜梗鹵汁等處分離。
1.2 設備及試劑
SX-300高壓滅菌鍋,TOMY公司; GRP-9160隔水式恒溫培養箱,上海森信實驗儀器有限公司;5415R和5804R冷凍離心機,Eppendorf公司;MΜLTISKAN GO酶標儀,Thermo公司;LSM 710激光共聚焦顯微鏡,德國蔡司公司;DG250厭氧培養箱,華粵行儀器有限公司。
MRS培養基,TSB培養基購于青島海博生物技術有限公司。
主要試劑:溶菌酶、PI染料,Sigma公司;CFSE熒光染料,Invitrogen公司;醋酸氯己定溶液(商品名:洗必泰),北京麥迪海藥業有限責任公司。
1.3 乳酸菌對變異鏈球菌的抑菌性實驗
采用牛津杯瓊脂擴散法[12]。將活化3代的乳酸菌接種到MRS液體培養基,37 ℃培養20 h,在4 ℃和12 000 r/min下離心20 min,取上清液,調pH值至4.0,經0.22 μm微孔濾膜后,收集濾液得到乳酸菌無細胞發酵上清液。取0.1 mL的1×108CFU/mL的S.mutans菌懸液與TSB固體培養基混合均勻,倒入內徑一致且水平放置的培養皿中,凝固后用鑷子將無菌的牛津杯(內徑為6 mm)輕輕、均勻地放置在培養皿中。取0.2 mL乳酸菌無細胞發酵上清液加入到牛津杯中,將此平板正面靜置于37 ℃培養48 h,測量抑菌圈大小。選取MRS液體培養基(pH值調整為4.0)作為陰性對照,醋酸氯己定溶液作為陽性對照。
1.4 乳酸菌對變異鏈球菌生物膜形成的影響
乳酸菌與S.mutans均過夜培養12 h,分別接種于37 ℃預熱的新鮮MRS和TSB培養基中,37 ℃,厭氧培養18 h,然后調節菌濃度約為1×105CFU/mL。在直徑6 cm的玻璃培養皿中放入18 mm×18 mm規格的無菌蓋玻片,在0 h時加入S.mutans菌懸液1 mL、乳酸菌菌懸液0.2 mL和含有質量濃度為2.5 g/L蔗糖的TSB培養基3 mL ,37 ℃厭氧培養24 h。取出玻璃片,PBS沖洗2次,去除表面浮游細菌,立即于室溫下暗箱中染色[13]。用熒光染料CFSE和PI分別對活菌和死菌進行染色。在37℃下孵育30 min,避光,最后用PBS洗滌,除去殘留染料。將上述已完成熒光染料的變異鏈球菌生物膜標本放置在CLSM下觀察[14]。生物膜中細菌量的變化和生物膜活性分別用細菌總面積減少率和活菌百分比表示:即細菌總面積減少率/%=(實驗組-對照組)/對照組×100,生物膜活性/%=生物膜中活菌面積/生物膜中細菌總面積×100。陰性對照組和陽性對照組分別加入等量的生理鹽水和醋酸氯己定溶液。每組3個以上平行樣品,重復2次實驗。
1.5 乳酸菌菌體性質與抑制效果關系的分析
1.5.1 乳酸菌的自聚集能力與抑制效果關系的研究
乳酸菌活化培養后,取一定量的菌液,3 000 r/min離心15 min,棄上清,收集菌體,用pH值為7.0的PBS洗滌2次,重懸浮于PBS中,調OD600=0.6±0.05,菌濃度約為107~108CFU/mL,37 ℃靜置培養,測定不同時間下上層液體的OD600吸光值[15]。其中A0代表0 h的吸光值;At代表th的吸光值。

1.5.2 乳酸菌自身生物膜形成能力與抑制效果關系的研究
參照KHAN等[13]的方法,具體如下:乳酸菌過夜培養,接種于37 ℃預熱的含有質量濃度為2.5 g/L蔗糖的改良TSB培養基中,厭氧培養18 h,調節菌濃度為1×105CFU/mL,然后取0.2 mL菌懸液加入到96孔板中。37 ℃培養24 h,棄游離細菌,每孔用0.2 mL的去離子水輕柔洗滌3次;自然干燥后每孔加入0.05 mL 10 g/L的結晶紫溶液,室溫下染色15 min,使結合的細菌著色;傾去染色液后,用去離子水洗滌3次以上;干燥后每孔加入0.2 mL乙醇/丙酮混合液顯色,酶標儀600 nm測定吸光度。以相同條件下S.mutans生物膜形成能力為對照組,各實驗組每次做3個以上平行,重復3次。
1.5.3 乳酸菌和浮游的變異鏈球菌的共聚能力與抑制效果關系的研究
乳酸菌和S.mutans均過夜培養12 h,然后各取一定量的菌液,3 000 r/min離心15min,棄上清,收集菌體,用pH值為7.0的PBS洗滌2次,重懸浮于PBS中,乳酸菌調節為OD600=0.6±0.05,S.mutans調節為OD600=0.5±0.05,此時這2株菌的濃度均約為107~108CFU/mL。等量的乳酸菌和S.mutans混合,充分振蕩2 min,37 ℃靜置培養,測定不同時間下上層液體的OD600吸光值。其中Ax為0 h乳酸菌的吸光值,Ay為0 h變異鏈球菌的吸光值,Amix為th后混合的吸光值[15]。

1.5.4 乳酸菌表面疏水性與抑制效果關系的研究
乳酸菌表面疏水性的測定參考SAMOT等[16]的方法并稍有改變。以二甲苯作為疏水性有機溶劑。乳酸菌菌體在5 000 r/min的轉速下,離心15 min,洗滌2次,重懸于0.1 mol/L KNO3(pH值為6.2)中,在600 nm下調吸光度為0.6,記為A0;將1 mL有機溶劑加入到3 mL菌液中,在室溫下先預培養10 min,之后振蕩2 min,再在室溫下培養20 min,吸取并測水相在600 nm下的吸光度,記為A1。

1.5.5 乳酸菌表面酸堿電荷與抑制效果關系的研究
選擇乙酸乙酯作為路易斯堿,氯仿作為路易斯酸,按照1.5.4的方法測定。
2 結果
2.1 乳酸菌的抑菌性與抑制變異鏈球菌生物膜間相關性分析
根據前期抑菌實驗的研究結果,隨機選擇抑菌效果有差異,來源不同的乳酸菌,通過比較各實驗組生物膜中細菌總面積較對照組的減少率來判斷不同的乳酸菌抑制變異鏈球菌生物膜形成的效果。由圖1可見,乳酸菌的抑菌性與其對變異鏈球菌生物膜形成的抑制效果間并不呈正相關關系,相反如RS4、RS7、17A這些抑菌效果表現差的菌株,其對生物膜形成的抑制效果表現較好;如PC-M8、LGG、La-137這些抑菌效果表現好的菌株,其對生物膜形成的抑制效果表現較差。

圖1 乳酸菌抑菌性與其抑制生物膜形成效果間的相關性Fig.1 The relation between LAB antibacterial activity and inhibiting biofilm formation ability
在變異鏈球菌生物膜形成階段,乳酸菌與變異鏈球菌的相互作用比較復雜,乳酸菌可能會產生抑制,也可能與變異鏈球菌發生共聚,共聚體可能一起黏附在固體表面,此種情況會加速有害生物膜的形成;也可能不黏附在固體表面,而是排出體外,這種是最理想的情況,圖1顯示乳酸菌對變異鏈球菌生物膜的抑制能力并不會隨著對變異鏈球菌抑菌能力的增強而增強,進一步揭示了變異鏈球菌生物膜形成的復雜性。
2.2 乳酸菌的菌體性質與抑制變異鏈球菌生物膜間相關性分析
2.2.1 乳酸菌的自聚集能力與抑制效果關系的分析
為了方便分析乳酸菌的菌體性質與抑制效果之間的關系,根據2.1所示,分別從好、中、差3個水平中隨機選取了10株(即RS4、FB-T9、LY-103、WT-143、YH-145、PC-T4、La-137、PC-M8、La、LGG)對S.mutans生物膜形成影響有差異的乳酸菌來研究。結果如圖2所示。
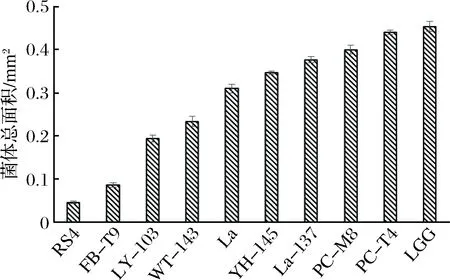
圖2 乳酸菌對變異鏈球菌生物膜形成的影響Fig.2 Effect of LAB on S. mutans biofilm formation
本實驗測定了各乳酸菌在37 ℃下第2小時和第4小時的自聚集能力,從圖3可以看出,大部分乳酸菌都表現出較強的自聚能力,并且均隨著時間的增加而增加。結合抑制生物膜的效果(見圖2),可以看出,除了RS4這株菌外,自聚集能力較強的其他菌株,如PC-M8,PC-T4,LGG,La3137等在抑制變異鏈球菌生物膜形成能力上,效果均較差。
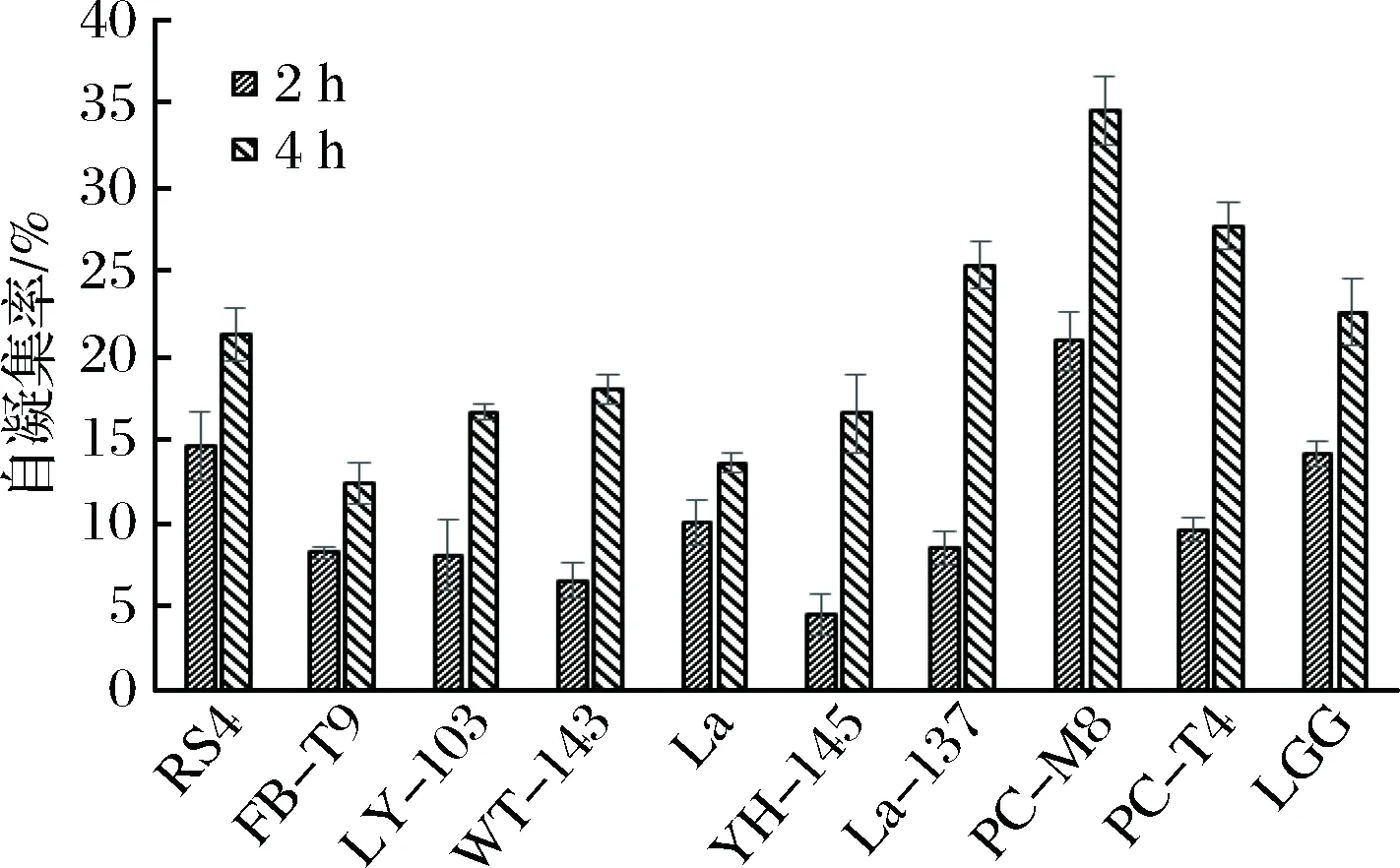
圖3 乳酸菌的自聚能力Fig.3 Auto-aggregation ability of LAB
2.2.2 乳酸菌自身生物膜形成能力與抑制效果關系的分析
結合抑制生物膜的結果(見圖2)與乳酸菌自身生物膜形成能力(見圖4)的結果,可以看出,RS4、FB-T9、LY-103、WT-143和La自身生物膜形成能力較低,其抑制S.mutans生物膜形成效果也較好,同樣,YH-145、PC-T4、PC-M8、LGG和La-137自身生物膜形成能力較強,其抑制S.mutans生物膜形成效果也較差。說明乳酸菌自身生物膜形成能力與抑制S.mutans生物膜形成效果之間呈負相關,即自身生物膜形成能力越小,抑制S.mutans生物膜形成效果越好。

圖4 乳酸菌自身生物膜形成能力的評價Fig.4 The ability of LAB biofilm formation
2.2.3 乳酸菌和浮游的變異鏈球菌的共聚能力與抑制效果關系的分析
從圖5可以看出,實驗中所用到的10株乳酸菌均與浮游的S.mutans有一定的交互凝集能力,并且隨著時間的增加而增加。在2 h時彼此之間的差距不是很大,但4 h時差距開始拉大。結合抑制生物膜的效果(見圖2)可以看出,除了RS4這株菌外,其他菌株基本上表現出共聚能力強,抑制效果差的特點。出現這種現象的原因有可能是RS4在與浮游的S.mutans共聚時,掩蓋了S.mutans與固體介質的黏附位點,其自身又不易黏附在固體介質上,所以可以攜帶S.mutans一起排出口腔。

圖5 乳酸菌與變異鏈球菌的共聚集情況Fig.5 Co-aggregation of LAB and S. mutans
2.2.4 乳酸菌的表面性質與抑制效果關系的分析
從圖6可以看出,這10株乳酸菌的疏水性差別較大,在5%~70%間浮動。然而結合抑制生物膜的效果(見圖2)發現,乳酸菌的表面疏水性與抑制效果之間并不具有規律性。這個研究結果與SAMOT等[16]的并不相符合,他們研究發現13株能夠在羥基磷灰石片上形成生物膜的乳酸菌,其中有10株具有較低的表面疏水性(0~35%),并把這一性質作為篩選口腔益生菌的標準之一。而本研究的觀點是具有預防齲病潛力的乳酸菌應該具有較低的生物膜形成能力,較高的疏水性,這樣可以確保乳酸菌不在牙齒表面大量聚集,同時可以保證一定數量的乳酸菌黏附在口腔粘膜上發揮作用。結合乳酸菌自身生物膜形成能力的結果(見圖4),同樣可以發現RS4這株乳酸菌更符合該要求。

圖6 乳酸菌的表面疏水性分析Fig.6 The surface hydroxyapatite of LAB
從圖7可以看出,這10株乳酸菌的表面酸電荷差別較大,在16%~70%之間浮動。而表面堿電荷普遍較低,多數在10%以下,只有RS4較高,達到了67%。
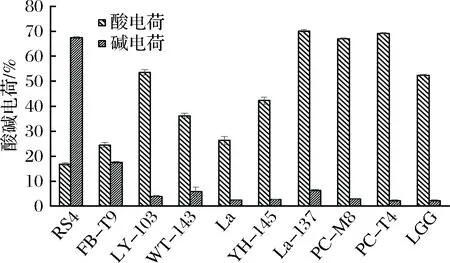
圖7 乳酸菌的表面酸堿電荷Fig.7 The surface acid-base charge of LAB
結合抑制生物膜的效果(見圖2),可以看出,像RS4、FB-T9、WT-143、La這些有著較低的酸電荷和較高的堿電荷的菌株,它們與變異鏈球菌相互作用時,能夠抑制變異鏈球菌生物膜的形成。與之相對的,PC-M8、PC-T4、LGG、La-137有著較高的酸電荷和較低的堿電荷,它們與變異鏈球菌相互作用時,能夠促進更加緊密的生物膜結構的形成。因此可以得出的相關性規律是較高的酸電荷和較低的堿電荷有助于抑制效果的發揮。
3 討論
之前多是單純研究乳酸菌對非生物膜狀態下的變異鏈球菌的抑制作用,評價指標也較單一,即抑菌效果好的乳酸菌就被認為有預防齲病的潛力[17]。但是齲齒的發生與致齲性牙菌斑生物膜有著密切的關系,抑菌效果好的乳酸菌是否也會對處在生物膜狀態下的變異鏈球菌有同樣的作用效果,目前還沒有相關的報道。本實驗的研究表明乳酸菌的抑菌性與其抑制變異鏈球菌生物膜間沒有相關性,更沒有之前推測的正相關關系。
對于有預防齲病潛力的乳酸菌,一方面希望它具有較高的自聚集能力,這樣有助于其自身在復雜的口腔環境中快速的生存與繁殖;另一方面不希望其以生物膜形式黏附在牙齒表面,因為它們產生的乳酸可能會腐蝕牙釉質,進而對牙齒造成不利影響[18]。本實驗的研究結果表明,除了RS4這株菌外,自聚能力與抑制生物膜效果之間呈負相關。從抑制生物膜的效果上來看,RS4和FB-T9這2株乳酸菌均具有潛在的預防齲病功效,但是RS4表現出較強的自聚集能力,而FB-T9的自聚集能力較弱,說明RS4與FB-T9相比,在口腔中更易生存并且具有快速繁殖的優勢。
乳酸菌與浮游的變異鏈球菌發生交互凝集后,可能有兩種結果,一種結果是聚集體不黏附在牙齒上,隨著吞咽、清潔等動作排出口腔;另外一種結果是聚集體黏附在牙齒上,加速了菌斑生物膜的形成[19]。本實驗的研究結果表明,除了RS4這株菌外,共聚能力與抑制生物膜效果之間呈負相關。
結合乳酸菌自身生物膜形成能力的結果(見圖2~4)可知,自身生物膜形成能力高的菌體,如果同時具有較高的自聚集能力和較高的共聚能力,則會表現出促進變異鏈球菌生物膜形成的結果。反之,自身生物膜形成能力低的菌株,如果在與變異鏈球菌共聚時能掩蓋變異鏈球菌與固體介質的黏附位點,此時較高的自聚集能力和較高的共聚能力就能夠協助乳酸菌抑制變異鏈球菌生物膜的形成。因此在篩選對變異鏈球菌生物膜形成具有抑制作用的乳酸菌時,其自身生物膜形成能力是首先考慮的因素之一。
具有預防齲病功效的乳酸菌,不僅要對牙齒表面有著較低的黏附率,還需在口腔中保持一定的數量,防止其被唾液沖刷吞咽,即要對口腔黏膜具有一定的黏附性[20-21]。菌體對黏膜系統的黏附有2種方式,一種是特異性黏附,另外一種是非特異性黏附[22-23]。特異性黏附是通過特異的黏附因子起作用的,而非特異性黏附主要是通過疏水、氫鍵和靜電等發揮作用的,其中疏水作用和靜電作用起著主要作用[24]。根據上述結果發現RS4這株乳酸菌表面疏水性較高,表面電荷也較多,因此其由疏水相互作用和靜電相互作用的粘膜黏附能力比較強,可能會對口腔內頰面、舌背等具有較好的黏附性。
綜上分析,所測定的這些菌體性質中乳酸菌自身生物膜形成能力與抑制S.mutans生物膜形成的效果之間呈明顯的負相關,而自聚能力和共聚能力與抑制效果的關系受自身生物膜形成能力的影響。因此,乳酸菌自身生物膜形成能力可能在抑制變異鏈球菌生物膜形成過程中發揮著重要作用,乳酸菌較低的生物膜形成能力可以保證其自身較少參與或不參與變異鏈球菌生物膜的形成,不會表現出促進作用。表面疏水性與抑制效果無規律性。表面較高的酸電荷和較低的堿電荷有助于抑制效果的發揮,這一性質可能有助于乳酸菌與變異鏈球菌表面某種黏附位點的結合,從而抑制變異鏈球菌對固體表面的黏附。因此可以看出,在抑制變異鏈球菌生物膜形成的過程中,乳酸菌的菌體性質間是綜合起作用。本文為篩選具有預防齲病潛力的乳酸菌提供了理論依據。

