潰瘍性結腸炎相關信號通路的研究進展
唐 苗,盧 倩,劉 衡,3,何 苗,3,郭 強,趙 昱,3,張成桂,3
(大理大學 1. 云南省昆蟲生物醫藥研發重點實驗室、2. 藥用特種昆蟲開發國家地方聯合工程研究中心、3. 中國西南藥用昆蟲及蛛形類資源開發利用2011協同創新中心,云南 大理 671000;4. 云南省第一人民醫院消化內科,云南 昆明 650032)
潰瘍性結腸炎(ulcerative colitis, UC)是一種主要累及直腸、結腸黏膜和黏膜下層的慢性非特異性炎性腸病,臨床表現為腹痛、腹瀉、黏液膿血便等。UC的發生、發展是一個多基因參與、多因素相互作用的復雜生物學過程[1]。近年來,通過細胞信號轉導通路的深入研究,越來越多關于UC的致病機制被發現,其中影響UC的信號通路主要有JAK/STAT、TGF-β/Smad、PI3K/Akt、Wnt、MAPKs、Notch、NF-κB等。這些細胞信號轉導通路中相關元件有可能成為潛在的治療靶點。因此,本文參考國內外文獻,就UC相關的信號通路進行綜述,以期提高科研工作者對UC發病機制的認識,并為UC治療及抗UC新藥研發提供思路。
1 JAK/STAT信號轉導通路
1.1JAK/STAT信號通路的組成和調控酪氨酸激酶(Janus kinase, JAK)信號轉導子與轉錄激活子(signal transducers and activators of transcription, STAT)信號通路(即JAK/STAT信號通路),主要由酪氨酸相關受體、JAK/ STAT、酪氨酸激酶偶聯酪氨酸相關受體的胞內段3部分組成,其是眾多細胞因子信號轉導的共同途徑,在免疫防御、細胞的分化、增殖、凋亡以及腫瘤的發生等生理、病理反應中發揮重要作用。
JAK激酶家族包括4種非受體酪氨酸激酶:JAK1、JAK2、JAK3、TYK2。JAK1、JAK2和TYK2廣泛存在于各種組織及細胞中,而JAK3僅存在于骨髓和淋巴系統中。研究表明[2],細胞因子與JAK之間并不存在一一對應關系,即一種細胞因子可以激活多種胞內JAK,或多種細胞因子同時激活相同JAK發揮生物學效應。STATs是一種DNA結合蛋白家族,它們是JAK的底物,可與酪氨酸磷酸化信號通路偶聯,從而發揮轉錄調控作用,介導多種生物學效應。目前,哺乳動物中已發現的STAT家族有STAT1-4、STAT5a、STAT5b、STAT6,分布于不同類型的組織和細胞中。STAT家族成員不僅具有如氨基端結構域(NH2)、DNA結合結構域(DBD)、SH2結構域(Src homology 2 domain)等保守的功能結構域,還有決定STAT因子特異性的不同的C-末端轉錄激活結構域(TAD),這些結構使STATs可以和各種不同的轉錄調節相關聯。JAK/STAT信號通路包括正性、負性兩種調控,正調控除酪氨酸激酶激活STAT蛋白外,還有絲氨酸磷酸化及與其他轉錄因子和細胞蛋白相互作用的蛋白質;負調節所涉及的調節因子較多,除細胞因子信號轉導抑制蛋白(suppressor of cytokine signaling, SOCS)、活化STATs蛋白抑制因子(protein inhibitor of activated STAT, PIAS)、蛋白酪氨酸磷酸酶(protein tyrosine phosphatases, PTPs)這3個主因子外,還有STAT1/3/5 C-端缺失突變體、酪氨酸磷酸化抑制劑AG-490、環腺苷酸(cyclic adenosine monophosphate, cAMP)等負性調節因子的相關報道[3]。
1.2JAK/STAT信號通路與UC趙海梅等[4]發現,經黃芪多糖治療后的結腸炎小鼠結腸黏膜JAK2和STAT6蛋白磷酸化表達明顯下降,而SOCS1和SOCS3的表達明顯升高,推測黃芪多糖治療UC可能是通過抑制JAK/STAT信號活化實現的。牛宏垚等[5]發現,UC患者黏膜中STAT3表達增加,活化增強,且表達和活化均隨內鏡下病變加重逐漸增強,STAT3蛋白可能通過IL-6/JAK/STAT3途徑參與UC的發病過程。趙青春等[6]研究發現,清腸化濕方能抑制LPS與TNF-α誘導的HT-29細胞 JAK2、STAT3的活化,清腸化濕方通過降低IL-6表達,抑制 JAK2、STAT3活化,阻斷結腸炎癥的發展和持續。可見JAK/STAT信號通路在UC的炎癥失調過程中發揮重要作用,JAK抑制劑可作為治療UC的新策略。
2 TGF-β/Smad信號轉導通路
2.1TGF-β/Smad信號通路的組成和調控轉化生長因子β(transforming growth factor β, TGF-β)是一類多功能的多肽類生長因子,參與細胞的生長分化,組織、器官、胚胎的發育以及各類損傷的修復。TGF-β1作為其中最主要的一種多功能抑制性細胞因子,可通過抑制蛋白水解酶的活化、阻滯腸上皮細胞增生,并可通過促進上皮細胞重建修復,下調炎癥反應、維持腸道微環境。Smad蛋白是細胞內的TGF-β受體激酶的底物[7],根據其功能可分為3類:受體調控Smad(R-Smad)、介質共用Smad(Co-Smad)以及抑制性Smad(I-Smad)。TGF-β1可通過活化配體依賴的跨膜絲氨酸蘇氨酸激酶異二聚體復合物(TβRⅠ和TβRⅡ),啟動信號傳導。TGF-β1與異聚體復合物結合,引起TβRⅡ自身磷酸化后,使TβRⅠ磷酸化并活化,活化的TβRⅠ可使Smad2和Smad3磷酸化,磷酸化的Smad2/Smad3與Smad4結合形成復合物,轉錄入核內,然后與其它的轉錄因子如p300/CBP、輔激動劑和輔阻滯劑共同調節目的基因轉錄,抑制促炎癥細胞因子分泌,下調炎癥反應。
2.2TGF-β/Smad信號通路與UC作為介導TGF-β1信號傳導過程中的一種胞內受體,Smad3在TGF-β1介導的T細胞活化和黏膜免疫調節方面有著重要的作用。Smad3基因敲除的小鼠常由于黏膜免疫功能天然缺陷,在出生后1~6個月內死亡,同時胃和腸道可見大量T細胞浸潤以及廣泛的膿腫形成,表明Smad3功能的破壞,可減弱T細胞對TGF-β1介導的生物學功能的反應。TGF-β1作為一種多功能的免疫調節因子[8],具有黏膜免疫作用,能促進UC結腸黏膜修復,亦被證實有抑制腸道巨噬細胞活化的作用,而活化的巨噬細胞可生成iNOS、TNF-α、IL-1β、清道夫受體、基質金屬蛋白酶等,促進炎癥發生、降解細胞外基質和誘導結腸組織損傷。
3 PI3K/Akt信號轉導通路
3.1PI3K/Akt信號通路的組成和調控磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase, PI3K)是細胞內信號的一種脂類第二信使,其在代謝、炎癥、腫瘤等疾病發生中發揮了重要作用。根據PI3K底物和結構的不同,可將其分為三型,其中以一個催化亞單位p110和一個調節亞單位p85組成的Ⅰ型PI3K研究最為廣泛。根據p110所結合的亞基的不同,Ⅰ型PI3K又可分為通過酪氨酸激酶連接受體傳遞信號,引起p110亞基的膜轉位和活化的ⅠA型PI3K,以及通過G蛋白連接受體傳遞信號,引起p110活化的ⅠB型PI3K。與Ⅰ型PI3K相比,Ⅱ型PI3K的最大特點是沒有調節亞基。Ⅲ型PI3K的特點則是除了第二信使功能外,其還在細胞自噬、新合成分泌型蛋白的分選及膜泡轉運中發揮重要作用。Akt是由原癌基因c-akt 編碼的一種絲氨酸/蘇氨酸蛋白激酶,為PI3K的直接靶蛋白。現已知Akt家族成員有Akt1 /PKBα、Akt2 /PKBβ和Akt3 /PKBγ,其中Akt3主要在腦組織和睪丸中高表達,Akt1和Akt2則在人體各組織中均有廣泛表達。Akt1~3受不同的基因編碼調節,但任何一種Akt的完全活化都需要Ser473位點和Thr308位點同時磷酸化,而活化的Akt可激活信號通路中的下游因子,發揮生物調控作用。PI3K-Akt信號通路的激活過程較復雜,PI3K既可以通過與Ras和p110直接結合而激活,又可以通過與連接蛋白或有磷酸化酪氨酸殘基的生長因子受體相互作用,改變二聚體構象而激活。PI3K再通過第二信使PIP3與Akt的PH結構域結合,引起Akt的構象改變,使Ser473和Thr308的磷酸化位點暴露,并磷酸化激活或抑制下游信號分子,從而對細胞的分化、增殖、凋亡等過程進行調節。
3.2PI3K/Akt信號通路與UC方培植等[9]通過1,2-二甲肼(1,2-dimethylhydrazine, DMH)/葡聚糖硫酸鈉(dextran sulfate sodium salt, DSS)復合法,制備潰瘍性結腸炎相關癌變(UCAC)模型鼠,應用Real-time PCR及Western blot技術檢測模型鼠結腸黏膜中p110、p85、p-Akt、mTOR基因及其蛋白表達情況發現,與正常鼠比較,模型鼠結腸黏膜p110、p85基因表達上調,p110、p85、mTOR蛋白表達亦呈上升趨勢,證明PI3K/Akt- mTOR信號通路的過度活化在UCAC中起重要作用。趙海梅等[10]通過對TNBS /乙醇法復制急性UC大鼠模型發現,與正常組相比,模型組大鼠結腸黏膜p-Akt、PI3K表達升高,經黃芪多糖灌胃后,大鼠結腸黏膜中p-Akt和PI3K蛋白的表達明顯低于模型組,證明黃芪多糖可能通過抑制 PI3K/Akt 信號通路發揮治療作用。張濤等[11]研究表明,健脾清熱活血方能通過下調UCAC模型鼠p85、p-Akt基因,以及p85、CDK1蛋白的表達,緩解腸道炎癥,修復腸道黏膜,治療UCAC。
4 Wnt/β-catenin-TCF信號轉導通路
4.1Wnt/β-catenin-TCF信號通路的組成和調控Wnt信號通路主要由細胞外因子Wnt蛋白、跨膜受體Frizzled( Fz)、轉導子β-catenin、核內轉錄因子TCF及其它輔助受體和蛋白組成[12]。該信號通路高度保守,任何成分的改變均可導致信號轉導異常,從而引發炎癥和細胞惡變。當細胞接到Wnt信號刺激時,Wnt蛋白會與Fz受體相結合并使其活化,活化的Fz受體便開始特定G蛋白的募集,并在輔助受體 LRP5/6的協助下,阻止GSK-3對β-catenin的磷酸化(β-catenin磷酸化后會經泛素-蛋白酶途徑被降解)。β-catenin是一種多功能胞質蛋白,在Wnt信號通路中起到最關鍵的樞紐作用,其氨基端具有GSK-3磷酸化位點,羧基端有對應靶基因的活化、轉錄功能,中間區域還有APC蛋白及TCF的結合位點,但其本身不直接與DNA結合,需在進入細胞核后,借助DNA結合蛋白TCF- 4在核內共同調控下游靶基因c-myc和cy-clinD1的轉錄,完成Wnt信號通路的最終調控。
4.2Wnt信號通路與UC沈駿等[13]研究發現,UC患者血漿Wnt9b水平明顯高于正常人,但Wnt9b水平與內鏡下疾病活動情況無相關性,而克羅恩病(Crohn disease, CD)患者血漿Wnt9b與正常人無差異,故血漿Wnt9b水平對UC和CD的鑒別診斷有一定意義。其原因可能包括Wnt9b可以激活自身Wnt信號途徑和T細胞核因子相關級聯反應,故Wnt信號途徑對于UC控制作用是多種途徑協同作用的結果。李素云等[14]在香連片抑制DMH/DSS誘導的UCAC模型鼠癌變機制研究中發現,DKK-1[一種可與低密度脂蛋白受體相關蛋白(low density lipoprotein receptor-related protein, LRP)和穿膜蛋白Kremen結合的分泌蛋白]可通過競爭性結合,減少細胞膜上的LRP,進而阻斷Wnt信號的細胞內傳遞。SABC免疫組化法檢測發現,經香連片治療的小鼠腸組織β-catenin、PCNA蛋白表達明顯低于模型組,同時Real-time PCR檢測顯示,香連片組小鼠DKK-1基因表達上調,故推測香連片抗小鼠潰瘍性結腸炎癌變的作用機制可能與其上調DKK-1的表達,抑制Wnt/β-catenin信號通路有關。
5 MAPKs信號轉導通路
5.1MAPKs信號通路的組成和調控絲裂原活化蛋白激酶(mitogen-activated protein kinase, MAPK)是一類存在于真核細胞中高度保守的信號轉導模塊,是連接細胞內外反應的重要成員,可介導胞外信號刺激傳入胞內,調節生長、分化、遷移、炎癥等細胞過程。在哺乳動物中,MAPKs家族主要分為3類:細胞外信號調節激酶(ERK)、c-Jun氨基末端激酶(JNK)和p38 MAPK激酶。多種胞外刺激因素可激活MAPK通路,包括炎性細胞因子、生長因子、細胞應激等。MAPK信號通路通過ERK、JNK和p38三條級聯反應途徑,活化轉錄因子c-Jun和c-fos,并促使其轉入細胞核形成異二聚體的轉錄激活因子AP-1,調控IL-1、TNF-α、IL-6 等炎性因子的轉錄,導致腸道黏膜炎癥的發生。
5.2MAPKs信號通路與UC何雙艷[15]研究發現,姜黃素可通過抑制p38 MAPK信號通路,減少TNF-α等促炎因子的釋放,減輕小鼠腸黏膜炎癥損傷,發揮治療作用。李姿慧等[16]研究發現,ERK、p38 MAPK信號通路參與了參苓白術散對脾虛濕困型UC大鼠結腸組織AQP3、AQP4蛋白及mRNA表達的調節作用,參苓白術散通過抑制ERK、p38 MAPK信號通路激活,可明顯改善大鼠結腸組織損傷。趙芯梅[17]通過整合基因組學和蛋白組學發現,由磷酸化p38、Galectin-3和MAWBP組成的一個可用于評估UC炎癥程度的復合標志物。MAWBP及其結合蛋白MAWD可激活ERK通路、活化癌基因TPX2,在UC中有抑制炎癥的作用。深入研究UC中MAPK信號及其下游信號轉導通路,可以為減輕腸道炎癥,延緩病程,尋找抗UC的抑制劑提供依據。
6 Notch信號轉導通路
6.1Notch信號通路的組成和調控Notch信號通路被認為是上皮層再生過程中的決定性因素,它不僅能調節腸道上皮細胞增殖、分化,還能維護腸道上皮細胞和保持腸上皮細胞的抗菌活性,有助于腸黏膜修復與再生,并維護內環境穩定。Notch信號可以影響T淋巴細胞的活性和分化,而T淋巴細胞分化過程中炎癥因子的表達失衡可能是UC主要發病機制之一。Notch信號通路主要由Notch受體、Notch配體和DNA結合蛋白3部分組成,已知的Notch受體共有4種類型(Notch1-4)[18],其中Notch-1分布最廣,且主要分布于腸道中,有助于控制T細胞生長。已知的Notch配體共有5種,均可以在TNF-α和γ-分泌酶的作用下,輔助Notch受體向細胞核內轉運,最終Notch受體與轉錄抑制因子RBP-J結合,調節靶基因Hesl(促使腸上皮細胞向吸收細胞系分化)和Hathl(促使腸上皮細胞向分泌細胞系分化)的表達,控制細胞的增殖、分化和凋亡。
6.2Notch信號通路與UC閆曙光等[19]表明,經TNBS/乙醇灌腸誘導的UC大鼠結腸上皮細胞中,Notch-1、Hesl-1 mRNA表達明顯上調,Math-1mRNA表達明顯下調。經烏梅丸灌胃后,UC大鼠結腸上皮細胞Notch-1、Hesl-1 mRNA表達明顯下調,Math-1mRNA表達上調,提示烏梅丸可以通過調節Notch信號通路,調控結腸上皮細胞的增殖、分化,發揮對UC的治療作用。張晶晶[20]方青黛顆粒和美沙拉嗪能明顯下調UC大鼠結腸組織中Hes-1的表達,上調Math-1的水平,證明復方青黛顆粒改善UC大鼠腸道病理變化可能與調節Notch信號通路,下游靶基因Hes-1和Math-1有關。
7 NF-κB信號轉導通路
7.1NF-κB信號通路的組成和調控NF-κB是由Rel/NF-κB家族的多肽成員構成的一組轉錄因子,其廣泛存在于各類組織細胞中,在不同類型或不同生存狀態的組織細胞中,僅在活性方面存在差異。哺乳動物Rel/NF-κB家族包括NF-κB1、NF-κB2、Rel(亦稱c-Rel)、RelA和RelB五個成員,它們都擁有一個約300個氨基酸組成的高度保守的Rel同源區(稱為RHR),主要負責NF-κB與DNA結合形成二聚體和行使核定位序列功能。能激活NF-κB的主要刺激因子包括生長因子、炎性細胞因子、免疫受體、神經毒素、細菌、病毒及其產物和某些理化因素等。正常狀態下,NF-κB通常與其抑制蛋白IκB相結合[21],以非活性形式貯存在細胞質中,當在有效刺激發生時,NF-κB激活信號可激活IκB激酶(IKK),IKK可誘導IκB發生磷酸化并降解釋放,從而去除IκB對NF-κB的抑制作用,使NF-κB活化,并促進下游基因的轉錄和表達,在機體免疫、組織炎癥、細胞的生存、增殖、分化、凋亡等方面發揮調控作用。
7.2NF-κB信號通路與UC戴高中等[22]研究表明,白頭翁湯加減灌腸和柳氮磺胺吡啶(SASP)保留灌腸均能有效緩解急性期左半結腸型UC患者的癥狀,RT-PCR結果顯示,兩組患者腸黏膜細胞NF-κB mRNA表達均較用藥前明顯下降,證明該藥可能通過下調NF-κB mRNA表達并抑制促炎因子的釋放,發揮治療作用。趙增強[23]研究表明,UC大鼠結腸組織中NF-κB p65、IκB-α、TLR4 mRNA及蛋白表達水平均明顯升高,半夏瀉心湯可下調腸組織NF-κB信號通路中NF-κB p65、IκB-α、TLR4 mRNA及蛋白表達,發揮對UC的治療作用。
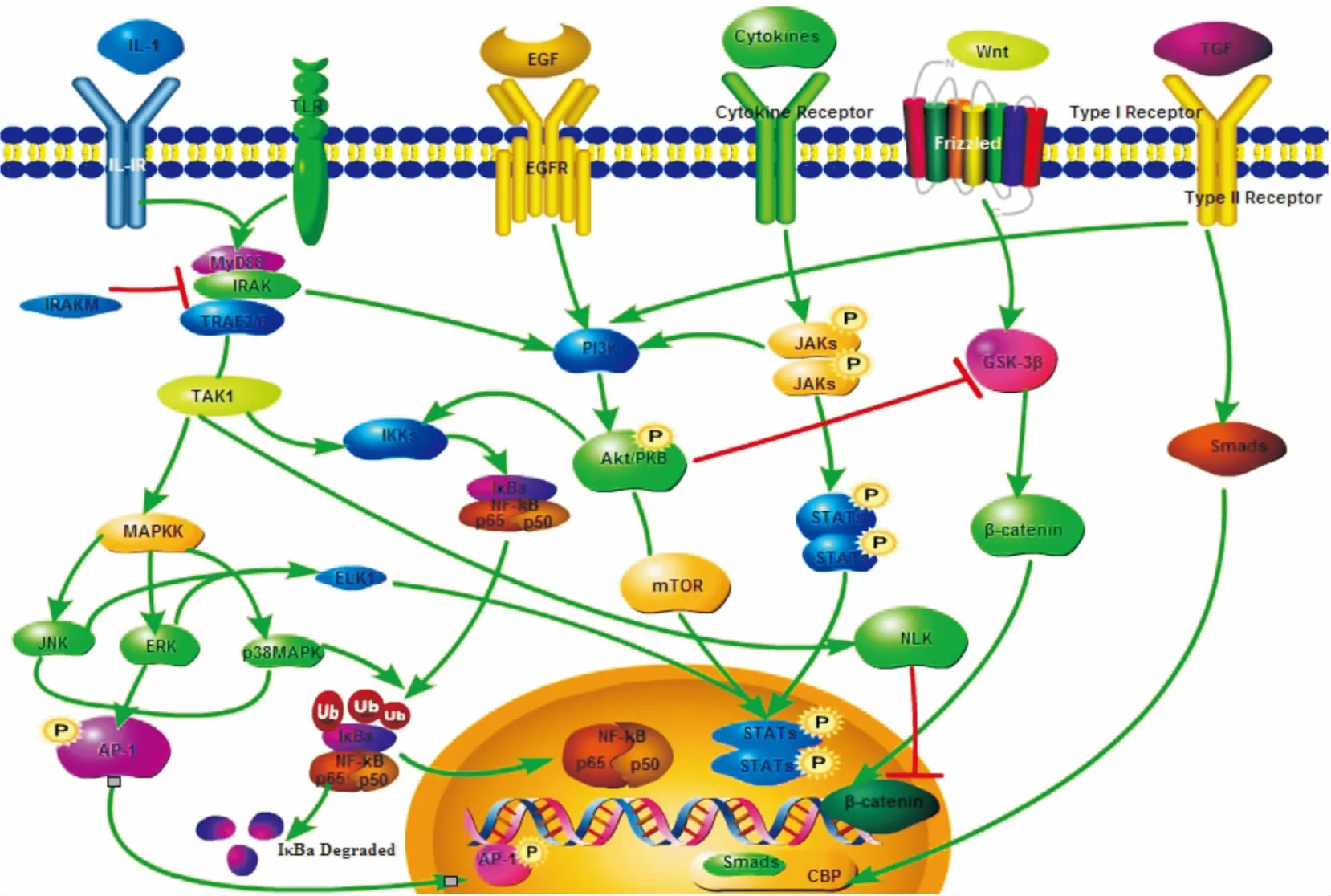
Fig 1 Ulcerative colitis-related signaling pathways
8 展望
UC病程長、易復發、難治愈,目前應用于臨床的一線藥物主要為5-氨基水楊酸類(美沙拉嗪、柳氮磺吡啶等)和糖皮質激素類藥物(醋酸潑尼松、醋酸地塞米松)等,但研究表明[24],上述藥物主要通過抑制NF-κB和TGF-β兩條信號通路發揮抗UC作用,且上述藥物均存在停藥后易復發、長期使用毒副作用大的問題。近年來,逐漸興起的抗巨噬細胞移動抑制因子(MIF)單抗和抗TNF-α單抗等單克隆抗體類藥物雖療效較好,但存在僅作用于NF-κB信號通路的局限性、費用昂貴等缺點。因此,尋找多信號通路、多靶點聯合治療方式是未來治療UC的必然趨勢。
中醫藥是我國傳統文化的瑰寶之一,中醫藥治療UC過程中涉及JAK/STAT、TGF-β/Smad、PI3K-Akt-mTOR、Wnt/β-catenin-TCF、MAPKs、Notch、NF-κB等多條信號通路,且各信號通路間存在相互作用,其在UC病理機制中的相互關系見Fig 1。按照中藥特性將其組合成治療UC的復方中藥,可通過調控多條信號通路發揮療效,并展現出多靶點、多環節、多系統綜合平衡調節的特點[25]。由此可見,在UC的預防和綜合治療中,傳統中醫藥較西醫藥有療效明顯、復發率低、毒副作用小的應用優勢。另有報道,腸道菌群的失衡影響UC病變程度,多數西藥在治療過程中還會影響結腸內菌群紊亂,加重病情。若利用中藥復方聯合西藥治療,不但增強療效,其中的中藥物質能增強腸道益生菌活性,抑制致病菌繁殖,加快腸黏膜屏障修復。因此,從信號通路深入研究中藥治療UC的作用機制,發現信號通路中關鍵環節、關鍵因子的特異性阻滯劑,可為抗UC新藥的研發提供新思路。

