毛花苷C促進肝癌細胞Huh-7凋亡并增強caspase-7的活化
張艷群,徐 慶,曾永聯,羅 琴,鄒海凡,譚 寧
(桂林醫學院1.藥學院、2.廣西肝臟損傷與修復分子醫學重點實驗室、3.科學實驗中心,廣西 桂林 541004)
原發性肝癌(hepatocellular carcinoma,HCC)是全球范圍內發病率和死亡率最高的惡性腫瘤之一,全國每年約有38.3萬人死于肝癌,占全球肝癌死亡總人數的51%[1]。目前,醫治HCC仍以手術為主,兼物理療法、化學藥物療法等在內的綜合治療。臨床常用的肝癌化療藥物如蒽環類抗瘤藥等,缺乏高度的組織選擇性,在發揮療效的同時,往往產生較嚴重的全身性毒副作用[2]。因此,如何使化療藥物既提高腫瘤化療效果,又減輕化療藥物的毒副作用,已成為腫瘤藥物治療亟待解決的關鍵問題。
強心苷類(Cardiac glycosides,CGS)是一類從植物中提取的類固醇衍生物,能明顯興奮心肌細胞,目前作為心衰和心房顫動的常用治療藥物。自1960年,相繼有研究發現,洋地黃毒苷、地高辛、哇巴因等強心苷類藥物具有預防和治療腫瘤的作用[3]。Stenkvist等[4]研究表明,乳腺癌患者在使用洋地黃治療后,腫瘤轉變為良性的比例升高,且在乳房切除術5年后,使用洋地黃治療的患者乳腺癌復發率僅為對照組的10.42%。同時,Goldin等[5]在給予127位癌癥患者使用洋地黃治療后,發現21例癌癥死亡中僅有1例屬于洋地黃組。并且CGS能選擇性地抑制腫瘤細胞的增殖,誘導其凋亡,而對正常細胞無明顯影響[6],因而強心苷類化合物被認為是一類新型的抗癌藥物。為了進一步證實CGS抗腫瘤治療的臨床價值,美國FDA正在進行小規模的Ⅰ期和Ⅱ期臨床試驗,結果尚未公布。本實驗采用不同濃度的毛花苷C(lanatoside C)溶液干預肝癌Huh-7細胞,研究毛花苷C對其增殖、凋亡及凋亡相關酶caspase-7活化的影響,初步探討毛花苷C對肝癌的抑制作用,為其臨床應用提供基礎。
1 材料與方法
1.1材料
1.1.1細胞株 肝癌Huh-7細胞株購自中科院上海生物科學研究所細胞資源中心。
1.1.2試劑 毛花苷C(上海旭東海普藥業有限公司,CAS:#17575-22-3),采用嘧啶試劑作溶劑溶解毛花苷C,使其終濃度為20 g·L-1,過濾除菌后,室溫避光存放備用。DMEM高糖培養基(Gibco公司,貨號11885-076);胎牛血清FBS(Corille公司,C1015-05);Cell Counting Kit-8試劑(上海同仁化學研究所,CK04);caspase-7單克隆抗體(12827)購自CST公司;抗β-actin一抗(SC-47778)購自Santa Cruz公司;Annexin V-FITC/PI凋亡試劑盒(上海東仁化學科技,AD10)。
1.1.3儀器 Elix3+30L+3YNERGY超純水系統(美國Millipore公司);311氣套式CO2培養箱(美國Thermo公司);Infinite M200 pro Nano Quant光柵型連續波長酶標儀(瑞士TECAN公司);Allegra X-22R冷凍離心機(美國貝克曼庫爾特公司);ChemiDoc XRS+凝膠成像系統(美國Bio-Rad公司);BD FACSAriaⅢ分選型流式細胞儀(美國BD公司);LSM710激光共聚焦掃描顯微鏡(德國蔡司公司)。
1.2方法
1.2.1細胞培養 將Huh-7細胞接種于含支原體抗生素的改良DMEM培養基中,培養于37℃、5% CO2培養箱中,胰蛋白酶常規消化傳代,選擇處于對數生長期的細胞進行實驗。
1.2.2細胞增殖實驗 胰酶室溫常規消化細胞后,用含FBS的DMEM培養基吹打成分布均勻的單細胞懸液,按1×103個/孔接種于96孔板中,培養于37℃、5% CO2培養箱中,細胞貼壁24 h后,加入毛花苷C使其終濃度為0.003 2、0.016、0.08、0.4、2 mg·L-1,以等體積嘧啶作為對照,同一濃度設置3個復孔,分別培養2 h及1、3、5、7 d后,棄去培養基,每孔加入CCK-8溶液100 μL,繼續培養2 h后,使用酶標儀檢測450 nm波長處吸光值。增殖抑制率/%=(對照組A450值-加藥組A450值)/對照組A450值×100%。
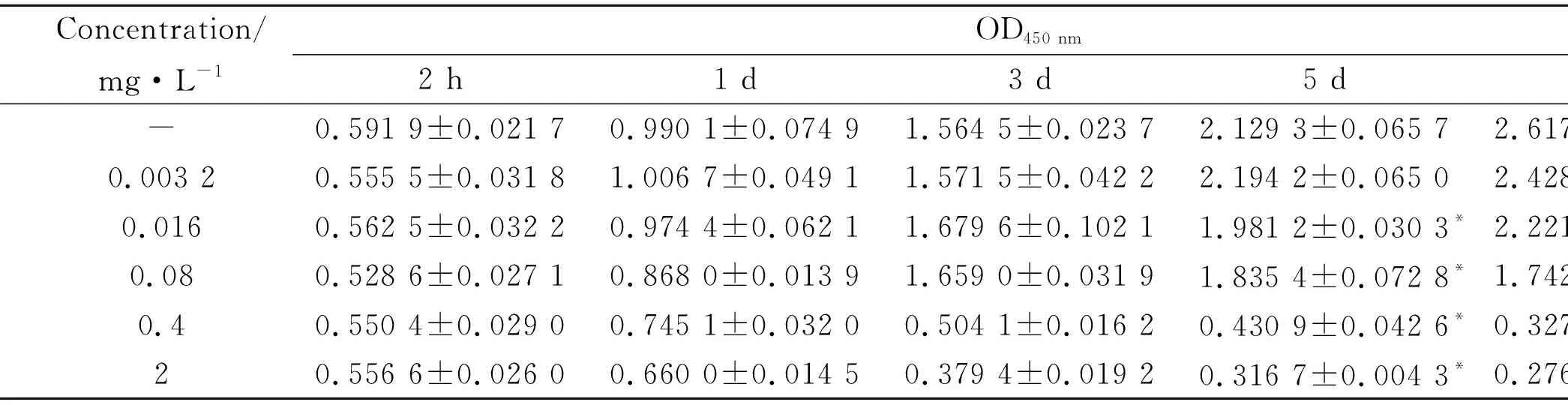
1.2.3克隆形成實驗 胰酶室溫常規消化細胞后,用含FBS的DMEM培養基吹打成分布均勻的單細胞懸液,按1.6×103個/孔接種于6孔板中,繼續培養于恒溫培養箱中。培養10 d后加毛花苷C,使其終濃度為0.003 2、0.016、0.08、0.4、2 mg·L-1,以等體積嘧啶代替毛花苷C作為對照組,同一濃度設置3個復孔,再繼續培養6 d后棄去上層培養基,PBS輕柔洗板2次,細胞用4%多聚甲醛固定15 min,棄多聚甲醛,結晶紫溶液染色15 min,清水反復浸洗,室溫晾干,采集圖像保存后,每孔加入2 mL 10%的冰醋酸溶液溶解結晶紫,每孔再取100 μL置于96孔板中,使用酶標儀檢測各孔560 nm波長處吸光度值,并按以下公式計算克隆抑制率[7]。克隆抑制率/%=(對照組A560值-加藥組A560值)/對照組A560值×100%。
1.2.4細胞凋亡檢測 取處于對數期的Huh-7細胞,以1×106個細胞接種于培養皿,培養24 h細胞貼壁后,加入毛花苷C,使其終濃度為0.003 2、2 mg·L-1,加等體積嘧啶作為對照組。待毛花苷C作用48 h后,消化細胞,收集細胞懸液并離心,棄上清,D-PBS重懸清洗1次,離心棄上清液,1×Annexin V Binding buffer重懸細胞,并吹打混勻,加入10 μL Annexin V/FITC和10 μL PI染色液(20 mg·L-1),避光染色30 min。300目篩網過濾細胞懸液,使用流式細胞儀測定并采集數據[8]。并通過激光共聚焦顯微鏡采集加入毛花苷C 48 h后,以及相應對照組Annexin V/FITC及PI染色圖像,FITC檢測波長為510~550 nm。
1.2.5Western blot檢測 將Huh-7細胞室溫消化后接種于培養皿中,24 h貼壁后,加入毛花苷C,使其終濃度為0.003 2、0.016、0.08、0.4、2 mg·L-1,加等體積嘧啶作為對照組,作用48 h后收集細胞,采用RIPA裂解細胞提取細胞總蛋白,用BCA蛋白定量試劑盒測定蛋白質濃度,再在蛋白樣品中加入上樣緩沖液混勻后,95℃金屬浴10 min,冰上放置10 min后,保存于-20℃冰箱備用。采用SDS-PAGE凝膠電泳分離總蛋白樣品,轉移至NC膜上,5%脫脂奶粉(TBST配制)室溫搖床封閉1.5 h,4℃孵育一抗過夜,TBST洗膜5次,每次10 min,室溫孵育二抗1.5 h,TBST洗膜5次,每次5 min,與ECL發光液反應2~3 min后,X線片曝光、顯影、定影,采用Gel-Pro Analyzer圖像分析系統計算分析X線片吸光度值。
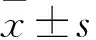
2 結果
2.1毛花苷C抑制Huh-7細胞增殖Tab 1的CCK-8實驗結果顯示,在加入毛花苷C后3 d,可發現毛花苷C對Huh-7細胞增殖的抑制作用隨著藥物濃度的增加而明顯增強。加藥5 d時,Huh-7細胞生長抑制率分別為(3.86±1.45)%、(8.64±1.43)%、(14.11±4.87)%、(79.72±2.23)%、(84.27±0.04)%。其中,0.003 2 mg·L-1毛花苷C組與對照組相比,無明顯差異(P>0.05);0.016、0.08、0.4、2 mg·L-1毛花苷C組與相應對照組相比,呈現明顯差異(P<0.05)。
2.2毛花苷C抑制Huh-7細胞克隆形成Fig 1的克隆形成實驗結果顯示,毛花苷C對Huh-7細胞克隆形成具有明顯的抑制作用(P<0.05),隨著毛花苷C濃度增高,Huh-7細胞克隆抑制率隨之增大。0.003 2、0.016、0.08、0.4、2 mg·L-1的毛花苷C干預Huh-7細胞10 d后,克隆抑制率分別為(3.29±2.84)%、(19.41±2.66)%、(56.08±3.66)%、(69.03±1.81)%、(65.02±1.12)%。其中,0.003 2 mg·L-1毛花苷C組與對照組相比無明顯差異(P>0.05),0.016、0.08、0.4、2 mg·L-1毛花苷C組較對照組表現出明顯差異(P<0.05)。
2.3毛花苷C促進Huh-7細胞凋亡取對數生長期的Huh-7細胞,給予不同濃度的毛花苷C培養48 h后,離心收集細胞,以Annexin-V/PI雙重染色后,使用流式細胞儀分析。如Fig 2A、2B所示,2 mg·L-1毛花苷C組與對照組晚期凋亡細胞(Q2)分別為(12.03±1.09)%、(6.97±0.25)%,早期凋亡細胞(Q4)分別為(7.63±0.61)%、(1.50±0.14)%,差異明顯(P<0.01)。通過激光共聚焦顯微鏡觀察(Fig 2C),發現2 mg·L-1毛花苷C組Annexin-V染色(綠色熒光)高于對照組。
Tab 1 Lanatoside C inhibited hepatocellular Huh-7 cell proliferation
*P<0.05vscontrol
Fig 1 Lanatoside C inhibited hepatocellularA:Different concentrations of lanatoside C inhibited clonal proliferation of Huh-7 cells; B: Comparison of different concentrations of lanatoside C inhibiting Huh-7 cell clonal formation(A560 nm).*P<0.05,**P<0.01 vs control.
2.4毛花苷C促進Huh-7細胞凋亡蛋白caspase-7的活化不同濃度毛花苷C干預Huh-7細胞48 h后,Fig 3蛋白免疫印跡結果顯示,毛花苷C可以明顯促進Huh-7細胞caspase-7蛋白從35 ku全長蛋白形式,活化為18 ku活性蛋白形式,對照組caspase-7蛋白并未出現明顯活化。
3 討論
2000年,Haux等[9]對9 271例使用洋地黃治療的患者進行分析,雖未發現該化合物具有明顯的抗癌作用,但血藥濃度高能降低患白血病和尿道癌風險,為強心苷的抗癌作用研究提供了基礎,現已有上千篇報道強心苷類化合物體外抗癌特性的論文發表。
強心苷類物質抗癌機制包括抑制Na+/K+-ATP酶活性、抑制缺氧誘導因子1活性、抑制成纖維細胞因子2(fibroblast growth factor-2, FGF-2)和NFκB、抑制拓撲異構酶的活性、阻斷ER、誘導細胞凋亡等[10]。而化療藥物引起癌細胞死亡的關鍵機制為誘導細胞凋亡,caspase是參與細胞凋亡的主要蛋白酶。Badr等[11]在人惡性膠質瘤細胞研究發現,毛花苷C可激活caspase蛋白的表達,從而誘導其發生凋亡。Caspase最初以酶原存在于細胞中,當起始凋亡蛋白酶如caspase-8、caspase-9通過低聚反應而激活時,進一步激活caspase-3、caspase-6、caspase-7等效應凋亡蛋白酶,從而導致與凋亡表型相關的一系列生物化學及形態學變化[12]。
Caspase可通過外源性途徑及線粒體內源性途徑激活[13],當FasL與腫瘤壞死因子(tumor necrosis factor,TNF)分別與細胞膜上的死亡受體Fas及腫瘤壞死因子受體TNFR發生特異性結合,隨即引發死亡誘導信號復合體(death-inducing signaling complex,DISC)的形成,DISC募集caspase-8,并促進下游的caspase酶原激活。而內源性途徑則是由各種細胞內外應激如癌基因的活化、DNA損傷、細胞缺氧等引起[14]。在內源性凋亡途徑中,激活后線粒體外膜通透性增加,從而使細胞色素C及其他促凋亡因子由線粒體向胞質釋放,這一過程主要受Bcl-2蛋白家族調控。Bcl-2蛋白家族的Bak、Bax等激活后,與線粒體外膜受體結合,在線粒體膜上形成孔道,使線粒體內部一些大分子蛋白如Smac/DIAB-LO、HtrA家族成員Omi/HtrA2以及細胞色素C由孔道釋放到細胞質中,細胞色素 C上存在caspase活化因子1(Apaf-1)特異性結合位點,Apaf-1與之反應后,誘導別構效應而激活[15],Apaf-1上具有與caspase-9同源的caspase募集與激活結合域(caspase raised and activating domain,CRAD),活化的Apaf-1能夠以CARD-CARD方式聚集并活化caspase-9,形成由細胞色素C、Apaf-1、caspase-9組成的凋亡小體,該凋亡小體可激活caspase-7,進而誘導下游蛋白的降解,最終引起細胞凋亡。在本實驗中,采用不同濃度的毛花苷C干預肝癌Huh-7細胞,結果顯示,毛花苷C能明顯抑制Huh-7細胞增殖,促進Huh-7細胞凋亡,增強caspase-7的活化水平。提示毛花苷C誘導細胞Huh-7發生凋亡可能與細胞內源性凋亡途徑有關,具體作用機制尚不明確,需要進一步實驗進行證實。
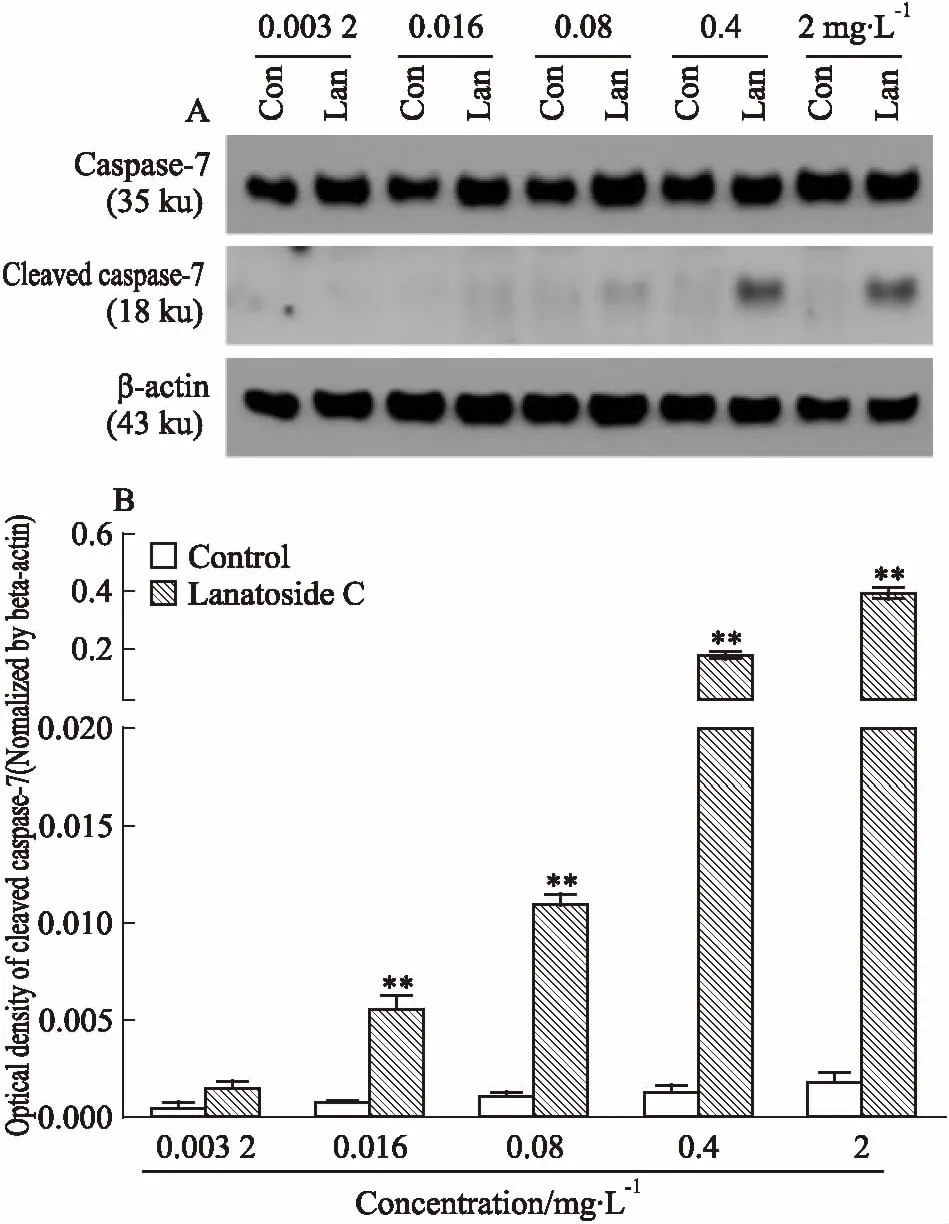
Fig 3 Lanatoside C up-regulated activationof caspase-7 in Huh-7
(致謝:本實驗在桂林醫學院科學實驗中心完成,感謝對本課題研究給予幫助的老師和同學。)

