MiR-186-5p通過靶向調控RAB2A在乳腺癌細胞阿霉素耐藥性中的逆轉作用機制
孫玉國,王照巖,楊玉玲,楊志一,尹崇高,李洪利
(濰坊醫學院1. 附屬醫院藥學部、2. 病理學教研室、3. 護理學院、4. 醫學研究實驗中心,山東 濰坊 261053)
盡管近年來臨床預防篩查和治療乳腺癌的技術已獲得長足發展,乳腺癌患者預后也有明顯改善,然而,耐藥性仍是乳腺癌治療過程中不可避免的問題[1],如阿霉素耐藥、順鉑耐藥等。阿霉素是臨床常見的化療藥之一,且越來越多的研究表明,阿霉素耐藥與微小RNA(microRNAs,miRNAs)的異常表達密切相關[2]。miRNAs作為一類調控序列,可結合mRNA序列的3′非翻譯區(3′UTR),以此調控癌細胞的耐藥增殖,如過表達miR-210抑制胰腺癌的增殖,且可通過靶基因ABCC5逆轉吉西他濱的耐藥[3]。miR-101通過抑制膠質母細胞瘤糖原合成酶激酶3β(glycogen synthase kinase 3β,GSK-3β)表達,逆轉替莫唑胺的耐藥[4]。但是關于miR-186-5p在乳腺癌細胞阿霉素耐藥性中的作用機制研究尚未見報道。本文對阿霉素耐藥株MCF-7/ADR及MCF-7細胞進行共轉染,檢測miR-186-5p、RAB2A對耐藥增殖的影響,進一步經LY294002處理后,檢測p-Akt308、p-Akt473及Akt的變化,以此闡述miR-186-5p、RAB2A在乳腺癌細胞阿霉素耐藥性中的作用機制。
1 材料與方法
1.1材料
1.1.1細胞株 人乳腺癌細胞株MCF-7購自ATCC。
1.1.2藥物與試劑 阿霉素由濰坊醫學院附屬醫院提供(海正輝瑞制藥有限公司,批準文號:國藥準字H33021980);Mir-XTMmiRNA qRT-PCR SYBR?Kit、SYBR?Green I染料,均購自TaKaRa公司;RIPA裂解液、CCK-8,購自索萊寶公司;PI3K抑制劑LY294002,購自北京碧云天公司;鼠抗人β-actin單克隆抗體、兔抗人RAB2A多克隆抗體、兔抗人p-Akt473多克隆抗體、兔抗人p-Akt308多克隆抗體,均購自Abcam公司;胎牛血清和MEM培養基購自美國Hyclone。
1.1.3儀器 ABI7500熒光定量PCR儀(美國ABI公司);電泳儀、轉膜儀(美國Bio-Rad公司);CO2培養箱(Thermo公司),酶標儀(Bio-Tek公司)。
1.2方法
1.2.1細胞培養及轉染 按照文獻[5,6],MCF-7、MCF-7/ADR細胞均在含10% FBS的MEM培養基、5% CO2、37℃培養箱培養,其中MCF-7/ADR細胞另外添加1.0 mg·L-1的阿霉素以維持其耐藥性,實驗前48 h不再添加阿霉素。細胞轉染采用Lipofectamine 2000,具體步驟參照操作說明書。參照文獻[9],細胞轉染及共轉染分組:① MCF-7組:常規培養,不做處理;② anti-NC/MCF-7組:轉入敲除miR-186-5p的對照質粒;③ anti-miR-186-5P/MCF-7組:轉入敲除miR-186-5p質粒;④ MCF-7/ADR組:MCF-7/ADR細胞常規培養,不做處理;⑤ NC組:將過表達miR-186-5p的對照質粒轉入MCF-7/ADR細胞;⑥ miR-186-5p組:將過表達miR-186-5p質粒轉入MCF-7/ADR細胞;⑦ miR-186-5p+Con組:MCF-7/ADR中同時轉入過表達miR-186-5p質粒和過表達RAB2A質粒的對照質粒Con;⑧ miR-186-5p+RAB2A組:MCF-7/ADR中同時轉入過表達miR-186-5p質粒和過表達RAB2A質粒;⑨ Scr+anti-miR-186-5p組:MCF-7中轉入敲除RAB2A的對照質粒和敲除miR-186-5p的質粒;⑩ SiRAB2A+anti-miR-186-5p組:MCF-7中轉入敲除RAB2A質粒和敲除miR-186-5p質粒。
1.2.2雙熒光素酶實驗 將RAB2A的3′-UTR的野生型(pGL3-RAB2A-3′UTR)和突變型(pGL3-RAB2A- 3′UTR-mut)分別與對照質粒NC、過表達miR-186-5p質粒、對照質粒anti-NC、anti-miR-186-5p質粒進行共轉染處理。具體實驗步驟參照文獻[7]。
1.2.3qRT-PCR 用TRIzol法提取各組乳腺癌細胞的總RNA。用莖環法和普通逆轉錄法分別對miR-186-5p和RAB2A進行逆轉錄,獲得第一鏈cDNA后,分別用Mir-XTMmiRNA qRT-PCR SYBR?Kit和SYBR?Green I染料進行qRT-PCR,miR-186-5p以U6為內參,RAB2A以β-actin為內參。反應條件及miR-186-5p的莖環序列、引物序列均參照文獻[8]。RAB2A上游引物:5′-ACATCATAATCGGCGACACAGGTG-3′,下游引物:5′ -CATTCGAGCACCGAACTCTACACC-3′。
1.2.4Western blot MCF-7、MCF-7/ADR細胞及轉染后的細胞,用RIPA裂解液裂解后進行蛋白抽提,接著進行分離膠濃度為12%的SDS-PAGE電泳,轉膜,5%脫脂奶粉封閉,一抗4℃孵育過夜,d 2 TBST洗膜,孵育二抗,再次洗膜后,加ECL曝光。一抗稀釋度:RAB2A(1 ∶1 000)、p-Akt308(1 ∶500)、p-Akt473(1 ∶500)、Akt(1 ∶1 000)、β-actin(1 ∶1 000)。
1.2.5CCK-8細胞增殖實驗 取各組細胞2×103個,接種于96孔板中。貼壁培養24 h后,向每孔加入10 μL CCK-8溶液。將培養板在培養箱內孵育4 h,用酶標儀測定在450 nm的吸光度值。以此分別測定MCF、MCF-7/ADR細胞在轉染以及共轉染后24、48、72、96 h細胞增殖能力的變化。
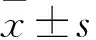
2 結果
2.1RAB2A與miR-186-5p靶向結合通過Targetscan和miRNAMap預測軟件,得出RAB2A與miR-186-5p存在靶向結合位點,我們采用雙熒光素酶實驗,檢測RAB2A與miR-186-5p在乳腺癌阿霉素耐藥株MCF-7/ADR中是否存在結合及調控相互關系。Fig 1結果顯示,miR-186-5p可特異性地結合于RAB2A的3′UTR。
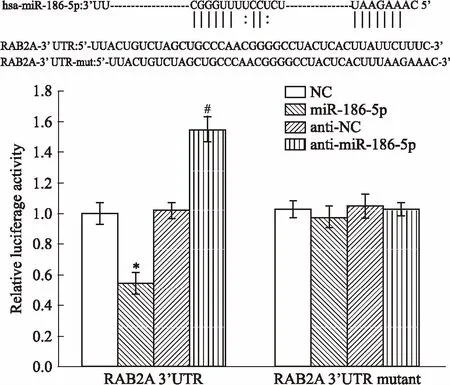
Fig 1 RAB2A, a direct target of
2.2miR-186-5p、RAB2A在各組乳腺癌細胞中表達采用qRT-PCR分別檢測miR-186-5p、RAB2A在乳腺癌細胞株MCF-7、MCF-7/ADR中mRNA的表達情況,同時,通過Western blot檢測RAB2A的蛋白表達水平。Fig 2結果顯示,與MCF-7細胞相比,MCF-7/ADR中miR-186-5p的表達水平明顯降低(P<0.05),RAB2A的mRNA表達沒有明顯變化(P>0.05),而RAB2A的蛋白表達水平明顯升高(P<0.05)。
2.3過表達miR-186-5p抑制乳腺癌細胞的增殖為檢測miR-186-5p對乳腺癌細胞耐藥和增殖的影響,我們通過轉染使MCF-7/ADR中的miR-186-5p高表達,敲低MCF-7中的miR-186-5p,CCK-8法檢測細胞增殖能力的變化。Fig 3結果顯示,轉染72 h后,與MCF-7/ADR及NC組細胞相比,miR-186-5p組細胞的增殖能力明顯降低(P<0.05);與MCF-7及anti-NC組細胞相比,anti-miR-186-5p組細胞的增殖能力明顯增加(P<0.05)。
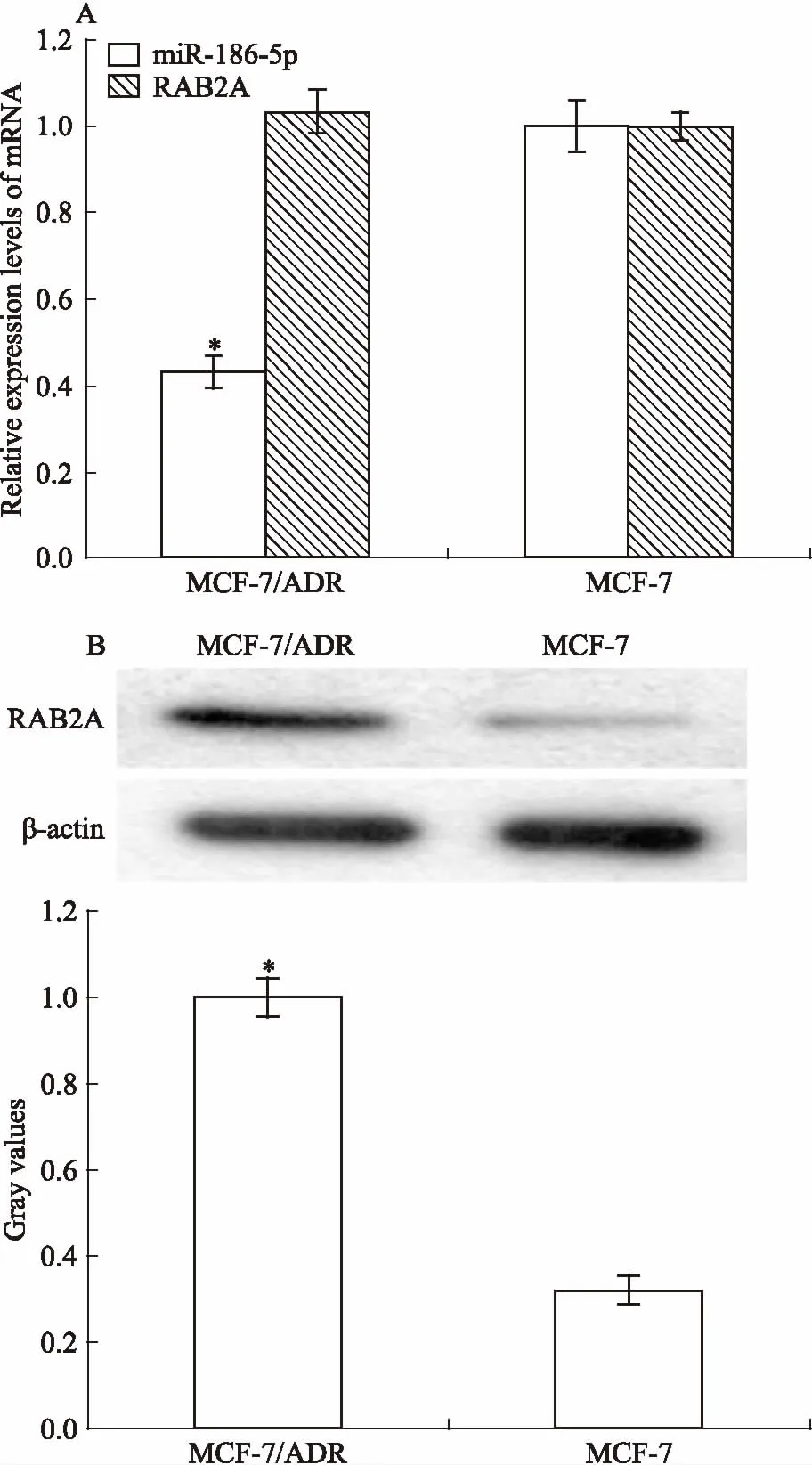
Fig 2 Expression levels of miR-186-5p and
2.4miR-186-5p負向調控乳腺癌細胞中RAB2A的表達Western blot檢測miR-186-5p對乳腺癌細胞中RAB2A的影響。如Fig 4所示,過表達MCF-7/ADR中的miR-186-5p及敲低MCF-7中的miR-186-5p后,與NC組細胞相比,miR-186-5p組細胞中RAB2A的表達明顯降低;與anti-NC組細胞相比,anti-miR-186-5p組細胞中RAB2A的表達明顯增加(P<0.05)。
2.5過表達RAB2A逆轉miR-186-5p抑制乳腺癌細胞增殖的能力為進一步檢測miR-186-5p是否通過作用于RAB2A,影響乳腺癌細胞的增殖,采用CCK-8檢測共轉染后RAB2A、miR-186-5p對乳腺癌細胞增殖能力的影響。如Fig 5所示,共轉染72 h后,與miR-186-5p+Con組細胞相比,miR-186-5p+RAB2A組細胞的增殖能力明顯增加(P<0.05);與miR-186-5p+Scr組細胞相比,miR-186-5p+SiRAB2A組細胞的增殖能力明顯降低(P<0.05)。
Fig 3 Influence of miR-186-5p on cell proliferation in
2.6miR-186-5p負向調控RAB2A經PI3K/Akt信號通路逆轉乳腺癌細胞的阿霉素耐藥和增殖為檢測miR-186-5p是否通過負向調控RAB2A,經PI3K/Akt信號通路逆轉乳腺癌細胞的阿霉素耐藥和增殖,終濃度為20 μmol·L-1的 PI3K抑制劑LY294002添加到共轉染后的各組細胞,Western blot檢測p-Akt308、p-Akt473的表達水平。如Fig 6所示,在LY294002處理下,與miR-186-5p+Con組細胞相比,miR-186-5p+RAB2A組細胞的p-Akt308、p-Akt473的表達水平明顯增加(P<0.05),Akt的表達水平沒有明顯變化;與miR-186-5p+Scr組細胞相比,miR-186-5p+SiRAB2A組細胞的p-Akt308、p-Akt473表達水平明顯降低(P<0.05),Akt的表達沒有明顯變化。
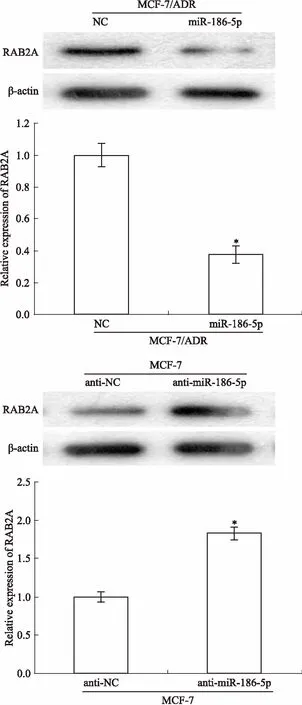
Western blot was employed to assess the expression of RAB2A in breast cancer cells after over-expression of miR-186-5p in MCF-7/ADR cells and suppression of miR-186-5p in MCF-7cells.*P<0.05 vs NC or anti-NC
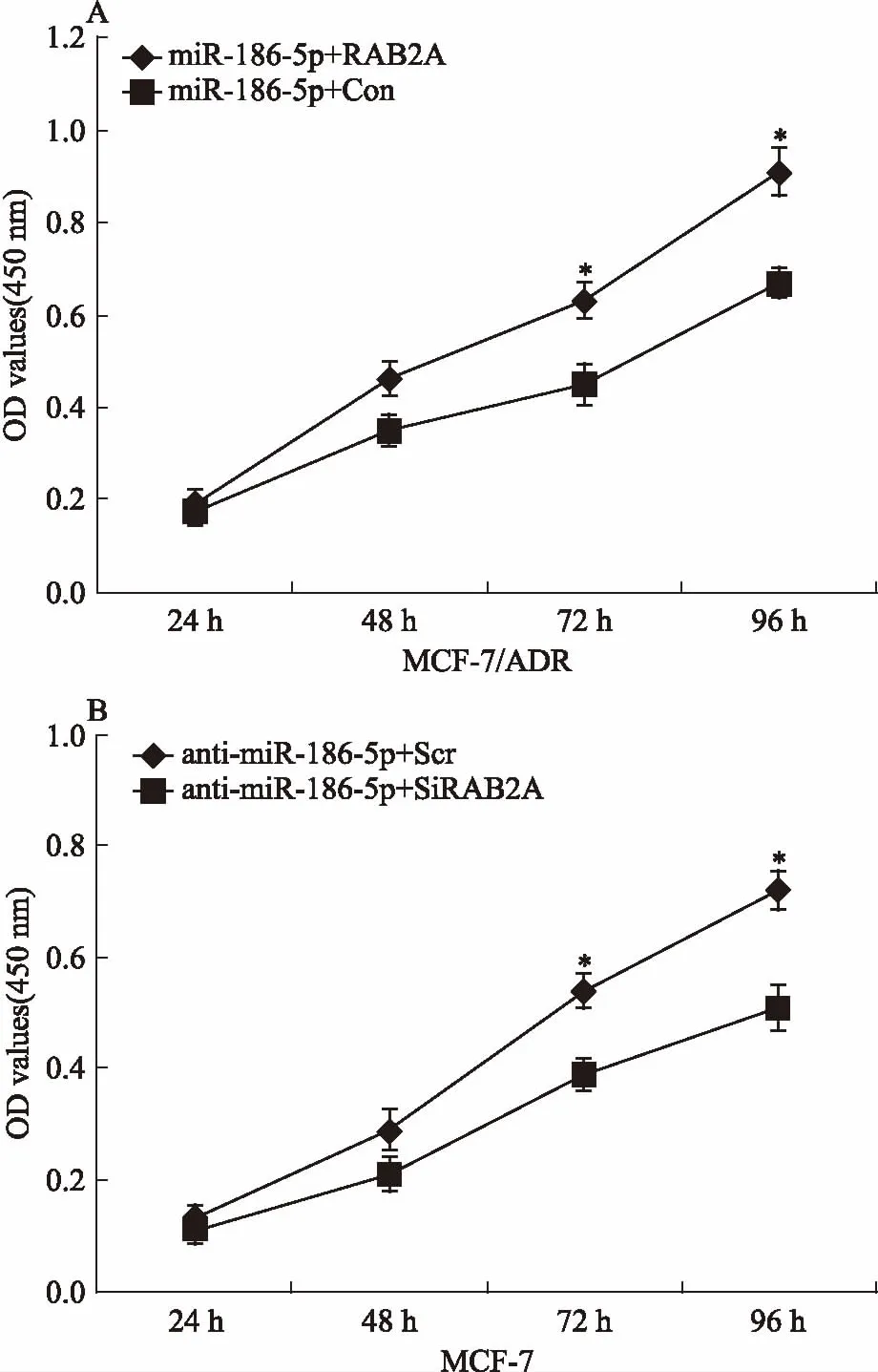
Fig 5 Over-expressed RAB2A restored reduction of
3 討論
乳腺癌是女性常見的惡性腫瘤,且化療是治療乳腺癌的常規手段。然而,多藥耐藥是導致化療失敗的主要障礙[9]。因此,研究乳腺癌的多藥耐藥機制將為臨床治療乳腺癌提供新的治療靶點和途徑,以期提高患者的預后。
RAB2A是小GTPase家族中的一員,參與囊泡轉運、內質網的回收及運動。研究發現,RAB2A與Rab27a通過雙效應物Noc2,協同調控成熟顆粒向胞外的運輸。Dey等[10]發現,S100A7可激活RAB2A介導的MAPK信號通路,影響口腔鱗狀細胞癌細胞的運動、侵襲。此外,Luo等[11]發現,RAB2A激活ERK信號通路,促進乳腺癌干細胞和腫瘤的發生。本實驗通過雙熒光素酶和Western blot實驗,首次證實miR-186-5p在阿霉素耐藥株MCF-7/ADR中存在RAB2A的結合位點,且RAB2A表達水平受miR-186-5p調控。
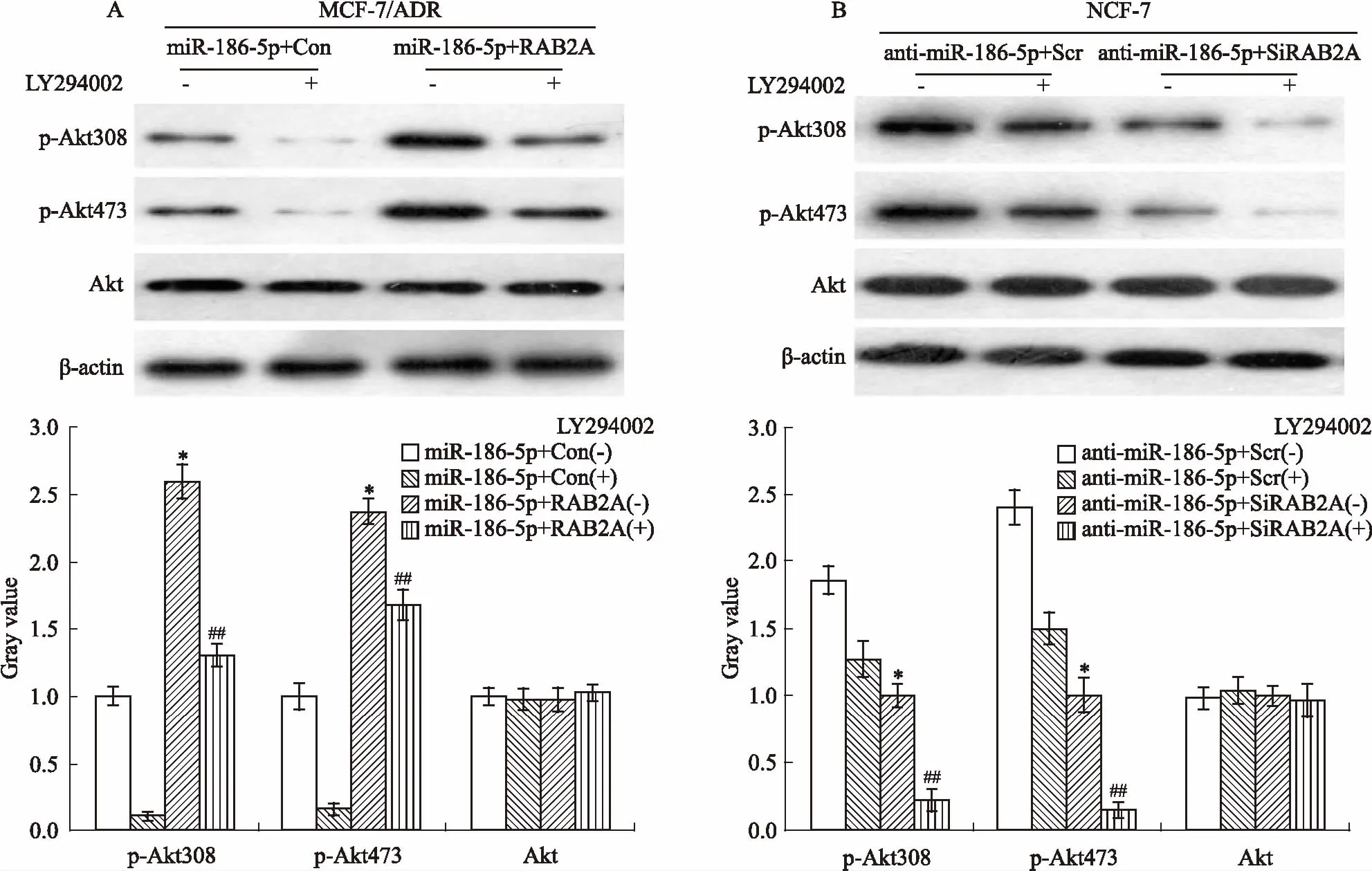
Fig 6 Over-expressed RAB2A restored effects of p-Akt308,p-Akt 473 by
近年來,大量研究表明miRNAs的失調與多藥耐藥存在密切關系。先前文獻表明,miR-186可靶向結合ABCB1和調節GST-π的表達,誘導卵巢癌細胞對紫杉醇、順鉑的耐藥性[12]。同時,miR-186經對Twist1的調控,逆轉卵巢癌細胞的順鉑耐藥[13]。Ye等[14]發現,miR-186調控微管相關蛋白tau(microtubule-associated proteins tau,MAPT)的表達,進而調節非小細胞肺癌的化學耐藥性。近來發現,TUG1經miR-186/CPEB2介導結直腸癌的甲氨蝶呤耐藥[15]。本課題組先前研究發現,miR-186-5p靶向調控PTTG1,抑制非小細胞肺癌的侵襲、轉移[8]。但是,關于miR-186-5p在乳腺癌阿霉素耐藥和增殖中的作用尚未見報道。本實驗發現,阿霉素耐藥株MCF-7/ADR中miR-186-5p低表達,過表達miR-186-5p后明顯抑制增殖。過表達RAB2A后明顯逆轉了miR-186-5p對增殖的影響,同時,經LY294002處理后,Western blot結果顯示,RAB2A明顯逆轉了miR-186-5p對p-Akt308、p-Akt473的影響。此外,我們在MCF-7細胞中獲得相同的結論。
綜上所述,miR-186-5p負向調控RAB2A,經PI3K/Akt信號通路逆轉乳腺癌細胞的阿霉素耐藥和增殖,過表達RAB2A逆轉了miR-186-5p對耐藥和增殖的影響。為臨床治療阿霉素耐藥的乳腺癌患者提供新的治療靶點和理論支撐,以便提出更有效的治療策略。

