替米沙坦通過降低Chemerin表達減輕2型糖尿病小鼠腎臟炎癥反應
施子祿, 鄭丹丹, 黃秋虹, 張素萍, 黃 倩
(1. 福建醫科大學附屬泉州第一醫院腎內科,福建 泉州 362000;2. 泉州醫學高等專科學校基礎醫學部生理學教研室,福建 泉州 362100;3. 浙江大學基礎醫學院生理系,浙江 杭州 310058)
糖尿病腎病(diabetic nephropathy,DN)作為糖尿病患者最常見的微血管并發癥之一,由于其后期并發的腎衰竭最終增加患者死亡率而備受關注。研究發現,DN形成過程復雜,涉及多種病理機制,如腎素-血管緊張素系統(renin-angiotensin system,RAS)過度激活、氧化應激損傷、慢性炎癥、凋亡、腎臟纖維化等[1-3],其中慢性炎癥是重要環節之一。DN患者體內炎癥信號被激活,直接或間接引起腎臟組織損傷,加速DN的進展。
糖尿病狀態下,循環RAS被抑制,腎臟RAS被激活,而腎臟RAS的激活是導致終末期腎衰竭的核心因素[4]。血管緊張素II(angiotensin II,Ang II)是RAS系統的重要成員,其在糖尿病誘導的臟器損傷中發揮重要作用。替米沙坦(telmisartan)為新型的Ang II受體1(AT1)拮抗劑,通過阻斷Ang II與AT1受體的結合而廣泛應用于心腦血管疾病的治療[5]。Chemerin是2007年發現的一種由脂肪細胞分泌的細胞因子,具有促進炎癥細胞聚集,參與慢性炎癥反應,調節脂肪細胞分化,參與糖代謝,增強脂肪組織胰島素敏感性等多種功能[6]。研究發現,同為沙坦類藥物的厄貝沙坦,可能通過抑制RAS系統的活化、減少腎臟局部Ang II的生成,從而對糖尿病大鼠腎臟起確切的保護作用[6]。現已知,替米沙坦成功減輕了db/db小鼠心肌組織炎癥反應[7],但能否減輕2型糖尿病(type 2 diabetes mellitus,T2DM)小鼠腎臟炎癥損傷發揮腎臟保護作用,目前國內外尚無相關報道。本研究通過構建T2DM小鼠模型,探討替米沙坦對T2DM小鼠腎臟炎癥反應的影響,并從Chemerin角度探討其腎臟保護機制。
1 材料與方法
1.1實驗動物健康成年♂C57BL/6小鼠,8周齡,清潔級,購自上海斯萊克實驗動物有限公司,實驗動物許可證號:SCXK滬2007-0005。標準條件飼養,自由進食、飲水,適宜溫度、濕度,黑暗和光照各12 h。
1.2試劑鏈脲佐菌素(streptozotocin,STZ)(美國Sigma公司,批號:S0130);替米沙坦(美國Sigma公司,批號:T8949);普通飼料與高脂飲食購自北京華埠康公司;小鼠Ang II酶聯免疫(enzyme linked immunosorbent assay,ELISA)試劑盒(上海基免實業有限公司,批號:BIO-JM-1314);小鼠白細胞介素1β(interleukin-1β,IL-1β)、小鼠白細胞介素6(interleukin-6,IL-6)、小鼠腫瘤壞死因子α(tumor necrosis factor α,TNF-α)ELISA試劑盒,均購自北京安迪華泰科技有限公司,批號分別為M0627、M0111、M0314;Chemerin蛋白抗體(批號:ab203040)、β-actin抗體(批號:ab8227)均購自Abcam公司;HRP標記的山羊抗兔IgG抗體(上海碧云天生物技術有限公司,批號:A0208)。
1.3儀器石蠟切片機(德國Leica公司);XR210全自動生化分析儀(廣東中山新銳醫療設備科技有限公司);5810R高速冷凍式離心機(德國Eppendorf公司);UVmini-1240紫外可見分光光度計(日本島津國際貿易上海有限公司);垂直電泳儀(美國Bio-Rad公司);Tanon 3500全自動數碼凝膠成像分析系統(上海天能科技有限公司)。
1.4方法
1.4.1糖尿病小鼠模型的建立及分組 40只小鼠適應性喂養1周后,隨機分成2組:正常對照組10只和T2DM模型組30只。正常對照組小鼠接受普通飼料(66.5%碳水化合物、4.5%脂肪、18.9%蛋白質)飼養4周,模型組小鼠接受高脂飲食(40.9%碳水化合物、24.2%脂肪、23.8%蛋白質)飼養4周。4周后,小鼠禁食不禁水12 h,單次腹腔注射STZ(40 mg·kg-1,溶于新鮮配制的0.1 mmol·L-1的無菌檸檬酸-檸檬酸鈉緩沖液中,pH 4.5),繼續高脂飲食飼養,正常對照組小鼠注射等體積檸檬酸-檸檬酸鈉緩沖液,繼續普通飼料飼養。注射STZ 1周后,斷尾取血測空腹血糖(fasting blood-glucose,FBG),2次FBG均≥16.7 mmol·L-1為T2DM造模成功[8],T2DM模型小鼠再隨機分為T2DM組、替米沙坦(1、3 mg·kg-1)組[9],每組10只,連續灌胃給藥8周,正常對照組和T2DM組小鼠僅使用等體積生理鹽水灌胃,8周末無小鼠死亡。
1.4.2FBG、24 h尿微量白蛋白、血清肌酐和尿素氮含量的測定 8周末實驗結束時,每只小鼠置于獨立代謝籠中,禁食6 h后剪尾取血,采用血糖儀檢測FBG;收集24 h尿液,采用全自動生化分析儀測定24 h尿微量白蛋白(microalbuminuria,mAlb)含量;0.8%戊巴比妥鈉(70 mg·kg-1)麻醉小鼠,下腔靜脈取血,制備血清,采用全自動生化分析儀測定血清肌酐(serum creatinine,Scr)和尿素氮(blood urea nitrogen,BUN)含量。
1.4.3腎臟HE染色 取各組小鼠相同部位腎組織,4%多聚甲醛固定,石蠟包埋,切片(3 μm厚),進行HE染色,光鏡下觀察腎臟病理變化。
1.4.4ELISA法檢測腎皮質IL-1β、IL-6、TNF-α的水平 取各組小鼠部分腎皮質進行勻漿,按照各因子ELISA試劑盒的步驟進行檢測。
1.4.5ELISA法檢測腎皮質Ang II的濃度 切取部分冰凍腎皮質進行勻漿,按小鼠Ang II ELISA試劑盒說明書,檢測腎皮質勻漿Ang II的濃度。
1.4.6腎臟免疫組織化學染色 取各組小鼠部分腎皮質固定,脫水,石蠟包埋,脫蠟,按免疫組化試劑盒說明書進行腎皮質Chemerin(1 ∶500)染色,光鏡下觀察腎皮質中Chemerin的分布。
1.4.7Western blot檢測腎皮質Chemerin蛋白的表達 取各組小鼠冰凍腎皮質,按照相應比例加入預冷的組織蛋白裂解液,玻璃勻漿器勻漿,充分裂解,14 000×g離心5 min,取上清,提取腎皮質總蛋白,采用BCA法測定蛋白濃度,SDS-PAGE電泳,電轉移至PVDF膜,分別加入一抗(Chemerin 1 ∶500稀釋,β-actin 1 ∶3 000稀釋),二抗為HRP標記的羊抗兔抗體(1 ∶2 000稀釋),ECL發光、顯影,β-actin為內參對照,以與β-actin的比值作為Chemerin蛋白的相對表達水平。
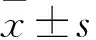
2 結果
2.1替米沙坦對T2DM小鼠生化指標的影響如Tab 1所示,與正常對照組相比,T2DM組小鼠FBG明顯升高(P<0.01),替米沙坦組與T2DM組相比差異無統計學意義(P>0.05)。mAlb、Scr和BUN能夠反映小鼠的腎功能,與正常對照組相比,T2DM組小鼠在飼養8周后,mAlb、Scr和BUN含量均明顯升高(P<0.05或P<0.01),2個劑量替米沙坦干預后均可以明顯降低T2DM小鼠mAlb、Scr和BUN含量(P<0.05或P<0.01),且高劑量替米沙坦的作用優于低劑量替米沙坦(P<0.05)。以上結果提示糖尿病使小鼠腎功能異常,替米沙坦能夠以血糖非依賴的方式改善T2DM小鼠腎功能。

Tab 1 Effect of telmisartan on biochemical characteristics in T2DM n=10)
*P<0.05,**P<0.01vscontrol group;#P<0.05,##P<0.01vsT2DM group;△P<0.05vs1 mg·kg-1telmisartan group
2.2替米沙坦對T2DM小鼠腎臟結構的影響為了觀察替米沙坦對T2DM小鼠腎臟結構的影響,對腎臟切片進行HE染色。如Fig 1所示,光鏡下可見正常對照組小鼠腎組織結構完整,腎小管上皮細胞排列整齊。與正常對照組相比,T2DM組小鼠腎臟組織中腎小管上皮細胞大量變性壞死、脫落,腎小管管腔明顯擴張,間質充血與炎癥細胞浸潤,表明T2DM小鼠腎組織炎癥損傷明顯。替米沙坦干預8周后腎臟病理損傷逐漸改善,主要表現為腎小管上皮細胞腫脹、壞死、脫落程度、炎癥細胞浸潤程度逐漸減輕,且高劑量替米沙坦組效果更明顯。以上結果表明,替米沙坦能夠減輕T2DM小鼠腎臟組織病理損傷。

Fig 1 Effect of telmisartan on morphological pathology of renal tissues in T2DM mice(×200)
2.3替米沙坦對T2DM小鼠腎皮質IL-1β、IL-6、TNF-α水平的影響糖尿病使腎臟內炎性細胞迅速活化,大量表達炎性細胞因子如IL-1β、IL-6、TNF-α等,這些炎性細胞因子加重腎組織損傷,加快糖尿病進程,因此,我們采用ELISA法檢測各組小鼠腎皮質IL-1β、IL-6、TNF-α的水平。如Fig 2所示,與正常對照組相比,T2DM組小鼠腎皮質IL-1β、IL-6、TNF-α水平明顯升高(P<0.05或P<0.01),給予2個劑量替米沙坦干預8周后,腎皮質中IL-1β、IL-6、TNF-α水平明顯降低(P<0.05),2個劑量替米沙坦組間比較無差異。以上結果表明,替米沙坦可以減少T2DM小鼠腎臟炎性因子表達,減輕T2DM小鼠腎臟炎癥損傷。

Fig 2 Effect of telmisartan on IL-1β, IL-6 and TNF-α levels in renal cortex of T2DM n=10)
2.4替米沙坦對T2DM小鼠腎皮質AngII濃度的影響Ang II是RAS系統最重要的組成部分,因此我們檢測了腎皮質中Ang II的濃度。如Fig 3所示,T2DM組小鼠腎皮質中Ang II濃度較對照組升高(P<0.01),2個劑量替米沙坦干預后均可以明顯降低Ang II濃度(P<0.01),且2個劑量替米沙坦組間比較無差異。提示替米沙坦能夠抑制腎臟局部RAS系統。

Fig 3 Effect of telmisartan on Ang II concentration in renal cortex of T2DM n=10)
2.5替米沙坦對T2DM小鼠腎皮質Chemerin蛋白分布的影響為了觀察替米沙坦對T2DM小鼠腎臟炎癥反應的作用,我們對腎臟切片進行Chemerin免疫組化染色。如Fig 4所示,對照組腎小管上皮細胞中Chemerin蛋白少量、散在分布,T2DM組小鼠腎小管上皮細胞中陽性分布明顯增多,以胞質中最明顯,替米沙坦干預后Chemerin蛋白分布逐漸減少。

Fig 4 Telmisartan protein distribution of renal cortex in T2DM mice(×200)
2.6替米沙坦對T2DM小鼠腎皮質Chemerin蛋白表達的影響如Fig 5所示,T2DM小鼠腎皮質Chemerin蛋白表達水平較對照組明顯增加(P<0.05),2個劑量替米沙坦干預后,腎皮質Chemerin表達較T2DM組降低(P<0.05),且2個劑量替米沙坦組間比較無差異。提示替米沙坦能夠改善T2DM引起的小鼠腎皮質Chemerin蛋白的表達增加。

Fig 5 Effect of telmisartan on Chemerin expression in renal cortex of T2DM n=10)
3 討論
DN是T2DM患者常見的慢性并發癥之一,也是終末期腎衰竭的主要病因,其病理機制復雜,涉及多種因素,炎癥反應可能在其中起關鍵作用[3]。研究證實,高糖誘導的腎組織炎癥反應對腎臟損害尤為重要,因此,減輕腎組織炎癥反應有利于改善糖尿病腎臟功能,減緩糖尿病病程進展[10]。
在糖尿病db/db小鼠模型中,替米沙坦同類藥厄貝沙坦的慢性治療能夠抑制心臟RAS系統以及NF-κB的表達,減輕心肌組織炎癥反應[11]。替米沙坦短期治療也可通過抑制眼組織局部的RAS系統,緩解糖尿病誘導的視網膜炎性損傷[12],但對糖尿病引起的腎組織炎癥反應的影響,目前國內外尚未見相關報道。本研究采用高脂飲食聯合STZ構建T2DM,結果顯示,替米沙坦能夠明顯降低T2DM小鼠mAlb、Scr及BUN水平,但FBG水平未下降,提示替米沙坦以血糖非依賴的方式改善T2DM小鼠腎功能。同時,替米沙坦還可改善腎臟病理學變化,減少炎癥細胞浸潤。
糖尿病時,腎組織局部RAS活性明顯上升,而Ang II是RAS系統的重要成員,研究發現Ang II可間接介導一系列炎癥反應,也可直接通過刺激炎性細胞釋放炎癥因子、細胞因子等,引起腎組織慢性炎癥反應而影響DN進展[4]。Mezzano等[13]對10例DN患者進行腎活檢,并采用免疫組化技術檢測Ang II的分布表達,結果在腎小管上皮細胞和間質細胞發現了高表達的Ang II,這些高表達的Ang II通過刺激腎小管上皮細胞,誘導單核細胞趨化蛋白-1等前炎癥介質的產生,從而啟動腎臟炎癥過程。本研究中,小鼠腎皮質ELISA結果證實,T2DM中Ang II濃度明顯升高,不同劑量替米沙坦干預均可使Ang II濃度明顯降低,腎皮質炎性細胞因子IL-1β、IL-6、TNF-α水平降低,進一步證實了腎臟局部RAS系統在T2DM小鼠腎臟炎癥反應中的作用。
Chemerin是近年來發現的具有參與脂肪細胞脂質代謝調控的新型脂肪因子,其可通過旁分泌途徑作用于巨噬細胞等炎性細胞,參與炎癥反應。文獻報道,在T2DM模型大鼠腎組織中Chemerin表達明顯升高,而且其水平的高低與腎臟炎癥因子緊密相關[14]。同樣,在T2DM伴患者血清中也檢測出高水平Chemerin[15]。本研究同樣發現,T2DM小鼠腎皮質中Chemerin蛋白的分布增多、表達明顯升高,進一步提示Chemerin與T2DM的發生、發展密切相關。給予替米沙坦干預后,小鼠腎皮質中Chemerin蛋白的分布減少、表達下降,表明替米沙坦可能是通過抑制Chemerin蛋白的分布、表達改善T2DM小鼠腎臟炎癥反應。
綜上所述,替米沙坦能夠以血糖非依賴的方式改善T2DM小鼠腎功能,減少腎皮質中炎性細胞因子IL-1β、IL-6、TNF-α水平,這種作用可能是通過抑制腎皮質Ang II的生成,進而抑制腎臟局部RAS,以及抑制Chemerin蛋白的分布、表達,減輕T2DM小鼠腎臟炎癥反應,最終改善腎組織的病理性損傷,為臨床干預DN的發生和發展提供一定的實驗依據和理論基礎。
(致謝:本文所有實驗均在泉州醫學高等專科學校微血管生理調控實驗中心完成,特別感謝對課題給予指導及幫助的老師。)

