重組人甲狀旁腺素1-34治療絕經后骨質疏松癥的臨床研究
陸彬彬 高愛國
南京醫科大學附屬無錫市人民醫院,江蘇 無錫 214021
骨質疏松癥是以骨密度降低及骨組織微細結構破壞為主要特征的全身性、隱匿性疾病,易致患者骨強度降低、骨脆性增加,從而導致全身骨痛、駝背變矮,嚴重者會發生骨質疏松性骨折,主要為胸腰椎體壓縮性骨折及髖關節骨折。目前臨床上出現了以重組人甲狀旁腺素1-34為代表的促進骨形成的抗骨質疏松藥物,但由于骨質疏松治療時間較長,患者依從性較差,此藥物的臨床應用報道很少。本次研究采用基因重組技術制備的人甲狀旁腺素1-34(特立帕肽)治療絕經后骨質疏松癥,連續應用26周,并于治療前及治療后的13和26周測定腰椎(L1-4)和股骨近端骨密度(BMD),采靜脈血測定骨代謝指標,應用VAS評分評價患者的疼痛程度,記錄不良反應。通過對比治療前后患者骨密度、骨代謝指標及疼痛程度的變化來評價該藥物的臨床療效。
1 材料和方法
1.1 病例資料
對我院2016年5月至2017年5月入院診斷為骨質疏松癥的老年女性患者進行研究對象的篩選,絕經時間≥3年,平均年齡(71±9)歲,平均身高(167±10)cm, 平均體重(53±9)kg。
納入標準:所有選取研究對象在治療前均采用雙能X線骨密度測量儀檢測骨密度,根據WHO推薦的“原發性骨質疏松癥診斷標準”,骨密度用T-Score(T 值)表示,T值≤-2.5 個標準差為骨質疏松;T值≥-1.0 個標準差為正常。
排除標準:①之前已連續使用重組人甲狀旁腺激素1-34超過 3 個月 (短期使用的,經過1年洗脫期可以入組);②之前 1 年里長期系統使用糖皮質激素或其他影響骨代謝的藥物;③之前 3 個月內接受過雙膦酸鹽、雌激素、雷洛昔芬或降鈣素治療;④之前接受過鍶鹽治療;⑤有腎上腺、甲狀旁腺、甲狀腺、性腺等影響骨代謝的內分泌疾病;⑥患有心、肝、腎、肺等嚴重原發系統疾病;⑦患者拒絕接受重組人甲狀旁腺激素1-34藥物治療[1]。
1.2 研究方法
篩選出的所有患者入組后均口服元素鈣 500 mg/d(鈣爾奇D,美國惠氏制藥有限公司)和維生素 D(羅蓋全,上海羅氏制藥有限公司)200U/d,連續服用26周后加用重組人甲狀旁腺素1-34(特立帕肽,美國禮來公司),用法為每天皮下注射 20μg特立帕肽。通過門診測定患者腰椎(L1-4)和股骨近端骨密度(BMD),采靜脈血測定血清骨鈣素(OC)、堿性磷酸酶水平,應用疼痛視覺模擬評分法(VAS 評分)評價患者的疼痛程度,并記錄下用藥期間的不良反應情況。
1.3 觀察指標
①疼痛視覺模擬評分法(VAS 評分):評價患者的疼痛程度,即在標有 VAS評分的直尺上,兩端分別標明有 “0”和 “10”字樣。 “0”cm 代表無痛, “10” cm 代表最劇烈的疼痛。患者根據自己感受的疼痛程度,在對應的直線上標出相應位置,即為評分值。評分值越高,表示疼痛的程度越重。②骨密度測量:采用雙能X線骨密度測量儀分別在用藥前及用藥后13、26周時測定患者全身、腰椎1-4和股骨頸的骨密度(BMD),所有步驟由計算機自行進行定位、數據采集及處理。③骨代謝指標:取清晨空腹肘靜脈血5 mL,分離血清后進行測定。堿性磷酸酶:是組織非特異性堿性磷酸酶的一種特殊形式,由成熟階段成骨細胞合成并分泌,與細胞外骨基質結合,是反映骨形成的特異敏感指標。骨鈣素:血清中骨鈣素可迅速被降解,使得其片段可被抗體檢測,其中 N-MID 片斷穩定性及靈敏度好,可用于監測骨代謝水平,反映近期成骨細胞活性,骨代謝越快,骨鈣素水平越高,反之則越低。④不良反應:通過隨訪記錄用藥期間發生的不良反應情況。
1.4 統計學處理
2 結果
2.1 入組患者基線資料
應用特立帕肽治療前患者基線資料見表1。
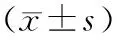
表1 患者基線資料Table 1 The baseline data of the 〗
2.2 應用特立帕肽治療前及治療后13、26周BMD變化
應用特立帕肽治療前及治療后13、26周BMD變化見表2。
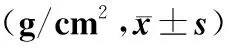
表2 特立帕肽治療前及治療后13、26周BMD變化Table 2 The change of BMD before and after 13 and 26 weeks of teriparatide
注:與治療前比較,*P<0.05。
治療13周時,腰椎L1-4、股骨頸、大粗隆和股骨干骨密度改善不明顯(P>0.05),治療26周時,腰椎L1-4和股骨頸骨密度較治療前明顯增高(P<0.05),而大粗隆和股骨干骨密度改善不明顯(P>0.05)。
2.3 應用特立帕肽治療前及治療后13、26周骨代謝指標變化
應用特立帕肽治療前及治療后13、26周骨代謝指標變化見表3。
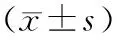
表3 特立帕肽治療前及治療后13、26周骨代謝指標變化Table 3 The change of bone metabolic index before and after 13 and 26 weeks of teriparatide
注:與治療前比較,*P<0.05。
治療13周時,血清骨鈣素和骨堿性磷酸酶較治療前升高(P<0.05)。治療26周時,血清骨鈣素和骨堿性磷酸酶呈持續升高趨勢(P<0.05)。
2.4 應用特立帕肽治療前及治療后13、26周VAS評分變化
應用特立帕肽治療前及治療后13、26周VAS評分變化見表4。
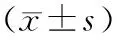
表4 特立帕肽治療前及治療后13、26周VAS評分變化Table 4 The change of VAS before and after 13 and 26 weeks of teriparatide
注:與治療前比較,*P<0.05。
治療13周時,疼痛緩解明顯(P<0.05),治療26周時,疼痛明顯減輕(P<0.05)。
2.5 治療后發生不良反應情況
治療后發生不良反應情況見表5。
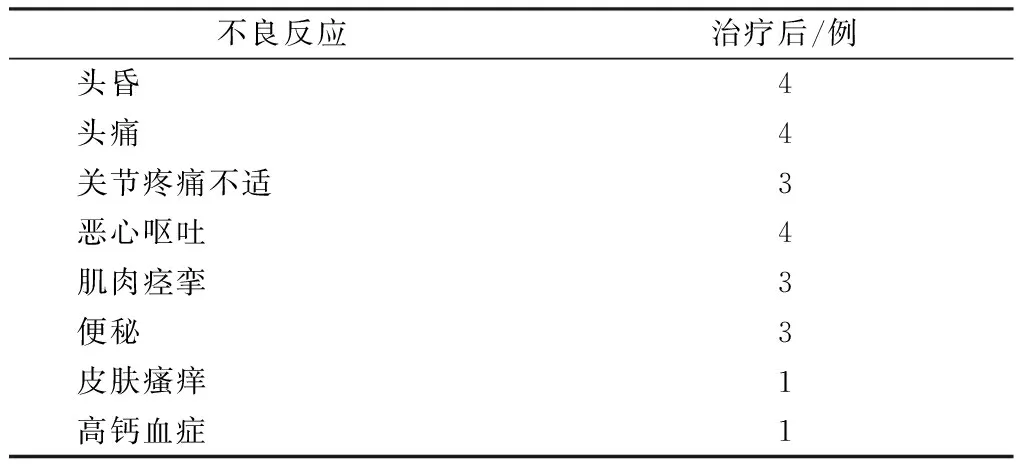
表5 治療后發生不良事件Table 5 The adverse events after the treatment
治療期間不良反應的情況均較輕微,沒有給予特殊處理即自行緩解。
3 討論
骨質疏松是一種骨骼脆性增加和易發生骨折的全身性疾病,以低骨量和骨組織的微結構破壞為特征。 據世界衛生組織統計, 目前骨質疏松的患病率已在全世界多發病、常見病中位居前列,全世界患病人數超過 2 億。骨質疏松性骨折的直接致殘和間接致死率高,因此早期預防和治療骨質疏松有重要意義[2]。
目前在臨床上治療絕經后骨質疏松癥應用最廣泛的藥物為抑制骨吸收類藥物,如:雙膦酸鹽、降鈣素、雌激素、易普拉芬等。此類藥物主要通過抑制骨吸收來提高骨密度,但難以維持正常骨量及骨強度,適合于骨代謝呈高轉換的患者。在骨質疏松性骨折的圍術期應用抑制骨吸收類的藥物會影響患者的骨折愈合,存在一定風險且患者長期服用會出現療效下降和不良反應。而臨床上出現的以重組人甲狀旁腺素1-34(特立帕肽)為代表的促進骨形成的藥物可以彌補這些不足。
特立帕肽是經生物合成技術,以大腸桿菌為宿主生產的hPTH的活性片段,保持其中34個氨基酸序列與hPTH的N端氨基酸序列的一致,具有hPTH的生物活性。hPTH在血液中具有調節鈣磷代謝的功能,是由84個氨基酸所組成的直鏈多肽分子,分子中不含半胱氨酸,其氨基端為hPTH的活性端,主要與PTH I型受體結合影響成骨過程[3];羧基端具有免疫反應效應,可由hPTH降解生成也可由甲狀旁腺分泌。hPTH 受體屬于G蛋白偶聯受體超家族,分為hPTH Ⅰ型和hPTH Ⅱ型。hPTH Ⅰ 受體主要位于骨骼及腎組織,對hPTH及相關蛋白擁有相同的激活力和親和力,其中hPTH的N端肽鏈與hPTH Ⅰ受體結合可促進骨細胞生長;hPTH Ⅱ受體主要位于胰腺及腦組織,與hPTH Ⅰ受體具有部分同源性,可選擇性結合hPTH, hPTH的C端肽鏈與hPTH Ⅱ受體結合可促進骨細胞凋亡[4]。特立帕肽不僅保存了與hPTH Ⅰ受體結合調節成骨細胞的作用,同時能消除了hPTH的C端肽鏈所帶來的促骨細胞凋亡作用[5]。
特立帕肽可發揮不同的生物活性來介導和調節全身骨代謝:增強成骨細胞分化、激活骨襯細胞及抑制成骨細胞凋亡等。其可通過 hPTH Ⅰ受體激活磷脂酶C,增加IP3和DG,進而激活PKC(蛋白激酶C),導致活性成骨細胞凋亡減少、數量增多,促進成骨細胞及骨襯細胞增殖;也可通過激活腺苷酸環化酶,催化生成cAMP(環磷酸腺苷),激活PKA(蛋白激酶A)來刺激骨襯細胞、成骨細胞及骨髓基質干細胞表面的hPHT Ⅰ型受體,進一步促進成骨細胞分化、延長成骨細胞壽命;也可通過調節細胞因子來間接調節骨代謝,如誘導促生長因子(IGF-1)與成骨細胞結合,刺激骨生長等[6],在治療骨質疏松癥方面有獨特療效。
目前國外已有部分臨床研究,如Gomberg等[7]通過前瞻性研究對因退行性腰椎滑脫而施行椎管減壓椎弓根螺釘固定植骨融合術后,使用特立帕肽和利塞膦酸鈉的絕經后骨質疏松患者進行比較,一組每日皮下注射20μg特立帕肽(29例),另一組每周口服利塞膦酸鈉(28例),結果顯示術后1年兩組疼痛改善無顯著性差異,骨愈合率分別為82%和62%,平均骨愈合時間分別為8周和10周,認為皮下注射特立帕肽較口服利塞膦酸鈉更有效。后續研究發現,12個月 后 特 立 帕 肽 組 椎 弓 根 螺 釘 松 動 率(7%~13%)較利塞膦酸鈉組(13%~26%)明顯降低(P<0.05),認為特立帕肽可提高腰椎骨髓和椎弓根皮質質量。如Sato 等[8]對絕經后骨質疏松女性患者進行隨機篩選,每日給予皮下注射特立帕肽治療,通過雙能X 線測定治療前及治療后 18 個月患者的骨密度進行對比,結果顯示在每日給予皮下注射20 μg特立帕肽后,腰椎骨密度增加 9%,股骨頸骨密度增加 3%,橈骨遠端骨密度無明顯變化;而每日給予皮下注射40 μg 特立帕肽后,腰椎骨密度增加 13%,股骨頸骨密度增加 6%,橈骨遠端骨密度無明顯變化。在一項研究中[9],428例糖皮質激素誘導發生骨質疏松的患者分別接受皮下注射20μg/d特立帕肽和應用10μg/d阿侖膦酸鈉進行治療,隨訪36個月后,結果顯示特立帕肽組骨形成標志物如Ⅰ型原膠原氨基端前肽(PINP)和骨鈣素(OC)顯著增加,骨吸收標志物如CTX僅在應用特立帕肽治療的6個月間增加較明顯;而阿侖膦酸鈉組在該三個指標上均明顯降低。可見作為促進骨吸收的代表藥物,特立帕肽能提高骨質疏松患者骨密度,增強骨骼強度,降低胸腰椎、髖部等骨折的風險,并且在改善骨結構,促進骨折愈合方面也有顯著的臨床療效。且特立帕肽不良反應較輕,相對安全可靠。其與傳統的抗骨質疏松藥物對比,擁有更突出的效果。
本次研究綜合分析了患者骨密度、骨代謝指標及VAS評分,可以更加準確的評價特立帕肽應用于骨質疏松癥的臨床效果。通過比較應用特立帕肽治療前后患者在BMD、骨代謝指標、VAS評分上的變化,發現治療13周時,血清骨鈣素和堿性磷酸酶較治療前升高,疼痛緩解明顯,但對骨密度的影響較小;治療26周時,腰椎L1-4和股骨頸骨密度較治療前明顯增高,血清骨鈣素和堿性磷酸酶也呈持續升高趨勢。可見特立帕肽有激活成骨細胞活性,改善骨骼細微結構的功能,可增加骨密度、促進骨形成、改善骨骼質量、加速骨折愈合,具有獨特的治療優勢。此外在治療期間,通過隨訪記錄患者不良反應的情況,發現大部分患者不良反應的發生均較輕微。當然,由于人力、物力的限制,且考慮到長期觀察患者的依從性會降低,僅對患者進行觀察26周,沒有觀察到特立帕肽對患者的長期影響。雖然在動物試驗中發現,應用特立帕肽兩年的大鼠約有45%發生惡性骨腫瘤,在特立帕肽上市后,很少報道發生骨肉瘤或骨腫瘤病例,并沒有證據可以說明兩者間有因果關系[10]。
特立帕肽在國內的臨床使用尚未普及,部分問題需繼續研究,如患者在接受24個月后,是否能繼續用藥、繼續用藥的最佳時間或繼續用藥的臨床療效情況,目前還沒有足夠的臨床研究可以證實;特立帕肽能否制作成口服藥來加以推廣和簡化患者的治療方式;特立帕肽與其他抗骨質疏松藥物的聯合使用及具體聯合用藥的方式等都需更多的臨床試驗加以證明。

