miR-23b-3p在皮肌炎血清中的表達與臨床意義
葉利芳 ,舒曉明 ,左 瑜 ,楊闞波 ,陳 賀 ,張亞妹 ,王國春 ,?
(1.北京大學中日友好臨床醫學院,北京 100029;2.中日友好醫院 風濕免疫科,北京 100029;3.中國醫學科學院北京協和醫學院 研究生院,北京 100730)
皮肌炎(dermatomyositis,DM)是一組病因尚不明確、臨床上以四肢近端肌無力、肌痛及皮膚病變為特征,以骨骼肌炎癥浸潤為特征性病理改變的自身免疫性疾病,也可伴發嚴重的呼吸、消化、循環等多系統損害[1]。肌肉病變為DM的主要病變之一,目前DM肌肉病變的確切病因和發病機制仍不清楚。
大量研究表明miRNA參與各種疾病的發病機制,如自身免疫性疾病[2]。新近發現的miR-23b-3p是一種炎癥相關的miRNA,可調節許多炎性細胞因子,例如NF-κB,腫瘤壞死因子(tumor necrosis factor,TNF)-α,白細胞介素(interleukin,IL)-1β和IL-17,參與多種自身免疫性疾病[6]。Zhu等[7]研究發現,miR-23b-3p在類風濕關節炎(rheumatoid arthritis,RA)和系統性紅斑狼瘡(systemic lupus erythematosus,SLE)患者中表達下調,通過靶向TGF-β激活的激酶1/MAP3K7結合蛋白 2 (TGF-β-activated kinase 1/MAP3K7 binding protein2,TAB2)、TAB3 和核因子 κ-B 激酶亞基抑制劑 α(inhibitor of nuclear factor κ-B kinase subunit α,IKK-α)抑制IL-17水平進而參與疾病發病。但迄今為止,miR-23b-3p在DM中的作用尚未研究。本研究采用實時熒光定量PCR檢測DM患者中的miR-23b-3p的表達水平,并分析其和臨床特征的相關性,初步探討其在DM中的臨床意義。
1 對象與方法
1.1 研究對象
選擇2011年3月~2016年2月于中日友好醫院風濕免疫科住院治療的活動期DM患者49例,其中男16例、女33例;全部患者均符合1975年Bohan/Peter的診斷標準。所有入選病例均排除合并感染及其他自身免疫性疾病。收集同期在我院體檢的經年齡、性別匹配的健康體檢人群血清作為對照。所有血清采集分離之后均于-80°C凍存直至檢測時使用。本研究已通過我院倫理委員會(2016117)批準,所有受試者簽署知情同意書。
1.2 臨床指標檢測
常規實驗室評估包括確定血清肌酸激酶(CK),乳酸脫氫酶(LDH),紅細胞沉降率(ESR),C-反應蛋白(CRP),均在中日友好醫院檢驗科完成。采用蛋白質印跡法檢測血清中抗Jo-1、PL-7、PL-12、EJ、OJ、Mi2、SRP、MDA5、NXP2、TIFl-1 和SAE抗體 (試劑盒購自德國歐蒙公司),采用ELISA法檢測血清中抗HMGCR抗體 (試劑盒購自美國Inova Diagnostics公司)。根據國際肌炎預后評估協作組 (international myositis outcome assessment co11aboration study,IMACS)推薦使用視覺模擬評分 (physician's global assessment,PGA)(范圍0~10cm)評估DM患者的疾病活動性。
1.3 血清總RNA提取
根據制造商的說明書使用TRIzol試劑(美國Invitrogen公司)從1ml血清中提取總RNA,并最終溶解于20μl無RNase的水中;采用紫外分光光度計K5500(中國)對獲得的總miRNA進行純度和濃度檢測,合格樣品的吸光度A260/280在1:8~2:1之間;然后進行凝膠電泳檢測RNA的完整性。
1.4 實時熒光定量PCR檢測
采用TIANGEN逆轉錄試劑盒(天根,中國)對血清提取的總RNA逆轉錄成cDNA;設計并合成相應引物(銳博,中國),頸環法檢測,以celmiR-39-3p為內參基因,采用miRNA qPCR Starter Kit(銳博,中國)行實時熒光定量PCR,然后采用CFX96 RTPCR儀(Bio-Rad公司,美國)上進行qPCR擴增,檢測各樣本Ct值。每種樣品采用相同體系及條件同時進行3次PCR擴增。為驗證預期PCR產物的準確性和特異性,進行解鏈曲線分析。△CT=目的基因平均 CT值-內參平均CT值,計算2-△△Ct作為miRNA的相對表達水平。
1.5 統計學方法
統計學分析均采用SPSS 19.0軟件;計量資料組間比較采用χ2檢驗,計數資料的比較采用Mann-Whitney U檢驗,采用Spearman相關系數進行相關性評估。
2 結果
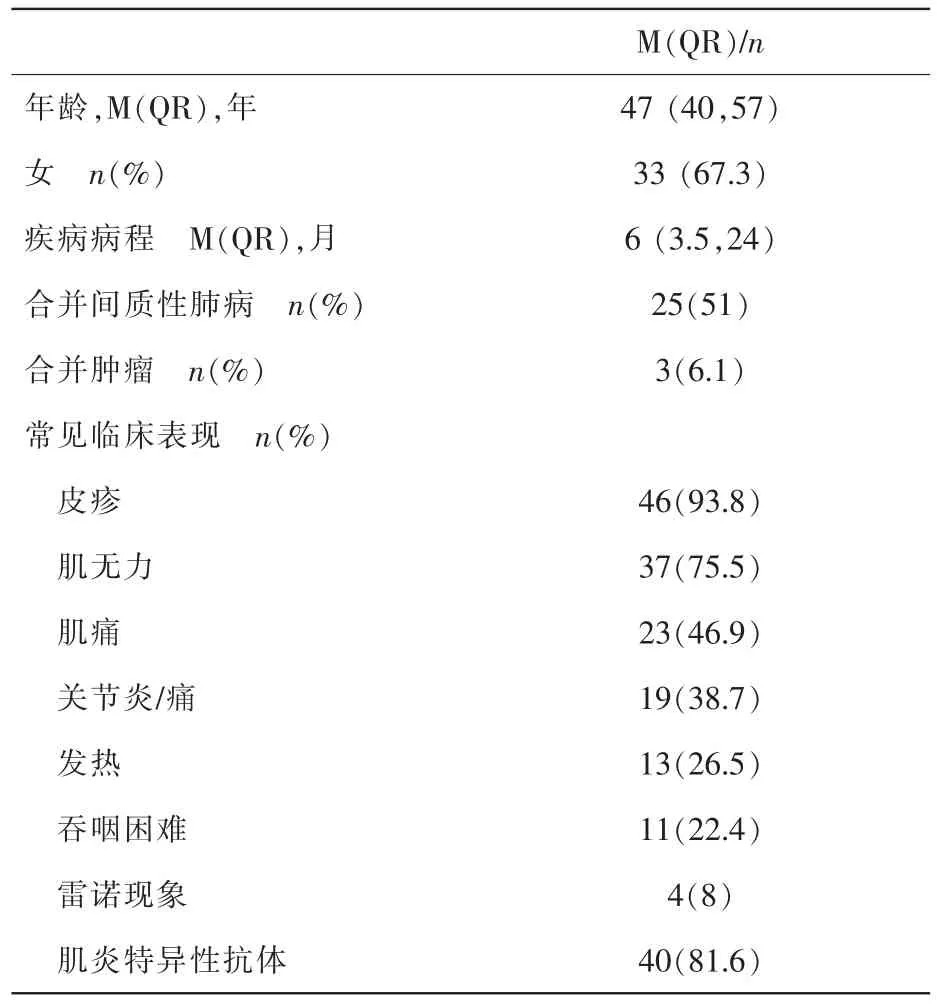
表1 DM患者臨床資料
2.1 DM患者的臨床資料
表1示,49例DM患者年齡47±10歲,常見的臨床癥狀為皮疹(93.8%)、肌無力(75.5%)、肌痛(46.9%)、關節炎/痛(38.7%)、發熱(26.5%)等,肌炎特異性抗體(myositis specific autoantibodies,MSAs)陽性率為 81.6%(40/49),約有 51%(25 例)的患者合并有肺間質病變 (interstitial lung disease,ILD),合并食管受累者有 11例 (22.4%),4例(8%)患者有雷諾現象。
2.2 miR-23b-3p在DM患者血清中的表達
DM患者血清中miR-23b-3p相對表達量為1.98±0.86,健康對照組miR-23b-3p相對表達量為 3.02±1.13,2 組具有顯著性差異 (P<0.01),結果見圖1。
2.3 DM患者血清miR-23b-3p表達水平與臨床特征的相關性
我們進一步分析常見臨床癥狀和實驗室指標,結果表明,DM患者血清miR-23b-3p相對表達量與“技工手”[1.20 (0.93,1.93)]的發生相關(Z=-2.302,P=0.021);miR-23-3p 與肌痛、 肌無力、吞咽困難、關節疼痛、雷諾現象和肺間質病變等常見臨床癥狀的出現不相關。實驗室結果表明,miR-23b-3p與CK水平呈負相關 (r=-0.286,P<0.05);與血沉(ESR)、C 反應蛋白(CRP)、乳酸脫氫酶 (LDH)、谷草轉氨酶 (AST)、谷丙轉氨酶(ALT)以及疾病活動度水平均無相關性,詳見表2及表3。
2.4 不同CK水平的miR-23b-3p表達水平比較
為進一步明確DM患者血清miR-23b-3p與CK的相關性,將實驗組分為CK正常組(35例)與CK升高組(14例),并比較其miR-23b-3p表達水平,結果顯示CK升高組miR-23b-3p(1.61±0.19)顯著低于 CK 正常組(2.15±0.15,P<0.05),見圖2。
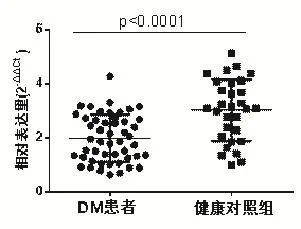
圖1 DM患者血清中miR-23b-3p表達水平下調
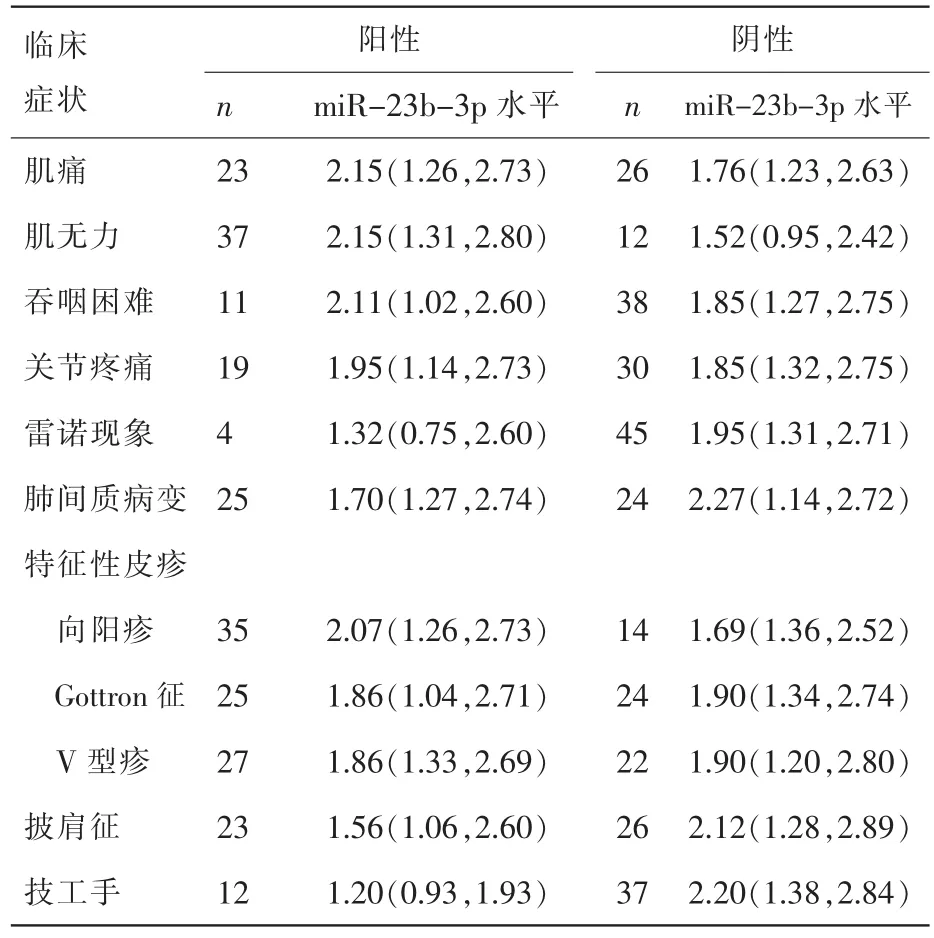
表2 DM患者血清中miR-23b-3p表達水平與臨床癥狀的比較
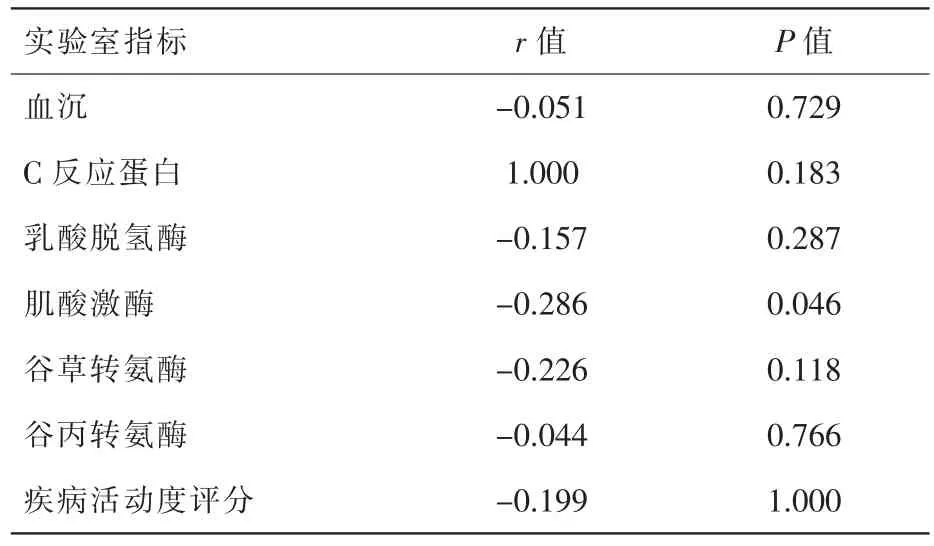
表3 DM患者血清中miR-23b-3p表達水平與實驗室指標的比較
3 討論
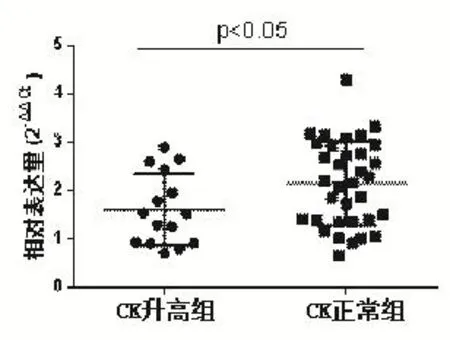
圖2 不同CK水平的miR-23b-3p的表達水平比較
已有研究表明miRNA參與各種疾病的發病機制,如miRNA參與系統性紅斑狼瘡,類風濕性關節炎等自身免疫性疾病的發病機制[8]。有報道多個miRNA在皮肌炎中的表達差異,如Inoue K等研究發現miR-223在DM皮膚和血清中表達下調并參與蛋白激酶C水平調節[3],Oshikawa Y等研究表明在DM血清和皮膚中表達下調的miR-7與Gottron’s皮疹的發生呈負相關[4],有部分miRNA參與肌肉損傷過程,Yin等研究表明DM患者肌肉組織中表達下調的miR-146a通過靶向TRAF6和影響IL-17/ICAM-1途徑調節炎性巨噬細胞浸潤進而參與肌肉炎性損傷[5]。這些研究均表明miRNA參與DM的發病。
在炎性疾病患者的血清樣品中存在循環的細胞外miRNA,可能由炎性細胞或組織產生,因此血清miRNA的變化可以反映疾病狀態[9]。近年來miRNA在DM發病中的調控機制越來越受到重視。研究顯示,miR-23b通過調節多種不同的免疫細胞和炎癥因子參與自身免疫性發病機制[6]。在DM患者的血液和炎癥肌肉損傷中發現的免疫細胞和炎癥因子直接參與肌纖維損傷[10],故推測miR-23b-3p在DM肌肉損傷發病過程中起作用。
本研究首次證實DM患者血清miR-23b-3p表達下調,與CK水平負相關,與技工手的發生有關,提示miR-23b-3p可能是參與DM肌肉損傷的重要分子。Martina等研究顯示,與健康對照組相比,miR-23b-3p的表達在IIM患者的外周血單個核細胞(PBMC)中未發現有顯著差異。本研究DM患者血清miR-23b-3p表達下調,推斷miR-23b-3p在皮肌炎致病機制中的調節作用可能不在PMBC中發生[11]。新近研究顯示,miR-23b-3p在肌營養不良患者中表達顯著下調,該研究為miR-23b-3p參與皮肌炎患者肌肉損傷過程提供了有力的證據[11]。但確切機制尚不清楚,miR-23b可能通過調節多種不同的免疫細胞和炎癥因子共同參與皮肌炎肌肉損傷過程。Zhu等[7]研究顯示,在RA或SLE中下調的miR-23b-3p靶向TAB2、TAB3和IKK-α mRNA轉錄物,通過限制關鍵促炎性細胞因子IL-17,IL-1β和TNF的作用來抑制自身免疫癥狀。IL-17在DM中的發病機理也有報道[13]。因此推測,miR-23b-3p可能通過靶向調控IL-17的表達,從而介導DM的肌肉損傷。
Oshikawa等研究發現,皮肌炎患者中皮膚與血清中miR-7的表達顯著下調,并認為血清miR-7可能是診斷皮肌炎的分子標記物[14]。本研究同樣發現,miR-23b-3p在DM中有技工手患者中的表達水平顯著低于無技工手患者,其原因尚不清楚,是否可以作為區分皮肌炎患者有無技工手的分子標記物也有待進一步的研究。

