miRNA-30s在肺癌中的研究進展
李軍芳,趙國芳,楊明磊,何立峰,董彩軍
基金項目:華美研究基金(2016HMKY05)
肺癌是目前全世界所有惡性腫瘤中發病率與病死率最高的疾病。由于肺癌早期臨床診斷方法特異性差、敏感度低,治療過程又缺乏有效的分子標志物進行動態監測指導治療,因此肺癌患者的治療效果并不理想。M icroRNAs(miRNAs)是一類內源性的、非編碼單鏈小分子RNA,長度約為19~24個核苷酸,調控近60%的蛋白編碼基因[1]。m iRNA-30s是miRNAs的重要組成部分,由5個進化保守成員組成,分別為 m iRNA-30a、miRNA-30b、m iRNA-30c、m iRNA-30d和 m iRNA-30e。研究顯示 m iRNA-30s在肺癌的發生、侵襲和轉移,以及抗癌藥物敏感性等方面具有影響作用。因此本文對 miRNA-30s在肺癌發生發展中所起的作用及應用前景作一綜述。
1 miRNA-30s在肺癌細胞增殖和轉移中的作用研究
多項研究均顯示 m iRNA-30s具有抑制肺癌生長和轉移的作用。Kumarswamy等[2]把具有侵襲性的肺癌細胞系轉染m iRNA-30a后,發現癌細胞的形態發生改變,同時Snai1的表達下降,E-cadherin的表達升高,發現非小細胞肺癌中E-cadherin和m iRNA-30a表達呈正相關,隨后他們結合生物信息學和螢光素酶載體等實驗方法證實 Snai1可能是m iRNA-30a的靶基因。Fan等[3]研究肺癌細胞 95D上皮-間質轉換過程發現,m iRNA-30a通過抑制Snail的表達,抑制EMT,進而抑制肺癌細胞的入侵,結果與Kao等[4]研究相同。研究者體外研究發現,過表達的m iR-30a-5p通過抑制乳酸脫氨酶 A(LDHA)蛋白的表達,引起肺癌細胞的生長周期阻滯,抑制肺癌腫瘤細胞的體外生長、增殖和遷移[5-6]。其可能機制是糖酵解產生的乳酸造成局部酸性環境,促進肺癌腫瘤血管生成,進而促進肺癌侵襲和轉移。因此,得出乳酸脫氨酶 A(LDHA)是m iRNA-30a-5p在肺癌中的靶基因。
在A549和H23非小細胞肺癌細胞中miRNA-30b/c直接作用于Rab18,下調Rab18蛋白的表達,從而抑制非小細胞肺癌的增值[7]。miRNA-30d則通過與靶基因的3’-UTR結合,負性調控核心蛋白的表達,實現抑制自噬通路的激活,進而抑制非小細胞肺癌細胞的增殖和遷移。Kumar等[8]發現miRNA-30d通過與TP53的3’-UTR結合,直接負調控p53的表達與活性;研究發現抑制miRNA-30d表達可引起p53表達上調,同時通過調節p21、Gadd45a及Puma等相關基因的表達,促進細胞衰老,誘導細胞凋亡。Wu等[9]則發現,miRNA-30d通過與核因子IB(NFIB)的3’-UTR結合直接負調控NFIB的表達與活性,抑制癌細胞的遷移和入侵。另外Wu等[10]利用生物信息學和螢光素酶載體等方法發現miRNA-30e是抑制Ubc9的表達,發揮類似于抑癌因子的作用。
最近研究發現[11],miRNA-30s可直接作用肺癌微環境中 MMP19的轉錄和翻譯,顯著抑制MMP19的表達,而過表達的MMP19可刺激上皮細胞的增殖和轉移,同時也是非小細胞肺癌不良預后的因素。
2 m iRNA-30s在肺癌診斷和預后判斷中的作用研究
由于肺癌患者早期多無癥狀或癥狀輕微,不易被發現,等到出現咳嗽、咯血、氣促及胸痛時,往往已是中晚期。所以肺癌的早期診斷非常重要,Volinia等[12]通過對肺癌及與之對應的轉移性淋巴結進行 miRNA微陣列分析研究,發現miRNA-30a/e和其它一些miRNA與腫瘤的進展具有良好的表征關系。提示miRNA可作為轉移性癌基因靶標鑒定的一種新的診斷方法[13]。
肺癌經手術、放化療等綜合治療后,患者5年生存率仍低于15%[14],其生存率較低的主要原因是復發和轉移。因此,成功、準確地對肺癌進行有效地判斷其轉移及預后對醫生和患者有很大益處。miRNA-30a可直接激活原癌基因(BCL11A),而BCL11A的過度表達對非小細胞肺癌患者的預后具有積極作用[15]。隨后也有研究表明 miRNA-30a-5p的表達與肺癌的TNM分期、轉移及預后均具有相關性[5]。對于miRNA-30b和m iRNA-30c,有研究報道了它們的表達與酪氨酸激酶抑制劑(KTIs)作為一線藥物治療NSCLC的預測價值[16],結果表明在非小細胞肺癌組織中miRNA-30b和miRNA-30c表達均顯著下調,且呈正相關;但miRNA-30c的表達明顯高于miRNA-30b,提示KTIs作為一線藥物治療非小細胞肺癌時,miRNA-30b和miRNA-30c的表達可以作為肺癌預后的潛在標記物。Hu等[17]研究Ⅰ~Ⅲa期肺癌患者的血清發現,較長存活組與較短存活組間miRNA的相對表達量相差5倍,其中miRNA-1、miRNA-30d、miRNA-1、miRNA-486 和miRNA-499與總生存期顯著相關,可作為總生存的獨立預測因素,也可作為一種非侵入性檢測,預測非小細胞肺癌患者的轉移及總體生存期,判斷患者的預后。隨后Silva等[18]分析了28例非小細胞肺癌患者體內的miRNA-30e-3p的表達水平,并分析與患者臨床病理學特征的相關性,發現在非小細胞肺癌患者的血漿中miRNA-30e-3p表達下降,miRNA-30e-3p的表達水平可以判定患者疾病的分期和評估手術的可能性。這表明血漿中miRNA-30e-3p水平與患者無病生存率和總生存率有關,與非小細胞肺癌患者預后相關。
3 miRNA-30s對抗癌藥物敏感性作用研究
已有研究證實miRNA-30s在肺癌的藥物治療機制中具有重要作用。Kim等[19]和門萬夫等[20]先后均研究了肺癌細胞對克唑替尼的耐藥性,結果均表明miRNA-30a可以增強肺癌細胞對克唑替尼的敏感性,減弱癌細胞的侵襲力,原因是miRNA-30a對上皮細胞間質轉化的抑制作用。另外門萬夫還發現肺腺癌細胞對克唑替尼敏感性的增加還與過表達的miRNA-30a抑制癌細胞的自噬有關。無論其抑制機制是怎樣,兩項研究結果均表明miRNA-30a可抑制克唑替尼在治療肺癌中的耐藥性,對肺癌的治療具有重要的作用。
Garofalo等[21]和Chen等[22]均研究了吉非替尼治療非小細胞肺癌的耐藥機制,均發現下調肺癌細胞中的 miRNA-30b和 miRNA-30c可誘導非小細胞肺癌對吉非替尼的敏感性增加,促進細胞凋亡。前者結合生物信息學和螢光素酶載體等方法證實 BCL2-like11和APAF-1可能是miRNA的靶基因;后者發現抑制Dicer酶,肺癌細胞中miRNA-30b/c的表達下調,Caspase-3蛋白表達上升,從而促進細胞凋亡。以上關于藥物治療肺癌產生的耐藥機制和尋找增強腫瘤細胞對藥物的敏感性的方法具有重要臨床意義,可為患者和醫生帶來巨大受益。
綜上所述,m iRNA-30s在肺癌細胞的增殖、轉移及耐藥等方面具有重要作用。但是,目前m iRNA-30s在肺癌中的功能及與多靶點相互作用的關系研究并不完整,需要系統性地描繪miRNA-30s對肺癌作用的信號傳導的調控網絡,這樣能更系統直觀地體現m iRNA-30s的作用機制,可為肺癌的臨床治療提供新的潛在方法。尤其是在抗癌藥物耐藥方面的研究,需要大規模的臨床轉化研究。
收稿日期:2018-05-10
(本文編輯:陳志翔)
吳元元,毛琦,胡釗.成年人齒狀突影像學測量及其臨床意義(見正文第1437頁)
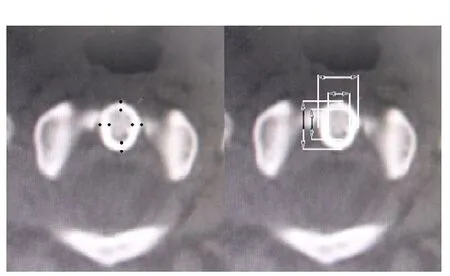
圖1 齒狀突基底部平掃,分別測量其冠狀位、矢狀位內外徑
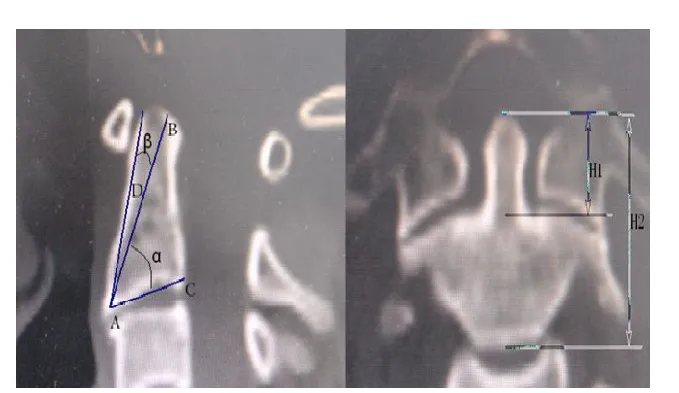
圖2 左側:在中央矢狀面,首先定義四個點,分別以A、B、C、D標識。點A為腹側與基底交界處。點B為中空螺釘尾端到達部位,點C為腹側與基底交界處,點D為腹側皮質中點,AB為中空拉力螺釘長度。角 、角 分別為螺釘與樞椎基底部和樞椎腹側夾角。右側:齒狀突高度:齒狀突尖至齒突基底部的垂直距離,為中央冠狀位上通過齒突尖與齒狀突基底部水平線間距離(H1)。樞椎總高度:齒狀突尖至樞椎基底的垂直距離,為中央冠狀位上通過齒突尖與樞椎基底部水平線間距離(H2)

圖3 齒體角(角1)為正中矢狀面上齒狀突與樞椎體正中線夾角。樞椎體后傾角(角2)為正中矢狀面上樞椎體正中線與基地部垂線夾角。KL、IJ為經過齒狀突的平行線,EF、AB為通過樞椎體的平行線
諶建萍.甲狀腺乳頭狀癌超聲影像和頸部淋巴結轉移的關系(見正文第1444頁)
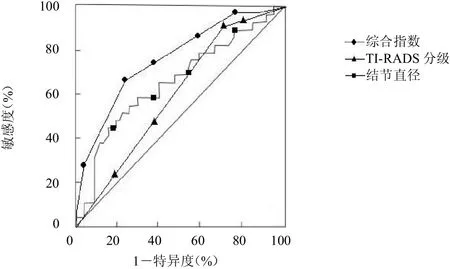
圖4 結節直徑和TI-RADS分級相結合構建 曲線
唐夢君,陳美琴,胡望遠.全身炎癥反應指標與食管鱗癌患者放療后預后關系的分析(見正文第1446頁)
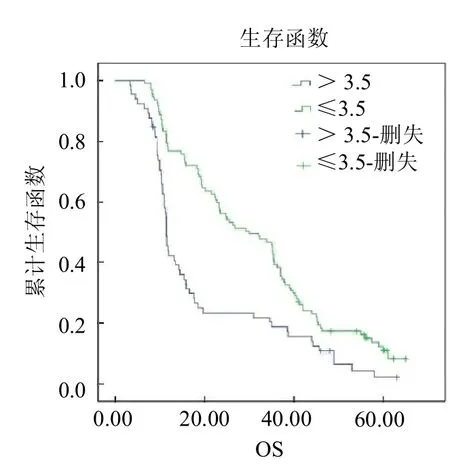
圖5 放療前不同 NLR水平食管癌患者的Kaplan-Meier生存曲線
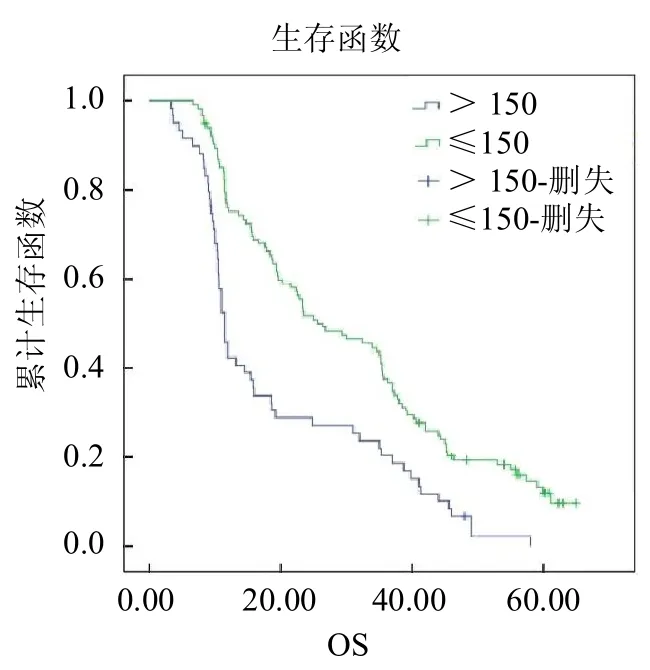
圖6 放療前不同 PLR水平食管癌患者的Kaplan-Meier生存曲線
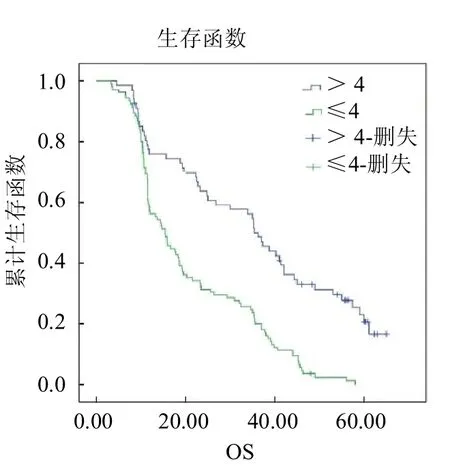
圖7 放療前不同 LMR水平食管癌患者的Kaplan-Meier生存曲線
陳良,陳振東,趙亦軍,等.早期肝癌3.0T MRI影像表現及診斷價值分析(見正文第1501頁)
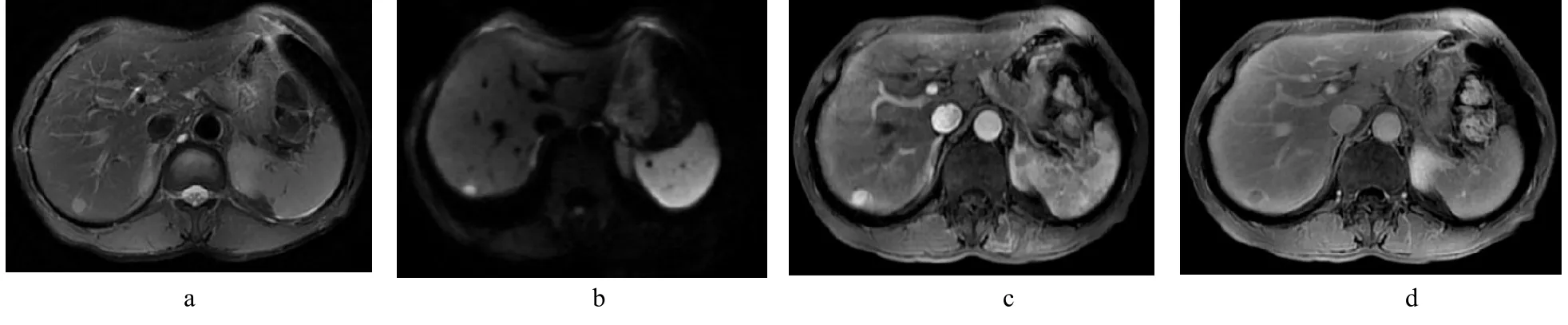
圖1 男,56歲,肝硬化10余年,CT發現右肝后上段小病灶,無法確定性質。a:T2W I呈高信號,周圍見低信號環包繞;b:DW I呈明顯高信號;c:動脈期顯著強化;d:延遲期病灶呈低信號,周圍見高信號假包膜
石俊華,馬晨霞,來蕾.肉芽腫性小葉性乳腺炎患者彩色多普勒超聲的表現及診斷價值分析(見正文第1506頁)
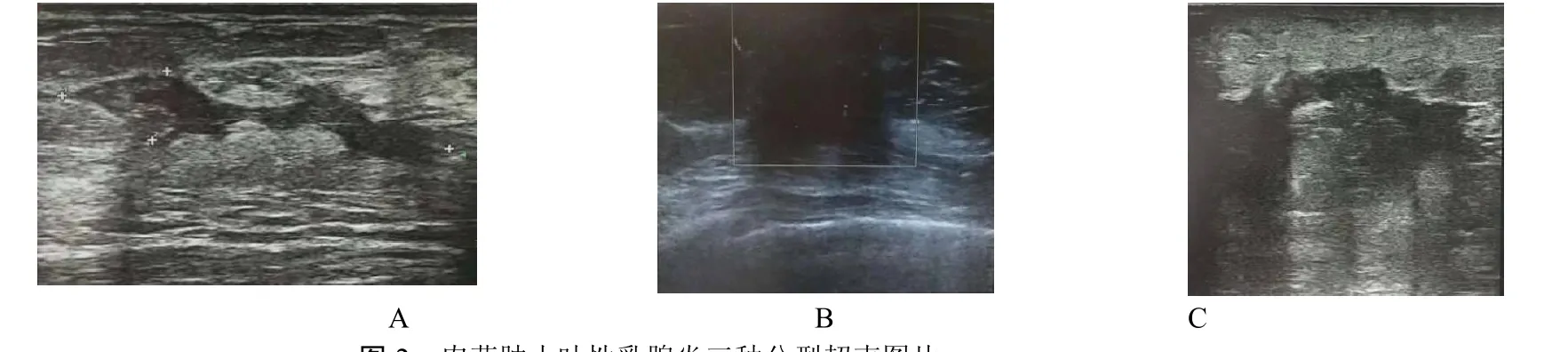
圖2 肉芽腫小葉性乳腺炎三種分型超聲圖片注:A為片狀回聲型,B為結節(或)腫塊型,C為彌散型
余晶晶,楊育生,鄭江江,等.NapsinA、CK7、P504S、CD10及TFE3聯合應用在乳頭狀腎細胞癌鑒別診斷中的價值(見正文第1521頁)
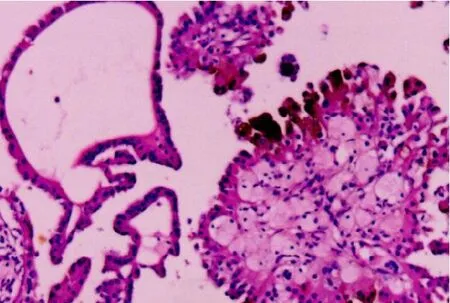
圖3 PRCC乳頭狀結構,乳頭軸心可見泡沫細胞(HE 染色,×100)
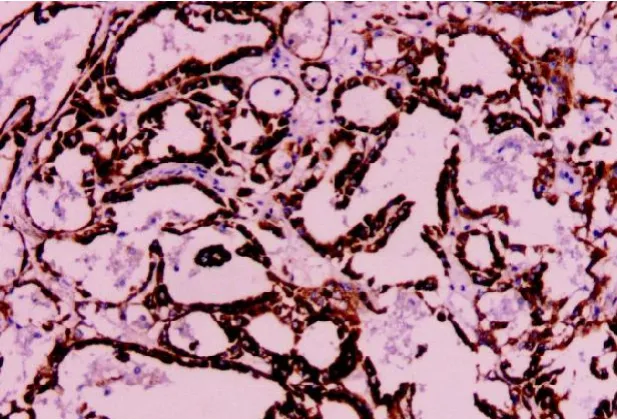
圖 4 P504S(Envision 法,×100)
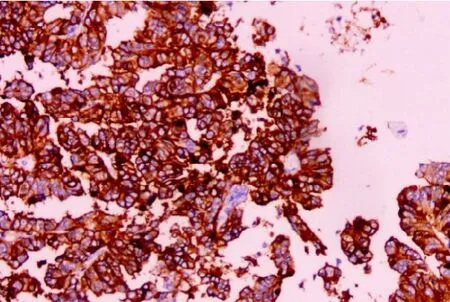
圖 5 CD10(Envision 法,×100)
王敏,虞繼紅,賀吉,等.不同固定液在細胞蠟塊技術中的應用
(見正文第1523頁)
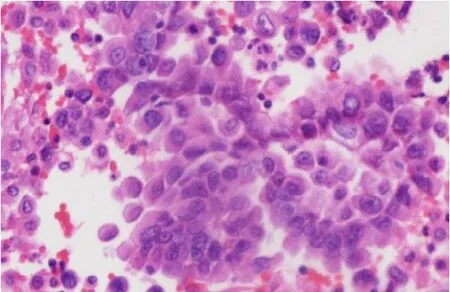
圖6 12%甲醛固定(HE染色,×400)
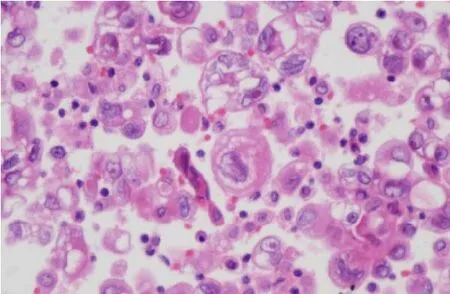
圖7 95%的乙醇固定(HE染色,×400)
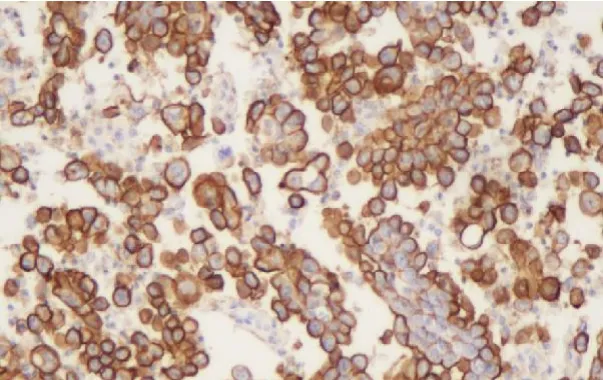
圖 8 12%甲醛固定 CA125(免疫組化染色,×200)
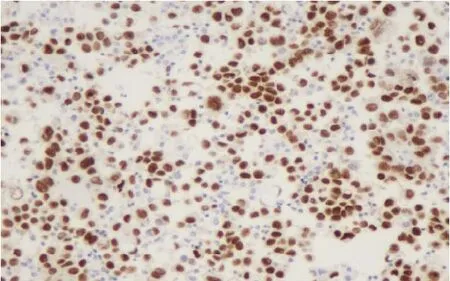
圖 9 12%甲醛固定 wT-1(免疫組化染色,×200)
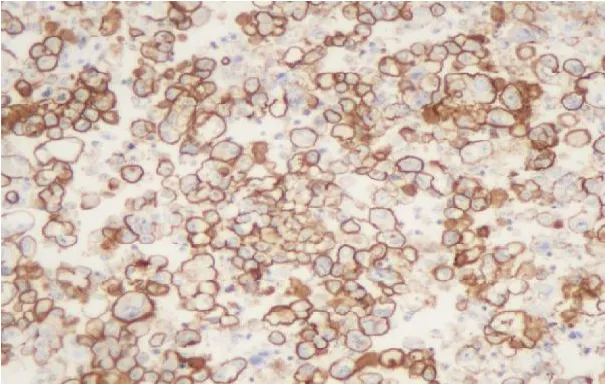
圖10 95%乙醇固定CA125(免疫組化染色,×200)
圖 11 95%乙醇固定 w T-1(免疫組化染色,×200)

