星點設計-效應面法優化鹿角多肽酶解工藝
王平,張會敏,李剛,孫鐵鋒,秦文,劉凡杰
(1.天津大學精密測試技術及儀器國家重點實驗室,天津 300072;2.山東省中醫藥研究院,山東 濟南 250014;3.山東大學校醫院,山東 濟南 250012;4.山東省醫藥生物技術研究中心,山東 濟南 250062)
鹿角膠是一種名貴中藥材,始載于《神農本草經》,列為上品,稱之為白膠[1],具有補血、益精等功效。鹿角膠作為鹿角的主要提取物,藥用已近兩千年,《本草圖經》記載“鹿,年歲久者,其角堅好,煮以為膠,入藥彌佳”[2]。鹿角膠中含有豐富的蛋白質,高達82.49%[3],臨床療效十分顯著。但由于其蛋白質分子量較大,嚴重降低了鹿角膠的利用率[4-5]。因此,急需提高鹿角膠的生物利用度,以便充分開發利用名貴中藥資源,更好地為人類健康服務。
由于多肽結構比蛋白質簡單,易被吸收且具低過敏性,被廣泛應用在臨床上,并為機體提供營養。近年來,多肽的生理功能愈來愈受到重視[6-7]。鹿角多肽是從鹿角中分離得到的一類分子量在0.2~10 kDa之間的具有生物活性的多肽[8]。鹿茸、鹿角分別是梅花鹿或馬鹿鹿角的未骨化的幼角、已骨化的角或角基,是不同生長期的鹿角。與大量文獻報道的鹿茸多肽相關研究[8-10]相比,對鹿角多肽的文獻報道尚不多見,且已有文獻多以水解度、多肽得率評價鹿茸多肽的制備工藝。本文在前期研究的基礎上[11],以酶用量、底物濃度、溫度為自變量,多肽含量及峰面積總和為因變量進行星點設計試驗,建立了一個可行、科學的制備方法,為鹿角多肽的深度研發提供技術支撐。
1 材料
ZX-002紫外分光光度計(日本島津公司);Waters 2965高效液相色譜儀(美國Waters 公司);KDM型控溫電熱套(鄄城華魯電熱儀器有限公司);BP211D賽多利斯電子分析天平(德國SARTORIUS公司);HHS6數顯恒溫水浴鍋(金壇市醫療儀器廠);LGJ-10冷凍干燥機(盛超科創(北京)生物科技有限公司);-80 ℃冰箱(美國FOMAS公司)。
鹿角膠是由鹿角片經水煎煮、濃縮制成的固體膠,鹿角片(批號:150470,河北亞寶藥業有限公司)經山東省中醫藥研究院中藥資源研究室鑒定為馬鹿正品,制法和鑒別按照2015年版中國藥典“鹿角膠”[1]項下進行。胃蛋白酶(批號:O1202A,美侖生物);細胞色素C(Mr12500)、抑酞酶(Mr6500)、桿菌酶(Mr1450)、乙氨酸-乙氨酸-酪氨酸-精氨酸(Mr451)、乙氨酸-乙氨酸-乙氨酸(Mr189);結晶牛血清清蛋白(BSA,純度為98%)、硫酸銅(CuSO4·5H2O)、酒石酸鉀鈉(KNaC4H4O6·4H2O)、10% NaOH溶液、無水醋酸鈉、冰乙酸、乙腈、甲醇等。
2 方法與結果
2.1 鹿角多肽的制備
稱取適量的鹿角膠粉末、胃蛋白酶,置于50 mL三角瓶中,加乙酸和乙酸鈉緩沖溶液調節至要求的pH,超聲震蕩溶解后,置于恒溫水浴鍋中,調至酶解溫度進行酶解;酶解結束后,直接加熱至95 ℃滅活,保持5 min,8 000 r/min離心10 min,分離上清液即得鹿角多肽酶解液。
2.2 HPLC法檢測鹿角多肽含量
2.2.1 對照品配制
精密稱取細胞色素C、抑酞酶、桿菌酶、乙氨酸-乙氨酸-酪氨酸-精氨酸、乙氨酸-乙氨酸-乙氨酸適量,用流動相配置成質量分數0.1%的不同相對分子量的肽標準品溶液,備用。
2.2.2 樣品制備
取200 μL鹿角多肽酶解液,加純凈水稀釋至2 mL,混合均勻,用微孔濾膜過濾(0.2 ~0.5 μm聚四氟乙烯或尼龍過濾膜),即得鹿角多肽待測樣品。
2.2.3 色譜條件

2.2.4 方法學考察
對混合對照品分別進行了精密度(進樣6針)、重復性(混合對照品6份)、穩定性試驗(0、2、4、6、12、24 h),測定峰面積,相對標準偏差均小于3%,說明系統適應性良好。
2.2.5 樣品的檢測與分析
將樣品的色譜圖與標準曲線中5種標準物質(細胞色素C、抑酞酶、桿菌酶、乙氨酸-乙氨酸-酪氨酸-精氨酸、乙氨酸-乙氨酸-乙氨酸)進行出峰時間對比分析,見圖1。然后用GPC數據處理軟件,將樣品的色譜數據代入校正曲線方程中進行計算,即可得到樣品中肽的相對分子質量及其分布范圍。用峰面積歸一化法計算鹿角多肽相對峰面積百分比之和。

1 細胞色素C;2 抑酞酶;3 桿菌酶;4 乙氨酸-乙氨酸-酪氨酸-精氨酸;5 乙氨酸-乙氨酸-乙氨酸圖1 鹿角多肽HPLC圖譜Fig.1 HPLC chromatogram of Antlers polypeptide
2.3 雙縮脲法測定鹿角多肽含量
2.3.1 標準品制備
取標準的結晶牛血清白蛋白(BSA,純度為98%),用H2O 配制成10.8 mg/mL的標準蛋白溶液。
2.3.2 雙縮脲試劑配制
稱取1.50 g硫酸銅(CuSO4·5H2O)和6.0 g酒石酸鉀鈉(KNaC4H4O6·4H2O),用500 mL水溶解,在攪拌下加入300 mL 10% NaOH溶液,用水稀釋到1 000 mL,配制成雙縮脲試劑。
2.3.3 標準曲線的繪制
取12支試管分兩組,分別加入0、0.2、0.4、0.6、0.8、1.0 mL的標準蛋白質溶液,用水補足到1 mL,然后加入4 mL雙縮脲試劑,充分搖勻后,在室溫(20~25 ℃)下放置30 min,于540 nm處進行比色測定,以濃度為橫坐標,以吸光度為縱坐標,制得標準曲線為:y=0.247 2x+0.016 5,R2=0.995 8。
2.3.4 樣品含量測定
取鹿角多肽酶解液適量,用同樣的方法測定,每個樣品平行3次。根據標準曲線,計算得出鹿角多肽含量。
2.4 單因素考察
2.4.1 底物濃度的影響
配置底物濃度分別為0.01、0.03、0.05、0.07、0.09 mg/mL(鹿角膠粉末/溶液體積),酶用量為2.5%,設置酶解時間為6 h,pH 3.5,酶解溫度為40 ℃,酶解。隨著底物濃度的提高,鹿角多肽峰面積在0.08 mg/mL左右達到最高,鹿角多肽含量在0.07 mg/mL左右達到最高,當底物濃度繼續升高時鹿角多肽峰面積、鹿角多肽含量反而下降(圖2)。

圖2 底物濃度與多肽峰面積、多肽含量關系Fig.2 Relationship between substrate concentration and polypeptide peak area and content
2.4.2 酶用量的影響
配置酶用量分別為0.5%、1.5%、2.5%、3.5%、4.5%(酶質量/鹿角膠粉末質量),設置底物濃度為0.05 mg/mL。酶解時間為6 h,pH 3.5,酶解溫度為40 ℃,酶解。隨著酶用量的增加,鹿角多肽峰面積、鹿角多肽含量均出現了先增加再降低,再小幅度增加降低的過程,在1.5%左右達到最高(圖3)。

圖3 酶用量與多肽峰面積、多肽含量關系Fig.3 Relationship between enzyme dosage and polypeptide peak area and content
2.4.3 酶解溫度的影響
配置底物濃度為0.05 mg/mL,酶用量為2.5%,酶解時間6 h,pH 3.5,酶解溫度分別為30、35、40、45、50 ℃,酶解。隨著溫度的升高,鹿角多肽峰面積先增加,并在40 ℃左右達到最高,然后降低后繼續增加(見圖4);鹿角多肽含量在45 ℃左右達到最高,然后略微降低。

圖4 溫度與多肽峰面積、多肽含量關系Fig.4 Relationship between temperature and polypeptide peak area and content
2.4.4 pH 的影響
由于胃蛋白酶在pH 5.0時失活,因此,本文選擇pH 4.5為考察的最大值。配置底物濃度為0.05 mg/mL,酶用量為2.5%,酶解時間為6 h,酶解溫度為40 ℃,pH分別為2.5、3、3.5、4、4.5,酶解。在pH 2.5~3時,鹿角多肽峰面積沒有數據;pH 4.5時,多肽面積最大;鹿角多肽含量在pH 2.5~4.5區間逐漸增大。因此選用pH 4.5為最佳pH(圖5)。

圖5 pH與多肽峰面積、多肽含量關系Fig.5 Relationship between pH and polypeptide peak area and content
2.4.5 酶解時間的影響
配置底物濃度為0.05 mg/mL,酶用量為2.5%,酶解溫度為40 ℃,pH 3.5,酶解時間分別為4、5、6、7、8 h,酶解。隨著時間的增加,多肽峰面積、鹿角多肽含量逐漸增加,7 h后增加緩慢。因此選用7 h作為酶解時間(圖6)。
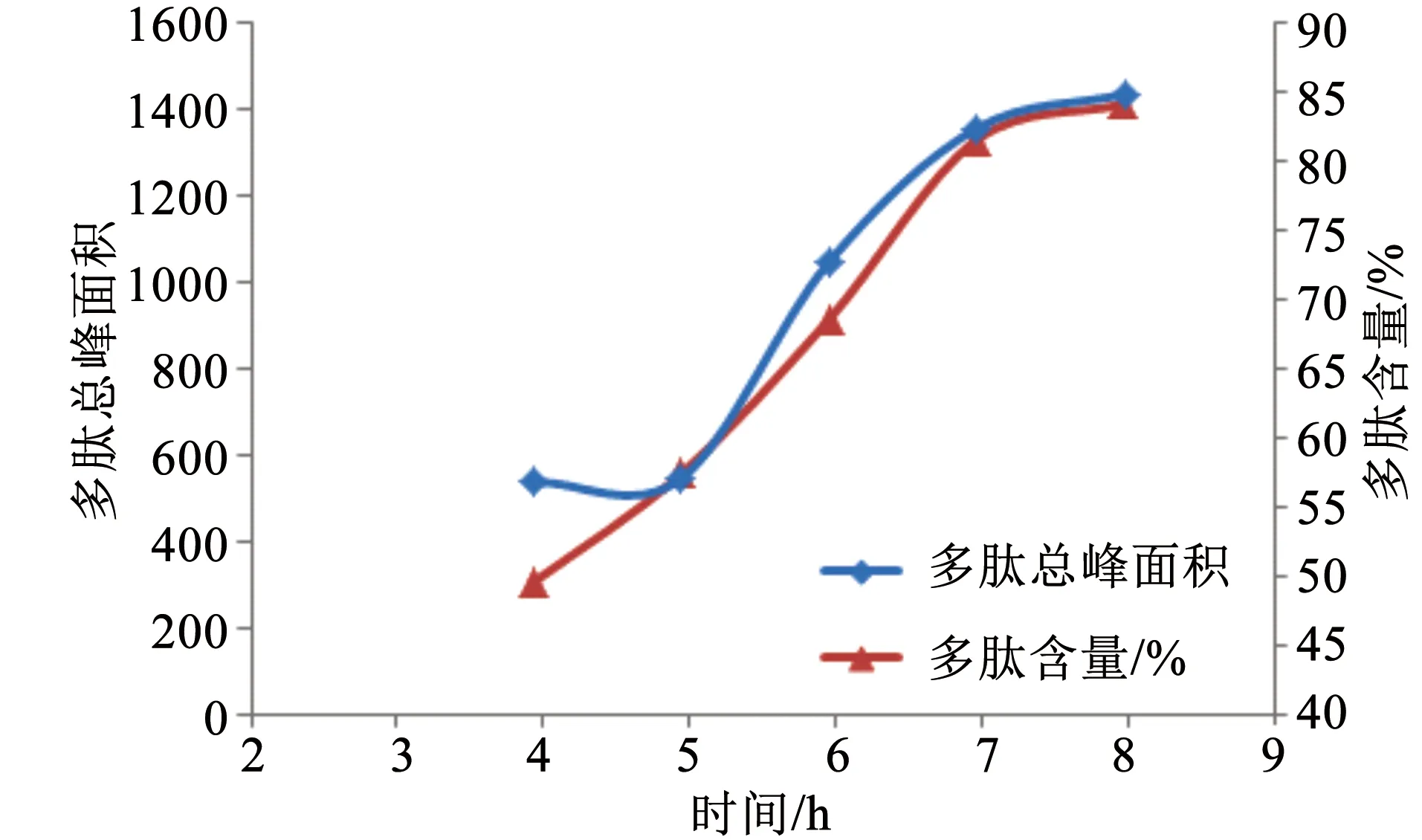
圖6 時間與多肽峰面積、多肽含量關系Fig.6 Relationship between time and polypeptide peak area and content
2.5 星點設計-效應面法優化制備鹿角多肽
2.5.1 因素與水平的確定
采用單因素考察法對鹿角多肽峰面積影響因素進行初步考察,發現酶用量、底物濃度及溫度是最主要的影響因素。因此確定酶用量、底物濃度、溫度為考察因素,3個自變量的取值范圍為酶用量A:1.20%~4.00%,底物濃度B:0.04~0.08 mg/mL、溫度C:30~50 ℃。每個因素設5個水平,試驗安排及結果見表1~2。

表1 因素水平
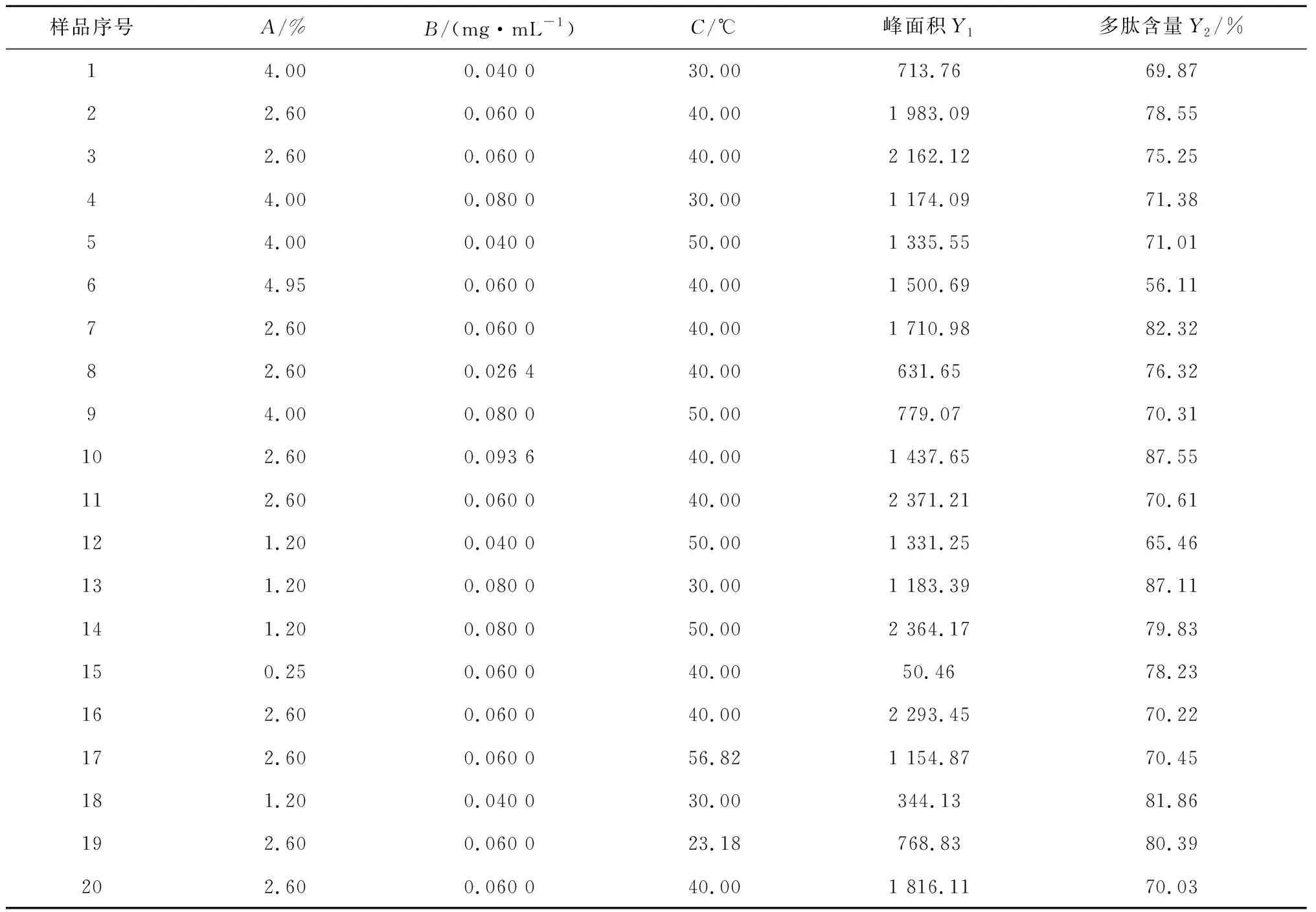
表2 星點試驗設計及結果Table 2 Arrangement and results of central composite design test
2.5.2 模型擬合
采用Design expert 8.0.5軟件對模型數據進行響應面試驗分析,以鹿角多肽峰面積Y1和多肽含量Y2為響應值,分別對酶用量A、底物濃度B、溫度C,進行多元回歸擬合后,得到二項式擬合方程:
Y1= -1.33×104+2.32×103A+1.44×105B+3.57×102C-8.79×103AB-1.73×101AC-5.14×102BC-1.99×102A2-
Y2=1.25×102-2.96×10-2A-5.83×102B-1.32C-8.40×101AB+2.12×10-1AC+4.32BC-1.35A2+6.44×103B2+
2.5.3 方差分析
針對Y1來講,模型F值為3.63,P=0.0285<0.05,表明該模型有顯著性差異。失擬項值為4.9(P=0.0530>0.05),表明模型比較穩定,擬合度良好。其中A、B、C對含量面積無顯著性差異(P>0.05),AB,AC,BC交互相對含量面積均無顯著性差異(P>0.05),A2對含量面積有非常顯著性差異(P<0.01),B2對含量面積有顯著性差異(P<0.05),C2對含量面積有顯著性差異(P<0.05)。
針對Y2來講,模型F值為5.92,P=0.0051<0.05,表明該模型具有非常顯著性差異。失擬項值為0.31(P=0.886 9>0.05),表明模型比較穩定,擬合度良好。其中A、B對多肽含量具有顯著性差異(P<0.01或P<0.05),C對多肽含量無顯著性差異(P>0.05),AB,AC,BC交互相對多肽含量均無顯著性差異(P>0.05),A2、B2對多肽含量有顯著性差異(P<0.05),C2對多肽含量無顯著性差異(P>0.05)。詳見表3

表3 星點設計方差分析
注:*P<0.05,**P<0.01,***P<0.001。
2.5.4 模型擬合
根據已確定的方程為模型,以多肽峰面積值和多肽含量為因變量,繪制效應面的三維圖,見圖7、8。等高線的形狀可反映交互效應的強弱,橢圓形表示二因素交互作用顯著,而圓形則與之相反。結果得到最佳工藝條件:酶用量A為1.78%,底物濃度B為0.08mg/mL,溫度C為39.96 ℃。為了便于實際操作,最終確定的參數為酶用量1.8%,底物濃度0.08mg/mL,溫度40 ℃。
2.5.5 優選工藝驗證
按照酶用量為1.8%,底物濃度為0.08mg/mL,溫度為40 ℃,制備3份鹿角多肽酶解液。鹿角多肽含量實際平均值為82.21%,預測值為83.69%;鹿角多肽峰面積實際平均值為1 880.87,預測值為1 916.68;計算偏差分別為1.77%、1.87%,小于2%,證明所得到的擬合方程可以較好地描述工藝中各因素與評價指標的關系,可見采用星點設計-效應面法預測得到的工藝參數準確、可靠,預測性良好。

圖7 各因素對峰面積影響的響應面Fig.7 Response surface of various factors affecting peak area

圖8 各因素對多肽含量影響的響應面Fig.8 Response surface of various factors affecting polypeptide content
3 討論
本文采用前期研究已建立的HPLC法,對鹿角膠酶解液進行檢測,同時以雙縮脲法對鹿角膠酶解液進行多肽含量測定。由于HPLC色譜峰峰面積的大小直接反映了酶解液中鹿角多肽的相對含量,故本文選取多肽含量及峰面積總和為考察指標(因變量),以酶用量、底物濃度、溫度為自變量進行評判。預測值與實測值的偏差分別為1.77%、1.87%(小于2%),表明本實驗方法簡便合理、穩定,可預測性良好。因此,采用星點設計-效應面法提取鹿角多肽更加科學、穩定,為進一步開展鹿角多肽分離、純化及新藥研發等工作提供了保障。

