黑曲霉誘導子促進青錢柳細胞合成三萜的氧化應激機制
,,,,, ,,,*
(1.江西農業大學食品科學與工程學院,江西南昌 330045; 2.江西省天然產物與功能食品重點實驗室,江西南昌 330045)
青錢柳(Cyclocaryapaliurus(Bata1)Iljinskaja)為我國特有的胡桃科珍稀喬木,多零星分布于我國華南地區,民間常以青錢柳葉制作保健茶。青錢柳葉含有三萜、黃酮、多糖、有機酸、甾醇及生物堿等多種生物活性成分[1],因而具有降糖[2]、降脂[3]、抗癌[4]、抗炎[5]、抗氧化[6]等多種生物活性。2014年,青錢柳被列入新食品原料目錄,引起了科研和生產人員的廣泛關注。但青錢柳繁育困難,資源稀缺,嚴重制約了其開發與利用。本實驗室通過植物細胞培養技術,建立了穩定的青錢柳細胞懸浮培養體系,以此生產三萜酸等活性次級代謝產物,有望解決青錢柳資源匱乏的難題[7]。
誘導子是指能夠促進植物產生一系列防御反應、促進植物防御性次級代謝產物合成的一類觸發因子[8]。研究表明,萜類可作為植物抵御病原體侵害的防御性化學物質,該物質的積累可提高植物對病原體的抵抗作用[9]。熊瓊瓊等[10]在青錢柳細胞培養的第4 d加入真菌誘導子(Aspergillusnigerelicitor,ANE)進行誘導(終濃度為200 μg/mL),3 d后總三萜的含量為對照組的10.21倍,達到49.52 mg/g。由此可見,外源添加ANE可以有效促進青錢柳懸浮培養細胞合成三萜類物質。
本文通過研究ANE作用下青錢柳細胞氧化應激相關酶的表達及其活性變化情況,從氧化應激層面探索ANE促進細胞合成三萜的作用機制,旨在為植物細胞培養生產活性次級代謝物提供參考。
1 材料與方法
1.1 材料與儀器
青錢柳懸浮培養細胞 江西省天然產物與功能食品重點實驗室保存;MS培養基 青島高科園海博生物技術有限公司;甲醇(色譜純) 美國天地有限公司;其余分離用有機溶劑 均為國產分析純;CAT、SOD、POD、PAL、PLC酶活力測定ELISA試劑盒 上海逸晗生物科技有限公司;植物RNA提取試劑盒(Easy Pure? Plant RNA Kit) 北京全式金生物有限公司。
DHG-9101.2S型電熱恒溫鼓風干燥箱 上海三發科學儀器有限公司;SB-3200DTDN超聲波清洗機 寧波新芝生物技術有限公司;DEAAXO4033型高效液相色譜儀 安捷倫科技有限公司;cBot Truseq PE Cluster Kit v3-cBot-HS、Hiseq4000 Truseq SBS Kit v3-HS(200 cycles) Illumina公司。
1.2 實驗方法
1.2.1 青錢柳細胞的懸浮培養 參考熊瓊瓊等[10]的方法。具體操作及條件如下:準確稱取2.0 g濕重的青錢柳懸浮培養細胞,接種至裝有40 mL MS培養液(內含1.0 mg/L激動素(KT)+0.5 mg/L 2,4-二氯苯氧乙酸(2,4-D)+0.3 mg/Lα-萘乙酸(NAA)+30 g/L蔗糖,pH=6.0)的100 mL的錐形瓶中,并置于溫度(28±1) ℃,轉速115 r/min的搖床上進行全暗培養。
1.2.2 黑曲霉誘導子的制備 參照熊瓊瓊等[10]的方法制備黑曲霉誘導子。
1.2.3 黑曲霉誘導子對細胞的誘導 參考熊瓊瓊等[10]的方法。在懸浮細胞接種后第4 d,向培養體系中加入ANE,使得培養體系中ANE的終濃度為200 μg/mL,并收獲誘導不同時間段(0、2、4、6、8、10、12、15、18、21、24、30、36、42、48、54、60、66、72、78 h)的懸浮培養細胞,同時對照組加入與ANE等體積的蒸餾水,每組3個平行。
1.2.4 青錢柳細胞三萜類化合物的提取與檢測 參照Ping等[7]的方法,提取和檢測青錢柳懸浮細胞三萜類物質。HPLC檢測條件如下:色譜柱為Waters C18(4.6 mm×250 mm,5 μm),流動相為0.2%醋酸水(A)和甲醇(B),流速:0.85 mL/min,檢測波長:210 nm,柱溫:40 ℃,洗脫條件為0~10 min,B 0%~82.5%;10~30 min,B 82.5%~90%;30~40 min,B 90%~90%。
1.2.5 氧化應激相關酶的活性測定及分析 粗酶的提取:參考Zhang等[13]的方法。將不同誘導時間點收獲的青錢柳懸浮培養細胞(0、0.25、0.5、1、2、3、4、5、6、7、8、10、12、15、18、21、24、30、36、42、48、54、60、66、72、78 h)進行抽濾,將青錢柳懸浮培養細胞進行抽濾,取鮮重為1 g的青錢柳懸浮培養細胞,加4 mL預冷的磷酸緩沖液(pH=7.0),液氮研磨勻漿,混勻后4 ℃、3000 r/min離心10 min,上清液為粗酶提取液。
酶活的測定:按照試劑盒說明書標明的方法,測定氧化應激相關酶(SOD、POD、CAT、PAL、PLC)的活力。
1.2.6 轉錄組測序分析氧化應激相關基因表達量 按1.2.3方法分別收獲誘導作用不同時間段的新鮮懸浮培養細胞,液氮速凍后置于-80 ℃冰箱中保存備用。分別選取對照組CK(未添加誘導子)、ANE誘導20、60 h后的三個樣品進行轉錄組測序。本試驗中樣品轉錄組測序基于HiSeq平臺,測序試驗采用Illumina TruseqTM RNA sample prep Kit方法進行文庫構建,其操作流程如下:樣品總RNA提取、總RNA質量檢測、cDNA文庫建立、轉錄組測序、轉錄組數據過濾及從頭組裝、相關基因功能注釋。完成上述工作后,利用Bowtie軟件[14]將各個樣品測序得到的Fragments與注釋的相關基因進行分析,利用RSEM軟件[15]對比對結果進行表達量統計,采用FPKM法計算相關基因的表達量。FPKM值(Fragments per kilobase of exon model per million mapped reads,FPKM)是衡量基因表達水平的標準,即每百萬條序列中來自某一基因每千堿基長度的reads數目,具體公式如下:
FPKM=cDNA Fragments/(Mapped Reads(Millions)×Transcript Length(kb))
公式中,cDNA Fragments表示比對到某一轉錄本上的片段數目;Mapped Read(Millions)表示Mapped Read總數;Transcript Length(kb)表示轉錄本長度。采用edgeR軟件對注釋的相關基因進行差異表達分析,獲得不同樣本間表達量不同的差異基因,當相關基因滿足FDR<0.05且log2|FC|≥1條件時,其為差異表達基因(FDR表示錯誤發現率,FC為差異倍數)。
1.3 數據統計與分析
采用Excel和DPS(6.55專業版)統計軟件進行統計分析,每組樣品設置三個重復,每個樣品進行三次平行測定,數據結果以平均值±標準偏差表示。
2 結果與分析
2.1 ANE誘導下青錢柳懸浮培養細胞三萜含量的變化
ANE作用下青錢柳懸浮培養細胞總三萜含量的變化如圖1所示。在接種后第4 d時加入ANE,隨著誘導時間的延長,細胞三萜含量呈先升高后降低的趨勢,而對照組的三萜含量一直處于較為恒定的水平。誘導后10 h三萜含量開始升高,至60 h時達到最高值,含量由12.47 mg/g變為36.46 mg/g,為對照組的3.36倍。根據Yin等[16]的研究,青錢柳懸浮培養細胞中三萜類物質主要為山楂酸、科羅索酸、白樺脂酸、齊墩果酸、熊果酸等五種三萜酸,因此本文采用HPLC法對這五種三萜的含量進行檢測,據此計算三萜總含量。此前有文獻報道,植物受到病原體侵害后,會產生的一類具有生物特異性的次級代謝產物(如三萜類物質),從而提高植物對病原體的防御能力[17]。因此,ANE可能是通過激活青錢柳細胞防衛機制來促進三萜合成的,因此,后續對ANE誘導作用下的抗氧化相關酶的基因表達情況和活性變化進行了研究。

圖1 ANE誘導下青錢柳懸浮培養細胞總三萜含量的變化Fig.1 Changes of total triterpenoids content of the suspended cultured C.paliurus cells under ANE elicitation
2.2 ANE誘導下細胞氧化應激相關酶活性的變化

圖2 ANE誘導下青錢柳懸浮培養細胞SOD酶活的變化Fig.2 SOD acitivity change of suspended culturedC.paliurus cell under ANE elicitation
2.2.2 ANE誘導下POD酶活性的變化 ANE對青錢柳懸浮培養細胞POD酶活性的影響如圖3所示,加入ANE后,細胞內POD酶活力開始升高,在1 h時達到一個峰值,該峰值與SOD的峰值幾乎同時出現,之后迅速下降,在6 h降到最低后又開始迅速上升,并在8 h時又達到一個峰值,之后又分別在21、66 h時出現兩個峰值,且在66 h時達到最大峰值;而對照組POD酶的活性在整個試驗期間內無明顯變化,始終處于較低水平,且比較平穩。POD與CAT是植物體內的重要的氧化還原酶,可以催化H2O2分解,是植物體內清除H2O2的關鍵酶[22-23],該酶的活性變化也可能是對ANE所致的氧化應激的一種保護反應。

圖3 ANE誘導下青錢柳懸浮培養細胞POD酶活的變化Fig.3 POD acitivity change of suspended culturedC.paliurus cell under ANE elicitation
2.2.3 ANE誘導下CAT酶活性的變化 由圖4可知,ANE對胞內CAT酶活力的影響非常明顯,誘導后的酶活明顯高于對照組,而對照組中CAT酶活力未發生明顯變化,一直處于相對較低的水平。加入ANE后,細胞CAT酶活力即開始迅速升高,分別在誘導2、8、24、54及66 h時出現了5個峰值,其中以8 h的峰值比較大。CAT酶活力的變化可能是對添加誘導子所致的高濃度H2O2的保護性反應。

圖4 ANE誘導下青錢柳懸浮培養細胞CAT酶活的變化Fig.4 CAT acitivity change of suspended culturedC.paliurus cell under ANE elicitation
2.2.4 ANE誘導下PAL酶活性的變化 PAL是苯丙烷代謝途徑中的關鍵酶和限速酶,其活性升高可使木質素、木栓質、多酚類物質含量的升高,進而提高自身的抗病或抗逆能力,其中多酚類物質還具有很強的自由基清除能力,能抑制細胞膜脂過氧化,因此植物細胞的抗氧化活性與PAL的活性也有一定關聯[24-25]。ANE對青錢柳懸浮培養細胞PAL酶活性的影響如圖5所示,ANE作用下,PAL酶的活性相對于對照組有明顯的提高,呈先升高后降低的趨勢,分別在7、18及42 h時達到了峰值,其中以42 h時的峰值最大;此后,PAL酶的活性逐漸降低,60 h之后誘導組的活性低于對照組。這可能是因為隨著次級代謝物的不斷積累,過多的次級代謝產物對細胞本身產生了毒害作用,以致細胞通過關閉或降低相應途徑中關鍵酶的合成,來限制次級代謝產物的積累[26]。ANE誘導引起了PAL活力的升高,可能是細胞應對誘導所致的胞內ROS變化的一種保護性反應。

圖5 ANE誘導下青錢柳懸浮培養細胞PAL酶活的變化Fig.5 PAL acitivity change of suspended culturedC.paliurus cell under ANE elicitation
2.2.5 ANE誘導下PLC酶活性的變化 PLC是植物中脅迫信號傳遞的一個關鍵酶,其水溶性產物進入胞內后,激發鈣離子釋放,從而進一步調節鈣離子、鈣調素依賴性酶活性及其相關信號轉導途徑,有研究表明,植物中PLC還可能與ROS的形成有關[27-28]。ANE對胞內PLC酶活性的影響如圖6所示,胞內PLC的活性在添加ANE后的前5 h基本上與對照組相同,之后開始升高,在6 h時出現一個峰值,在第24 h又出現了一個較大的峰值,之后迅速降低,但直至78 h還是明顯高于對照組。
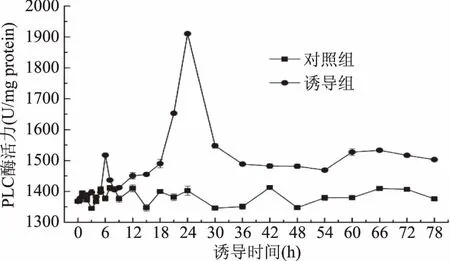
圖6 ANE誘導下青錢柳懸浮培養細胞PLC酶活的變化Fig.6 PLC acitivity change of suspended culturedC.paliurus cell under ANE elicitation
2.3 ANE誘導對胞內氧化應激相關基因表達的影響
ANE誘導作用下,青錢柳細胞內氧化應激相關的5個酶的活性均出現了明顯升高,推測可能是相應基因表達上調所致,在轉錄層面上,植物細胞對于誘導子的響應常常發生于誘導子誘導的中前期,因此,結合ANE誘導后細胞中氧化應激相關酶酶活力及三萜含量的變化,挑選誘導中前期的對照組(CK)、誘導后20 h及誘導后60 h的細胞進行轉錄組測序,分析了誘導后5個酶基因的表達變化情況。在轉錄組注釋到的青錢柳細胞相關基因中,共注釋到了43個POD候選基因、12個SOD候選基因和2個CAT候選基因,其中有20個POD基因在誘導20、60 h后的表達量都發生了上調,且有3個顯著上調;3個SOD基因上調;1個CAT基因表達量顯著上調(如表1所示)。此外,本文在轉錄組測序中還注釋到了6個PAL候選基因與19個PLC候選基因,其中4個PAL基因發生了上調、且有3個顯著上調;7個PLC基因發生了上調,但都不顯著(如表1所示)。以上結果表明,ANE誘導可導致青錢柳懸浮培養細胞產生氧化應激,進而引起氧化應激相關酶的基因表達量的上調,相應的酶活力因此升高。誘導作用下抗氧化系統相關酶活力升高,一方面保護了細胞免受氧化損傷,另一方面也通過信號網絡促進了三萜化合物的合成。

表1 ANE誘導對青錢柳懸浮培養細胞氧化應激相關酶基因表達的影響Table 1 Effects of ANE elicitation on the expression of related genes to oxidative stress
2.4 ANE誘導對胞內三萜合成相關基因表達的影響
在植物當中,萜類合成主要通過兩條途徑進行(圖7),包括甲羥戊酸(MVA)途徑與2-甲基赤蘚醇磷酸(MEP)途徑,上述兩條途徑均以異戊二烯焦磷酸(IPP)及其雙鍵異構體二甲基烯丙基焦磷酸(DMAP)為共同中間產物,合成下游合成途徑中的各種萜類物質,此過程涉及多種萜類合成酶[29]。青錢柳細胞中三萜合成途徑的通量增加,即三萜合成相關酶基因的表達量上調是細胞中三萜含量增加的直接原因。如表2所示,在ANE誘導子的作用下,轉錄組注釋到的35個三萜合成相關酶基因均發生不同程度的差異表達,其中MVA途徑上的相關合成酶基因普遍發生上調,而MEP上游途徑中合成酶相關基因(如DXS、IspD、IspE、IspF、IspG、IspH)的表達則普遍發生了略微下調變化,說明在青錢柳細胞當中,三萜類物質主要是通過MVA途徑進行合成的。結合三萜含量以及氧化應激相關酶活力變化可知,ANE誘導子可激活青錢柳細胞的氧化應激反應,繼而通過信號轉導網絡,促進細胞當中三萜合成酶相關基因的表達,最終促進青錢柳細胞中三萜類物質的積累。
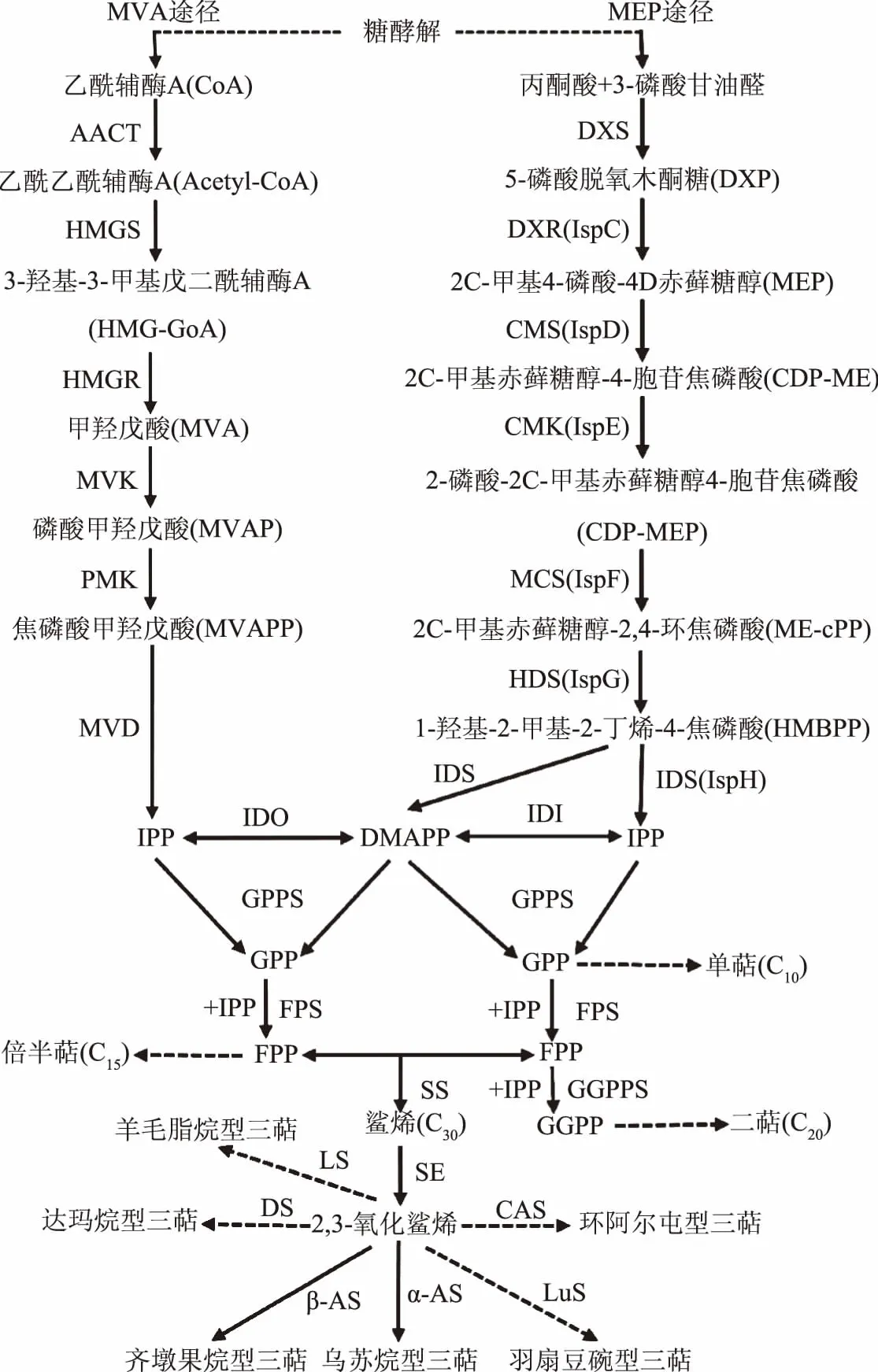
圖7 萜類化合物生物合成途徑Fig.7 Biosynthetic pathway for terpenoids
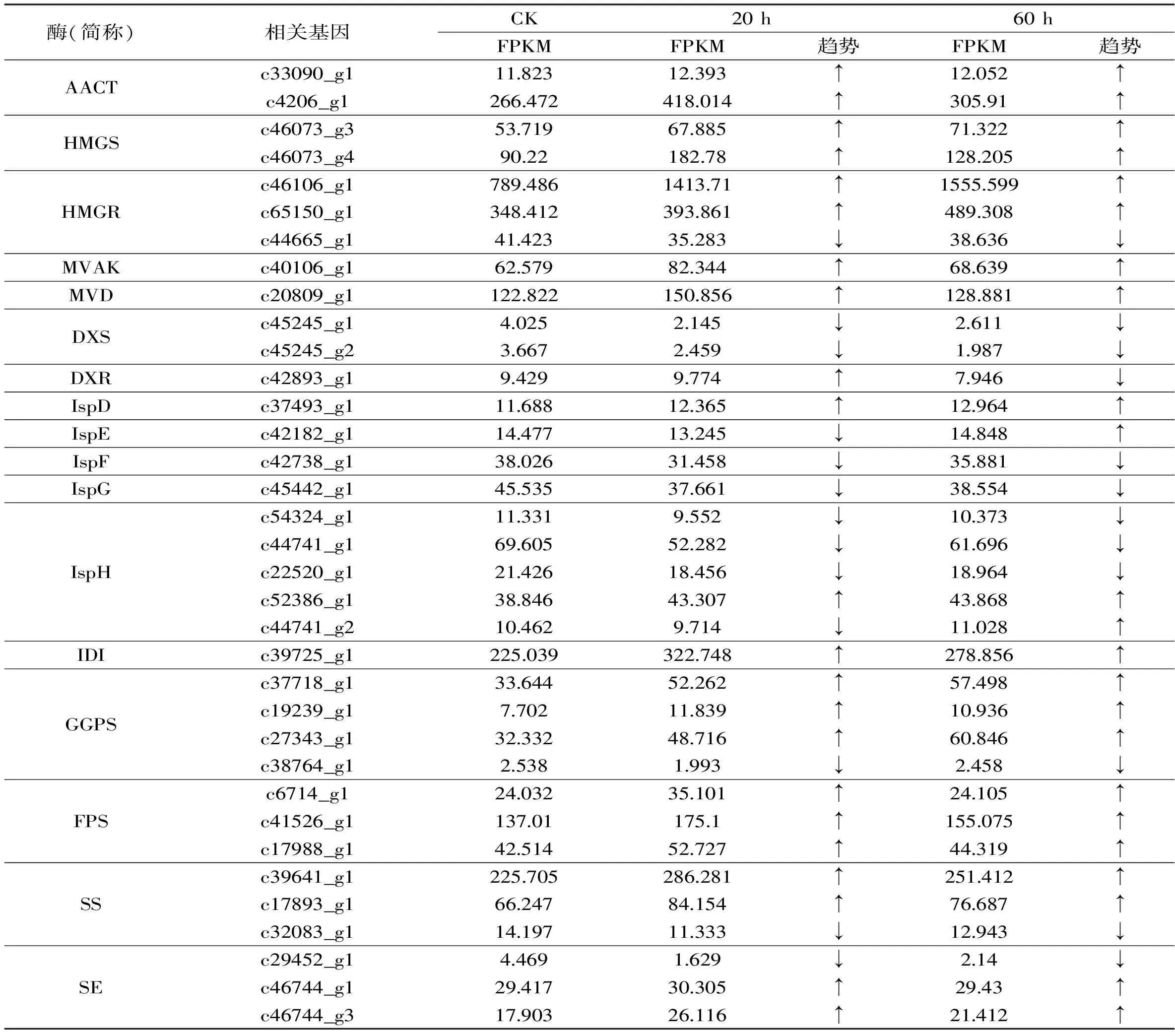
表2 三萜代謝途徑中的差異表達基因Table 2 The differentlly expressed genes of terpenoids biosynthetic pathway
3 討論與結論
植物在遭受逆境脅迫時(如病原體侵染時),細胞內ROS的產生與清除之間的平衡會受到破壞,從而出現ROS的積累。一方面,ROS可直接殺滅侵染植物的病原體,另一方面,ROS又可作為信號分子直接或間接激活某些防衛基因的表達,從而促進植物細胞內防御性次級代謝產物的積累。但過多的ROS會對植物自身造成傷害,因此植物體內有一套完整的氧化與抗氧化的平衡調節系統,即ROS大量積累時,各種抗氧化酶活性也隨之上升[30]。
SOD、POD及CAT是細胞內清除ROS的三種重要的抗氧化酶。張長平等[31]使用真菌誘導子提高了南方紅豆杉懸浮培養細胞中萜類物質(紫杉醇)的含量,其結果表明,PAL、POD、CAT和SOD酶的活力也發生了時序性變化。侯丕勇等[32]發現,真菌誘導子能誘導鐵皮石斛原球莖中LOX、PAL和POD活性的升高,從而提高了總生物堿的含量。翟俏麗等[33]在白樺懸浮培養細胞中添加真菌誘導子誘導1 d后,三萜含量比對照組增長了78%,且在誘導6~10 h內,POD和PAL酶的活性分別是對照組的5.74、5.70倍。

PAL是苯丙烷代謝途徑中的關鍵酶和限速酶,其活性升高可促進植物黃酮、茶醌類色素及木質素類物等物質的積累,繼而增強植物本身的抗氧化、抗病或抗逆能力。本文研究發現,經ANE處理后青錢柳細胞PAL酶的活性顯著提高,在18 h時達到最大,其后又在42 h時,再次上升達到最大峰值,這與劉長軍等[34]報道的ANE作用新疆紫草細胞后PAL酶活性明顯增加的結果相似。
PLC是植物中脅迫信號傳遞的一個關鍵酶,其水溶性產物進入胞內后,激發鈣離子釋放,從而進一步調節鈣離子、鈣調素依賴性酶活性及其相關信號轉導途徑[27]。本實驗發現,添加ANE后,青錢柳細胞PLC的活性明顯提高,這可能是PLC介入了ANE對細胞三萜類物質合成的誘導作用過程,但具體的機制有待于進一步研究。
此外,在轉錄水平上,本實驗表明,在ANE的誘導下,細胞氧化應激相關的5個酶的基因表達量明顯上調,三萜合成途徑中合成酶相關基因表達亦發生上調。由此可見,真菌誘導子是一種能促進青錢柳懸浮培養細胞中三萜類物質積累的誘導因子,在其誘導作用下,青錢柳細胞發生了氧化應激,隨后細胞內信號網絡被激活,繼而促進三萜合成酶相關基因表達發生上調,并最終促進青錢柳細胞當中三萜類物質的積累。

