SHH基因修飾的大鼠鼻黏膜外胚層間充質干細胞向神經樣細胞的誘導分化
畢士奇, 呂德明, 楊開元, 戴瑤, 莊琴, 黃秋生, 張志堅, 崔學文
(1. 江蘇大學醫學院, 江蘇, 鎮江 212013; 2. 江蘇大學附屬醫院血液科, 江蘇 鎮江 212001; 3. 江蘇大學附屬醫院耳鼻咽喉科, 江蘇 鎮江 212001; 4. 江蘇大學附屬醫院骨科, 江蘇 鎮江 212001)
外胚層間充質干細胞(ectomesenchymal stem cells,EMSCs)是來源于胚胎時期神經嵴(neural crest)的一種多能干細胞,主要分布于頭面部黏膜的固有層內。EMSCs不僅保留多向分化潛能而且具有很強的增殖能力[1]。鼻腔黏膜包括呼吸部黏膜和嗅部黏膜,關于嗅黏膜干細胞和嗅鞘細胞修復中樞及外周神經系統損傷的研究較多,并且取得了令人矚目的進展。我們以往的研究發現在大鼠和人的鼻腔呼吸黏膜固有層內廣泛存在EMSCs,該細胞可同時表達神經外胚層干細胞標志蛋白和中胚層干細胞標志蛋白。與嗅鞘細胞比較,鼻呼吸黏膜來源的EMSCs取材更簡便,且不損傷嗅覺功能[2]。EMSCs能夠在體外傳代和擴增,其擴增代數可達10代,擴增的EMSCs 仍可高表達干細胞標志蛋白。
音猬因子(sonic hedgehog, SHH)是胚胎發育過程中產生的一種多功能因子,在調控神經系統分化中發揮重要作用[3]。有關文獻報道,SHH通過Patched-Smoothened-Gli 經典的信號通路,促進神經細胞的突起向 SHH 高濃度區域延伸,并促進神經細胞之間的突觸形成[4]。我們以往的研究表明,聯合使用全反式維甲酸(ATRA)、SHH、人神經營養因子3(NT3)、腦源性神經營養因子(BDNF)等神經營養因子可在體外誘導EMSCs向神經元樣細胞分化[5];然而,誘導過程需要消耗大量的神經營養因子。如果將EMSCs單獨移植到脊髓損傷部位,由于局部缺少高濃度的SHH等神經營養因子,EMSCs的增殖分化能力有限,將影響其修復神經損傷的效率。為了提高脊髓損傷部位SHH濃度,我們課題組選用殼聚糖納米顆粒作為載體,以京尼平為交聯劑交聯SHH,然后將SHH緩釋納米顆粒移植至大鼠脊髓損傷處,可促進脊髓損傷修復[6]。由此說明,維持脊髓損傷部位SHH濃度有利于神經再生。
目前中樞神經系統損傷最佳的治療方法仍是細胞移植[7]。如何在體外尋找與神經組織生物相容性好,可分泌神經營養因子并可自身分化為神經細胞的種子細胞,已成為目前神經科學領域的研究熱點。本研究中用SHH基因轉染EMSCs,使其能自分泌SHH,并提高其向神經細胞分化的能力。如將該細胞移植到脊髓損傷部位,其既可分泌SHH維持脊髓損傷部位SHH濃度,促進損傷神經的再生,又可誘導自身分化為神經細胞參與神經組織修復。
1 材料與方法
1.1 動物與試劑
清潔級SD大鼠,50~150 g,雌雄不限,由江蘇大學實驗動物中心提供(合格證號:2211615001)。DMEM/F12培養基、胎牛血清、Neurobasal培養基及B27(美國Gibco 公司);胰蛋白酶、ATRA、兔抗Smoothen抗體(美國Sigma公司);兔抗巢蛋白、兔抗Connexin-43、兔抗軸突膜蛋白(GAP-43)、兔抗髓鞘堿性蛋白(MBP)、小鼠抗波形蛋白、小鼠抗膠質纖維酸性蛋白(GFAP)、Cy3和488偶聯抗兔、抗小鼠和抗山羊IgG抗體購自博士德生物工程公司;山羊抗SHH和小鼠抗β-3微管蛋白(TUBB3)抗體(美國R&D公司)。SHH-GFP基因重組腺病毒的構建由長沙盈潤公司提供技術支持。SHH-GFP引物設計如下,ShhN-gfp-f:AAAGAATTCGCCACCATGCTGCTGCTGCTGGCCAGATGT; ShhN-gfp-r:AAAGAATTCAGATTTGGCCGCCACGGAGTTC。
1.2 SD大鼠EMSCs的分離、培養和純化傳代
頸椎脫臼法處死SD大鼠,頭面部用碘伏滅菌后,無菌條件下經鼻孔沿鼻腔向上至內眥部剪開皮膚及鼻骨,顯露鼻腔,取出鼻中隔中下部分置于DMEM/F12中,剝離全層鼻黏膜,棄去鼻中隔軟骨[8]。PBS漂洗剝離黏膜組織,去除血液。用眼科剪充分剪碎黏膜組織,0.25%胰酶37 ℃消化15 min,置于10% 胎牛血清的DMEM/F12終止消化,離心去上清液。將沉淀的組織塊和細胞用10% 胎牛血清的DMEM/F12吹散,接種于培養瓶,置于37 ℃、5% CO2、95%濕度細胞培養箱中培養;7 d 后將培養基和懸浮的組織吸出棄去,并補充新的培養基,每3天換液1次,當細胞密度達80%時進行消化、傳代。
1.3 SHH基因重組腺病毒轉染EMSCs
將上述第3代EMSCs接種于96孔培養板和6孔培養板內,同時加入濃度為1%的293A細胞擴增的SHH基因重組腺病毒液(具體方法略),培養3 d后熒光顯微鏡觀察轉染情況,當轉染率達85%時,用4 ℃預冷的4%多聚甲醛固定96孔板內細胞,對未轉染的細胞(EMSCs)及SHH基因轉染的細胞(SHH-EMSCs)進行免疫熒光染色。用蛋白質印跡法檢測6孔板內EMSCs及SHH-EMSCs細胞內的SHH表達水平和培養液中的分泌型SHH的相對含量。
1.4 免疫熒光染色檢測SHH-EMSCs干細胞標志蛋白
將上述4%多聚甲醛固定的EMSCs及SHH-EMSCs用PBS清洗3次,用0.3% Triton X-100 37 ℃孵育30 min,3% BSA 37 ℃孵育1 h,分別加入巢蛋白、波形蛋白、 Connexin- 43抗體(稀釋比為1 ∶100)。對照孔加入PBS, 4 ℃孵育8 h,PBS洗3次,加入和第一抗體相應的Cy3標記的第二抗體,37 ℃孵育2 h,PBS清洗,DAPI染核后甘油封片,用熒光顯微鏡(Zeiss Axio Observer; GmbH, 德國)觀察拍照。
1.5 蛋白質印跡法檢測細胞及培養液中的SHH蛋白
蛋白樣品的收集方法如下:用50 μL RIPA裂解液(含1 μL復合蛋白酶抑制劑)4 ℃裂解6孔板內的細胞10 min,加入等量電泳上樣緩沖液混勻后100 ℃煮沸冷卻后-80 ℃冷凍備用;收集6孔板內培養基上清液,-20 ℃冷凍后,置于-80 ℃冷凍干燥機中干燥,稱取10 mg的凍干粉加入50 μL PBS(含1 μL復合蛋白酶抑制劑),溶解后加入等量的電泳上樣緩沖液混勻后100 ℃煮沸冷卻后-80 ℃冷凍備用。蛋白質印跡步驟如下:制備10%的分離膠和5%的積層膠, 以4 μL每泳道上樣, 電泳, 轉膜,脫脂奶粉封閉1 h,用山羊抗SHH一抗37 ℃孵育2 h, TBST洗膜3次,每次5 min, HRP偶聯的二抗孵育1 h, TBST洗膜3次,每次5 min;以ECL-PLUS作為發光劑, 于分子成像系統Typhoon 9400 Imager上掃描蛋白條帶并測定其灰度。細胞內蛋白表達的相對水平選用細胞內骨架蛋白β-微管蛋白作為內參。計算各泳道(各組)SHH蛋白條帶與β-微管蛋白條帶的灰度比值,進行統計學處理。培養基內分泌型SHH含量只作定性觀察(培養基內的β-微管蛋白含量極微不適合作為內參)。
1.6 SHH-EMSCs向神經細胞的誘導分化
誘導分化實驗分為4組:SHH-EMSCs誘導組、SHH-EMSCs正常培養組、EMSCs誘導組、EMSCs正常培養組。誘導組培養液為含5 % 胎牛血清, 2% B27,ATRA 0.5 μg/mL, TSA 20 ng/mL的Neurobasal培養液,對照組培養液為5% 胎牛血清 Neurobasal培養液。將第3代SHH-EMSCs和EMSCs接種于96和6孔板內, 完全貼壁后,加入誘導或非誘導培養基,3 d后均換為10% 胎牛血清 DMEM/F12完全培養基繼續培養4 d。倒置顯微鏡觀察細胞形態的變化。培養7 d后用4 ℃預冷的4%多聚甲醛固定細胞,用GAP-43、TUBB3、MBP、GFAP的抗體對分化細胞進行免疫熒光染色(染色過程同上)。蛋白質印跡測定細胞內GAP-43、TUBB3、MBP、GFAP和Smoothen蛋白表達水平(蛋白收集和測定方法同上)。
1.7 SHH-EMSCs的體內移植
SD大鼠麻醉后顯露T9-L1棘突及椎板,用特制止血鉗咬去T9-T12棘突及椎板。顯露脊髓,刺破硬脊膜,微量注射器吸取20 μL SHH-EMSCs懸液(含1×108個細胞),傾斜60°進針,緩慢注入,注射持續時間為5 min,注射完畢停留5 min退針。術畢,逐層縫合筋膜、肌肉和皮膚。連續肌注青霉素(5萬U/kg)3 d,動物手術2周后用4 ℃預冷的4%多聚甲醛溶液經心臟灌注固定,取出脊髓。用30%蔗糖脫水后進行冰凍切片,片厚20 μm,貼于經多聚賴氨酸處理的載玻片上,2% BSA/0.01% Triton X-100室溫作用30 min,以兔抗TUBB3 抗體(1 ∶200),37 ℃孵育1 h,PBS漂洗3次,然后用Cy3標記的熒光二抗(羊抗兔IgG,1 ∶100) 37℃ 孵育1 h,DAPI染核后,于熒光顯微鏡下觀察細胞在脊髓內存活和分化的情況。
1.8 統計學分析
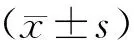
組內采用
LSD-t檢驗,P<0.05 為差異具有統計學意義。
2 結果
2.1 SHH基因轉染后EMSCs向神經細胞誘導分化的形態學觀察
SHH-EMSCs誘導組培養48 h后, 即可見部分細胞的胞體變圓,兩極可見短突起;培養3 d后部分細胞呈多極化。 培養7 d后,EMSCs誘導組可見很少量的神經樣細胞,SHH-EMSCs誘導組可見較多神經樣細胞。培養14 d后(圖1),SHH-EMSCs誘導組出現較多數量的雙突起、多突起等多種形態的神經樣細胞,部分突起可連接成網狀;EMSCs誘導組出現少量神經樣細胞;EMSCs正常培養組未見明顯細胞形態學改變。

圖1 誘導14 d后各組細胞形態觀察(倒置顯微鏡×100)
2.2 SHH-EMSCs的干細胞標志蛋白及SHH蛋白的表達
原代EMSCs培養3 d,部分細胞開始貼壁生長。繼續培養3 d后,貼壁細胞生長較快。培養至第10 d可見大部分細胞呈魚群樣;免疫熒光染色結果顯示EMSCs表達巢蛋白、波形蛋白和Connexin-43,且表達率高達85%(圖2)。經SHH基因轉染的EMSCs形態無明顯變化;免疫熒光染色結果顯示SHH-EMSCs仍然高表達巢蛋白、波形蛋白 和Connexin-43, 且表達率高達90%(圖3);免疫印跡數據顯示SHH-EMSCs的SHH表達水平明顯高于EMSCs(圖4A),并且SHH-EMSCs培養基上清液中可檢測到分泌型的SHH(圖4B)。
2.3 SHH-EMSCs向神經細胞誘導分化的驗證
2.3.1 免疫熒光染色結果 對4組細胞進行免疫熒光染色,可觀察到SHH-EMSCs誘導組GAP-43、TUBB3、MBP和Smoothen蛋白呈強陽性,GFAP表達陰性(圖 5)。同等曝光量的條件下其他3組細胞GAP-43、TUBB3、MBP、GFAP和Smoothen蛋白的表達均為陰性(染色結果未列出)。

圖2 EMSCs的巢蛋白、波形蛋白及Connexin-43蛋白表達(免疫熒光染色×100)

圖3 SHH-EMSCs的巢蛋白、波形蛋白及Connnexin-43(免疫熒光染色×100)

A. 細胞內SHH蛋白,a:P<0.05,與EMSCs組比較;B. 培養上清液中SHH蛋白
圖4蛋白質印跡檢測SHH蛋白表達

圖5 免疫熒光檢測SHH-EMSCs誘導組神經細胞分化標志蛋白(×100)
2.3.2 蛋白質印跡結果 SHH-EMSCs誘導組的GAP-43、TUBB3、MBP和Smoothen蛋白表達水平明顯高于其他3組(均P<0.01);EMSCs誘導組與兩組未誘導組對比無統計學意義;GFAP在4組細胞中的表達水平均較低且差異無統計學意義(圖6)。


b: P<0.01,與其他3組比較
2.4 SHH-EMSCs在大鼠脊髓內的存活及分化情況
SHH-EMSCs移植至脊髓內2周,可見SHH-EMSCs依然存活且已遷移一段距離,并分泌SHH-GFP融合蛋白(綠色熒光顆粒),移植細胞表達神經細胞標志蛋白TUBB3(紅色熒光),白色箭頭所示(圖7)。
3 討論
EMSCs是分布于頭面部的特殊類型的MSCs,起源于胚胎時期的神經嵴,EMSCs取材簡便、體外增殖能力強,具有多向分化潛能[9]。體外培養的EMSCs可定向誘導為成骨細胞、脂肪細胞和神經元樣細胞[10]。將EMSCs在體外誘導成雪旺樣細胞,與神經球樣細胞搭載Firbrin膠共同移植到脊髓損傷模型的SD大鼠體內,顯示EMSCs可促進神經再生,提示該細胞在中樞神經系統疾病細胞治療方面具有良好的應用前景[2]。

圖7 SHH-EMSCs細胞體內存活及TUBB3蛋白的表達(免疫熒光染色×100)
SHH是哺乳動物信號通路家族中的3種蛋白質之一,它不僅是調節脊椎動物器官發生的形態形成因子, 而且在神經系統的發生和分化過程中具有重要作用[11]。大量研究表明SHH可促進神經干細胞分化為多巴胺能神經元[12];陳謙等[13]利用SHH聯合NT-3成功誘導骨髓間充質干細胞向神經元樣細胞分化;研究發現SHH核心受體BOC通過與ABL和JNK激活的相互作用調節神經元分化和神經軸突生長[14];SHH可促進中樞神經損傷后的修復[15-16]。
本研究結果顯示,SHH基因修飾的EMSCs保留了原有的干細胞特性,并增強了向神經細胞分化的能力。GAP-43參與軸突再生[17], TUBB3是神經元微管家族蛋白[18],GAP-43和TUBB3是經典的神經元細胞表面標志物;MBP是成熟少突膠質細胞標志物并且與髓鞘的脂質膜相互作用而維持髓鞘結構的穩定[19],GFAP是星形膠質細胞標志物[20]。SHH-EMSCs經過ATRA誘導后,其高表達GAP-43、TUBB3和MBP,但GFAP表達較弱,說明SHH-EMSCs具有神經元樣細胞和少突膠質細胞分化的偏向。值得一提的是在本研究中所用的神經誘導培養基,并未加入任何神經營養因子即可實現其神經誘導分化。蛋白質印跡結果表明,SHH-EMSCs細胞中至少存在兩種形式的高濃度SHH,即游離型的SHH和胞內型的SHH。游離型的SHH是EMSCs分泌進入培養基的活性形式,可通過與EMSCs自身或周邊細胞膜上的受體如BOC,Patched/Smoothen 等結合,調節靶細胞的增殖和分化[21-22]。胞內型SHH是EMSCs內的合成和儲存形式[23],SHH-EMSCs細胞裂解液內的高水平SHH表明,通過腺病毒染的SHH基因可在EMSCs內高表達,并能分泌到胞外。體內實驗結果表明移植到脊髓內的SHH-EMSCs可長時間存活,并分泌SHH-GFP融合蛋白。由此提示,SHH-EMSCs移植到脊髓內可提高損傷脊髓局部的SHH濃度,改善脊髓損傷部位的微環境,有利于神經再生。
綜上所述,SHH基因修飾的EMSCs具有較強的向神經樣細胞分化的潛能,有望成為移植治療脊髓損傷的一種新的種子細胞。

