COX-2、MMP-9和VEGF在子宮腺肌病異位內膜間質細胞中的表達及其意義
李燦宇 劉歡歡 王婷婷 陳增鑫 申愛榮 封全靈
鄭州大學第三附屬醫院婦科(鄭州 450052)
子宮腺肌病嚴重危害婦女健康,但仍缺乏有效的臨床治療策略[1]。子宮腺肌病可能具有較為獨特的分子病理學特征[2],了解其發病機制對尋找有效治療策略有重要意義。本課題組前期研究表明COX-2、VEGF、MMP-9表達下降與子宮腺肌病間質細胞凋亡有關[3]。為進一步探討三者與子宮腺肌病發生發展的關系,本研究通過免疫組化研究了子宮腺肌病異位內膜組織中COX-2、VEGF、MMP-9的蛋白表達及相關性,通過分離間質細胞,實時定量PCR(real-time PCR)和western blot方法檢測了子宮腺肌病組織間質細胞中COX-2、VEGF、MMP-9的mRNA和蛋白表達,并觀察了間質細胞中COX-2基因沉默對VEGF、MMP-9的mRNA和蛋白表達的影響,現將結果報告如下。
1 資料與方法
1.1一般資料標本來自2013年12月至2015年12月在鄭州大學第三附屬醫院婦科行腹腔鏡或開腹手術的子宮腺肌病患者,收集在位、異位內膜新鮮組織各30例,選取同期正常內膜新鮮組織10例(排除子宮腺肌病、內膜異位癥及其他婦科良性疾病)作為正常對照,另外收集40例異位內膜組織石蠟包埋標本。全組病例年齡25~54歲(各組間年齡差異無統計學意義),術前3個月無激素使用史,診斷經腹腔鏡、病理診斷證實。手術室中獲取無菌標本后立即置于無菌4℃預冷的含有青、鏈霉素的DMEM/F-12(FD)培養液,1 h內送至實驗室在生物安全柜中進行培養。本研究經鄭州大學第三附屬醫院倫理委員會審議同意,所有標本采集均經患者知情同意。兔抗人多克隆抗體COX-2(12375-1-AP)購自武漢三鷹生物技術有限公司。
1.2方法
1.2.1免疫組化檢測兔抗人多克隆抗體COX-2(12375-1-AP)購自武漢三鷹生物技術有限公司。兔抗人單克隆抗體MMP-9(ZA-0562)和兔抗人多克隆抗體VEGF(ZA-0509)購自北京中杉金橋生物科技有限公司。所有組織標本經石蠟包埋,4 μm連續切片,用蘇木素-伊紅(HE)染色觀察病理變化,用Envision免疫組化二步法檢測蛋白表達情況。嚴格按照試劑盒說明書進行操作,陽性對照切片由試劑公司提供,染色結果陽性。陰性對照用PBS緩沖液代替一抗,染色結果陰性。
1.2.2免疫組化結果判定方法每張切片選10個高倍視野(400倍),根據染色程度及染色范圍來計算評分。按陽性細胞所占百分比評分:無陽性細胞者為0分,1%~25%為1分,26%~50%為2分,51%~75%為3分,76%~100%為4分;按染色強度評分:無著色為0分,淡黃色為1分,棕黃色為2分,棕褐色為3分。以陽性細胞所占百分比與染色強度評分的乘積為總評分,總評分≤6為低表達,總評分>6為高表達。
1.2.3實時熒光定量PCR檢測間質細胞原代培養與鑒定,siRNA轉染復合物制備和瞬時轉染方法見前期研究[3]。提取各組細胞RNA,反轉錄后進行實時定量PCR擴增。反應體系為20 μL,包含SYBR Green Master(ROX)試劑10 μL、上下游引物各 0.6 μL、模板 cDNA 1.0 μL 和 RNase-Free Water 7.8 μL;擴增程序為 95 ℃ 10 min,95 ℃ 15 s,60℃1 min,共40個循環。生成定量標準曲線圖,計算機分析Ct值。計算方法:目的基因的相對定量值 =2-△△Ct。抑制率(%)=(1-干擾組COX-2 mRNA相對表達量/空白對照組COX-2 mRNA相對表達量)×100%。
1.2.4Western blot檢測收集轉染前和轉染48 h后的細胞提取總蛋白,經SDS-聚丙烯酰胺凝膠電泳分離,再轉移至硝酸纖維素膜;用1×PBS配制的5%脫脂牛奶室溫封閉2 h,棄去牛奶,加入一抗兔抗人COX-2、VEGF、MMP-9和鼠抗人β-actin抗體(cell signal technology),于4℃下孵育過夜;PBST洗滌3次,用HRP標記的抗鼠的二抗于室溫孵育2 h后檢測。
1.3統計學方法采用SPSS 19.0統計軟件包對所得數據進行處理。所有計量資料以均數±標準差表示,多樣本均數比較用單因素方差分析(ANOVA),多樣本均數間的兩兩比較采用最小意義差異法(LSD-t檢驗)或Tamhane′s T2法,兩獨立樣本均數之間的比較采用t檢驗。用χ2檢驗分析COX-2、MMP-9和VEGF高表達情況,采用Pearson相關性檢驗進行相關性分析,以P<0.05為差異具有統計學意義。
2 結果
2.1子宮腺肌病異位內膜組織中COX-2、VEGF和MMP-9高表達及其相關性COX-2、VEGF和MMP-9蛋白主要在異位內膜腺體細胞和間質細胞胞漿中表達(圖1),子宮腺肌病異位內膜組織中COX-2、VEGF和MMP-9蛋白高表達率分別為57.5%(23/40)、45.0%(18/40)和37.5%(15/40)。Pearson相關性分析顯示COX-2和VEGF高表達呈顯著正相關(r=0.676,P=0.000),COX-2和MMP-9高表達呈顯著正相關(r=0.457,P=0.003),MMP-9和VEGF高表達呈顯著正相關(r=0.441,P=0.004)。
2.2子宮腺肌病在位、異位內膜和正常子宮內膜間質細胞中COX-2、VEGF和MMP-9 mRNA的相對表達如表1所示,子宮腺肌病患者離體培養的在位、異位間質細胞中COX-2、MMP-9和VEGF mRNA的表達均明顯高于正常對照組(P<0.05),且異位間質細胞中的表達均顯著高于對應在位內膜(P<0.05)。
2.3子宮腺肌病在位、異位內膜和正常子宮內膜間質細胞中COX-2、MMP-9和VEGF蛋白的相對表達如表2所示,子宮腺肌病組患者離體培養的在位、異位間質細胞中COX-2、MMP-9和VEGF蛋白的相對表達均明顯高于正常對照組(P<0.05),且異位內膜間質細胞(ESC)mRNA和蛋白的表達均明顯高于對應在位內膜(P<0.05)。
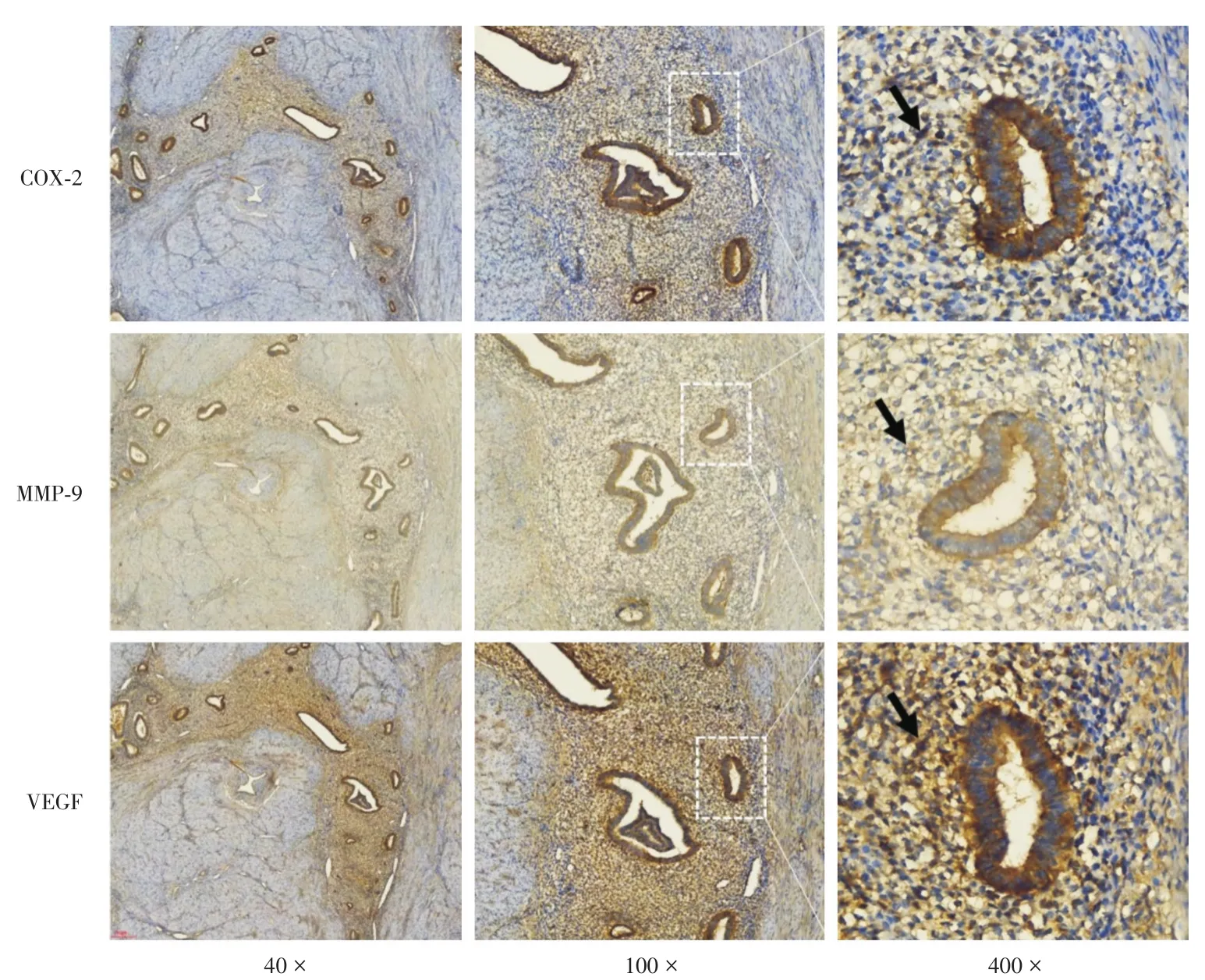
圖1 免疫組化檢測COX-2、VEGF和MMP-9蛋白在異位內膜組織腺體和間質細胞中的表達(Envision二步法,箭頭示間質細胞陽性表達)Fig.1 Expression of COX-2,VEGF and MMP-9 proteins in adenomyosis ectopic endometrium by immunohistochemistry(Envision staining,arrows show positive stromal cells)
表1 子宮腺肌病在位、異位內膜和正常對照組間質細胞中COX-2、MMP-9和VEGF mRNA相對表達(n=10)Tab.1 RelativeexpressionofCOX-2,MMP-9andVEGFmRNA in adenomyosis and control stromal cells(n=10) ± s

表1 子宮腺肌病在位、異位內膜和正常對照組間質細胞中COX-2、MMP-9和VEGF mRNA相對表達(n=10)Tab.1 RelativeexpressionofCOX-2,MMP-9andVEGFmRNA in adenomyosis and control stromal cells(n=10) ± s
注:與正常對照組比較,*P<0.05;與對應在位內膜組比較,△P<0.05
組別異位內膜組*△在位內膜組*正常對照組COX-2 3.460 7±0.312 2.193 3±0.599 1.467 0±1.280 VEGF 3.921 4±0.690 2.654 9±0.628 1.245 3±0.729 MMP-9 2.747 3±0.972 1.557 7±0.590 1.012 5±0.162
表2 子宮腺肌病和正常對照間質細胞中COX-2、MMP-9和VEGF蛋白相對表達(n=10)Tab.2 RelativeexpressionofCOX-2,MMP-9andVEGFproteinin adenomyosis and control stromal cells(n=10) ± s

表2 子宮腺肌病和正常對照間質細胞中COX-2、MMP-9和VEGF蛋白相對表達(n=10)Tab.2 RelativeexpressionofCOX-2,MMP-9andVEGFproteinin adenomyosis and control stromal cells(n=10) ± s
注:與正常對照組比較,*P<0.05;與對應在位內膜組比較,△P<0.05
組別異位內膜組*△在位內膜組*正常對照組0.795 6±0.012 0.694 4±0.016 0.245 3±0.016 0.885 5±0.018 0.782 8±0.015 0.122 6±0.008 0.818 8±0.007 0.712 4±0.129 0.074 0±0.009 COX-2VEGF MMP-9
2.4COX-2基因沉默后子宮腺肌病在位、異位內膜和正常子宮內膜間質細胞中COX-2、MMP-9和VEGF mRNA的相對表達沉默COX-2基因后,與陰性對照組和空白對照組相比,子宮腺肌病在位、異位內膜間質細胞中COX-2、MMP-9和VEGF mRNA的相對表達量均顯著下降,陰性對照組和空白對照組相比差異無統計學意義(表3、4)。
表3 COX-2基因沉默后子宮腺肌病在位、異位間質細胞中COX-2、MMP-9和VEGF mRNA相對表達(n=10)Tab.3 Relative expression of COX-2,MMP-9 and VEGF mRNA in eutopic and ectopic stromal cells of adenomyosis after COX-2 gene silencing(n=10) ± s
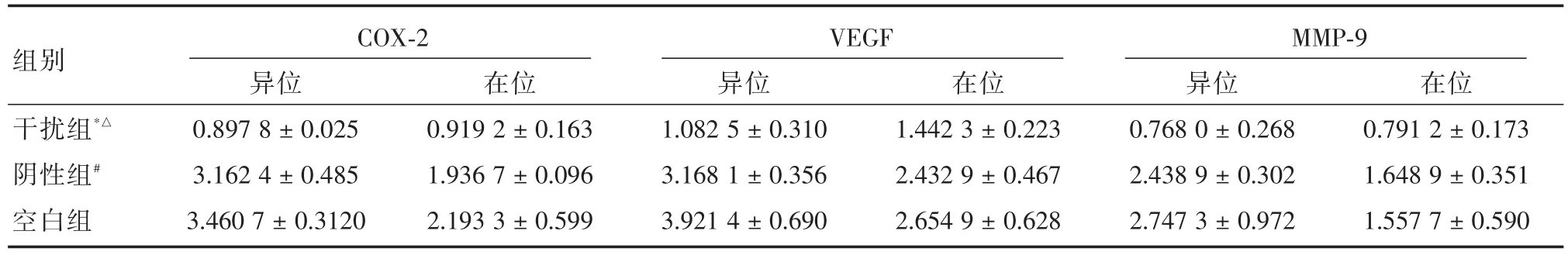
表3 COX-2基因沉默后子宮腺肌病在位、異位間質細胞中COX-2、MMP-9和VEGF mRNA相對表達(n=10)Tab.3 Relative expression of COX-2,MMP-9 and VEGF mRNA in eutopic and ectopic stromal cells of adenomyosis after COX-2 gene silencing(n=10) ± s
注:與陰性組比較,*P<0.05;與空白組比較,△P<0.05,#P>0.05
組別干擾組*△陰性組#空白組COX-2異位0.897 8±0.025 3.162 4±0.485 3.460 7±0.3120在位0.919 2±0.163 1.936 7±0.096 2.193 3±0.599 VEGF異位1.082 5±0.310 3.168 1±0.356 3.921 4±0.690在位1.442 3±0.223 2.432 9±0.467 2.654 9±0.628 MMP-9異位0.768 0±0.268 2.438 9±0.302 2.747 3±0.972在位0.791 2±0.173 1.648 9±0.351 1.557 7±0.590
表4 COX-2基因沉默后各組VEGF、MMP-9 mRNA表達的下降率Tab.4 Decrease rate of VEGF and MMP-9 mRNA in adnomyosis after COX-2 gene slilencing ± s,%

表4 COX-2基因沉默后各組VEGF、MMP-9 mRNA表達的下降率Tab.4 Decrease rate of VEGF and MMP-9 mRNA in adnomyosis after COX-2 gene slilencing ± s,%
注:與對應在位內膜組,*P<0.05
組別子宮腺肌病異位內膜組*子宮腺肌病在位內膜組VEGF 71.80±9.25 42.15±17.69 MMP-9 70.79±8.30 41.50±27.48
2.5 COX-2基因沉默后子宮腺肌病在位、異位內膜和正常子宮內膜間質細胞中COX-2、MMP-9和VEGF蛋白的相對表達沉默COX-2基因后,與陰性對照組和空白對照組相比,子宮腺肌病在位、異位內膜間質細胞中COX-2、MMP-9和VEGF蛋白的相對表達量均顯著下降,陰性對照組和空白對照組相比差異無統計學意義(圖2,表5、6)。
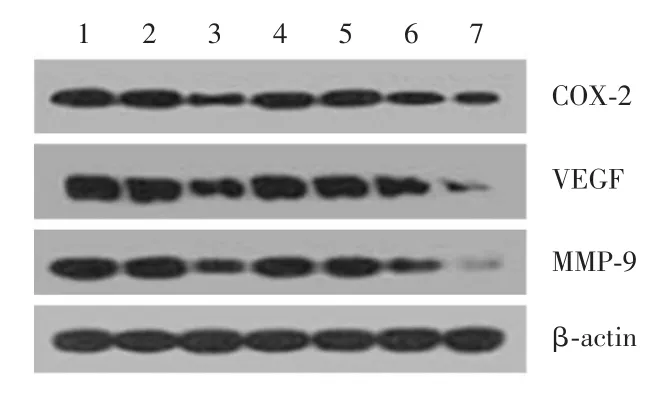
圖2 Westernblot檢測COX-2基因沉默后AM各組及正常對照組ESC中COX-2、VEGF及MMP-9蛋白相對表達Fig.2 Relative expression of COX-2,MMP-9 and VEGF protein in eutopic and ectopic stromal cells of adenomyosis and controls after COX-2 gene silencing detected by western-blot
表5 COX-2基因沉默后子宮腺肌病在位、異位間質細胞中COX-2、MMP-9和VEGF蛋白相對表達Tab.5 Relative expression of COX-2,MMP-9 and VEGF protein in eutopic and ectopic stromal cells of adenomyosis after COX-2 gene silencing ± s
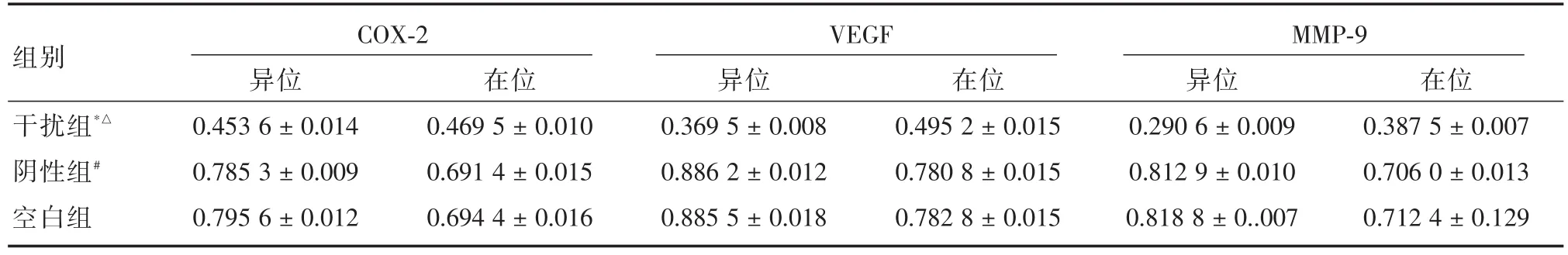
表5 COX-2基因沉默后子宮腺肌病在位、異位間質細胞中COX-2、MMP-9和VEGF蛋白相對表達Tab.5 Relative expression of COX-2,MMP-9 and VEGF protein in eutopic and ectopic stromal cells of adenomyosis after COX-2 gene silencing ± s
注:與陰性組比較,*P<0.05;與空白組比較,△P<0.05,#P>0.05
組別干擾組*△陰性組#空白組COX-2異位0.453 6±0.014 0.785 3±0.009 0.795 6±0.012在位0.469 5±0.010 0.691 4±0.015 0.694 4±0.016 VEGF異位0.369 5±0.008 0.886 2±0.012 0.885 5±0.018在位0.495 2±0.015 0.780 8±0.015 0.782 8±0.015 MMP-9異位0.290 6±0.009 0.812 9±0.010 0.818 8±0..007在位0.387 5±0.007 0.706 0±0.013 0.712 4±0.129
表6 COX-2基因沉默后子宮腺肌病各組VEGF、MMP-9蛋白表達的下降率Tab.6 Decrease rate of VEGF and MMP-9 protein in adnomyosis after COX-2 gene slilencing ± s,%

表6 COX-2基因沉默后子宮腺肌病各組VEGF、MMP-9蛋白表達的下降率Tab.6 Decrease rate of VEGF and MMP-9 protein in adnomyosis after COX-2 gene slilencing ± s,%
注:與對應在位內膜組,*P<0.05
組別異位內膜組*在位內膜組VEGF 58.25±1.53 36.69±3.01 MMP-9 64.50±1.16 45.59±1.75
3 討論
子宮腺肌病是指子宮內膜腺體和間質細胞在子宮肌層彌漫性或局限性生長,引起痛經、月經過多和不孕不育,嚴重影響患者身心健康的一種疾病,其發病機制尚不清楚[4]。目前的研究認為AD發病的分子機制包括5個方面:炎性因子、細胞外基質酶、生長因子、性激素受體及神經血管生成因子[5]。子宮內膜的異位侵襲及血管生成是子宮內膜侵入肌層并生長發育的必備條件,新生血管的形成需要多種血管形成相關因子的協同作用,包括VEGF、COX-2、MMP及血管生成素(angiogenin,Ang)等[6]。其中COX-2、MMP和VEGF分別代表了AD發病機制中的炎性因子、細胞外基質及生長因子三個方面,研究其三者與AD的關系可以進一步探索AD的發生機制,為其靶向治療提供理論基礎。
COX-2為花生四烯酸合成酶的限速酶,可將花生四烯酸轉變為PGE2,PGE2作為芳香化酶P450的誘導因子,可促進E2的合成,E2又可刺激COX-2的合成,故COX-2、PGE2、P450、E2形成了一個惡性循環[7]。在子宮內膜異位癥小鼠模型中抑制COX-2可通過降低PGE2的表達水平,從而抑制VEGF表達影響血管生成[8]。這些研究提示COX-2可能是影響子宮內膜異位疾病發生、發展的重要因子。
VEGF作為最強的血管生成因子,其高水平表達與子宮腺肌病發生關系密切,其高表達的致病機制尚不清楚[9]。雌激素可通過誘導VEGF高表達及血管生成促進子宮腺肌病的發生[10]。MMP-9是一種重要的基質金屬蛋白酶,其高表達與AD的發生密切相關[11],多種信號通路可通過調節MMP-9參與子宮腺肌病的發生[12]。本研究通過免疫組化方法檢測了子宮腺肌病異位內膜組織中COX-2、VEGF和MMP-9蛋白表達,結果顯示三者在子宮腺肌病組織中均呈高表達,且存在顯著正相關。結果提示COX-2可能與VEGF、MMP-9一起共同參與了子宮腺肌病的發生和異位侵襲。
子宮內膜上皮細胞的間質轉化是子宮腺肌病發生的重要分子病理機制,間質細胞增殖和侵襲成為子宮腺肌病發生發展的重要因素[13-14]。子宮腺肌病的內膜異位的發生與腫瘤細胞的惡性侵襲行為類似,有研究表明,在腫瘤細胞中選擇性抑制COX-2表達能顯著改變VEGF和MMP-9表達,并抑制腫瘤發展[15]。本研究通過對間質細胞的分離和鑒定,檢測了間質細胞中MMP-9、VEGF和COX-2的表達情況,結果顯示三者在子宮腺肌病內膜間質細胞中的表達顯著高于正常對照,尤其在異位內膜間質細胞中更為顯著,結果提示三者表達上調可能在間質細胞侵襲中發揮重要作用。而當在子宮腺肌病間質細胞中沉默COX-2基因后,在位、異位內膜間質細胞中VEGF、MMP-9的表達顯著下調,尤其在異位間質細胞中更為明顯。這提示子宮腺肌病間質細胞中COX-2可能是VEGF、MMP-9通路的上游因子,COX-2可能通過對VEGF、MMP-9表達調節參與了該疾病的發生,針對該通路機制有望探索子宮腺肌病新的治療策略。
目前AD的發病病因不明,研究多限于從患者或動物模型中檢測不同因子在AD及對照組織中的表達情況。本研究同時從細胞學及組織學檢測MMP-9、VEGF和COX-2在AD中的表達情況,同時對三者的相互關系進行研究,結果表明三者共同參與了AD發生發展,COX-2可能是AD發病的關鍵因子,有望成為治療AD的分子靶點。本研究病例數也有一定局限性,尚需大樣本量的研究進一步證實。

