microRNA-181b-3p對人膽囊癌細胞侵襲能力的影響
何政 吳慧 鄭軍
三峽大學第一臨床醫學院宜昌市中心人民醫院肝膽胰外科(湖北宜昌443002)
膽囊癌(gallbladder cancer,GBC)是指發生于膽囊及膽囊管的惡性腫瘤,其發病率在消化道腫瘤中位居第六,由于其起病隱匿,易發生轉移,預后極差,患者中位生存期僅有6個月[1]。微小RNA(microRNA,miRNA)是一類長約17~25個核苷酸的短鏈非編碼RNA,通過與mRNA上3′端非翻譯區結合,阻止mRNA翻譯或導致其降解,以此來調控相應蛋白的表達[2-3]。其在免疫調節、細胞分化、腫瘤形成等過程中均發揮著重要的作用[4-5]。目前,miRNA在腫瘤中的作用不盡相同,一些miRNA直接作用于具有促凋亡或抗增殖作用的基因轉錄本而表現出促進腫瘤進展的作用,相反,表現為抑制腫瘤作用的miRNA則被證實能夠抑制控制細胞分化或凋亡的基因的表達[6]。在膽囊癌中,miR-155、miR-20a和miR-182被鑒定為是促進腫瘤進展的調控因子[7-9]。而另一些miRNA如miR-135a、miR-26a以及miR-146b-5p則表現為抑制膽囊癌的發展[10-12]。上皮間充質轉化(epithelial-tomesenchymal transition,EMT)被認為是腫瘤發生侵襲轉移的重要原因[13-14]。有研究表明在乳腺癌中,miR-181b-3p能促進這一過程,并參與腫瘤的侵襲轉移[15]。因此研究miR-181b-3p在膽囊癌中的表達及與EMT的關系至關重要。本研究通過體外細胞學實驗分析miR-181b-3p對于膽囊癌細胞侵襲和遷移能力的影響,揭示miR-181b-3p在膽囊癌細胞侵襲轉移中的作用。
1 材料與方法
1.1組織標本、細胞株來源和制劑人膽囊癌細胞株GBC-SD由華中科技大學附屬同濟醫院膽胰外科實驗室饋贈;人膽囊癌組織及正常組織來自三峽大學第一臨床醫學院肝膽胰外科病區8例膽囊癌患者。所有患者均簽署由醫院倫理委員會批準的患者知情同意書,符合醫學倫理學規定。所有標本均在離體后30 min內置于液氮罐凍存,標本均經過病理學切片確診。DMEM培養基、胎牛血清購自美國Gibco公司;miR-181b-3p的模擬物(mimic,正義鏈為:CUCACUGAACAAUGAAUGCAA)、抑制物(inhibitor,序列為GAGUGACUUGUUACUUACGUU)及對照序列(NC,UUUGUACUACACAAAAGUACUG)由廣州銳博生物科技有限公司負責構建;PCR相關SYBR Premix試劑購自Takara公司;Trizol、Lipofectamine2000購自美國賽默飛公司;Transwell小室及六孔板購自美國Corning公司;Vimentin、E-cadherin、GAPDH抗體購自美國CST公司;Matrigel基質膠購于美國BD公司。
1.2方法
1.2.1細胞培養人膽囊癌細胞系GBC-SD在含10%胎牛血清的DMEM培養基、37℃、5%CO2的條件下,于細胞培養箱中培養,根據細胞生長情況每2~3天更換新鮮培養基或進行細胞傳代培養。
1.2.2PCR檢測正常及膽囊癌組織中RNA表達量充分剪碎組織,每1 mL Trizol加入200 μL,充分震蕩后離心,取上層液相于新的Ep管并加入1 mL異丙醇,離心后棄上清,得到的產物加入1 mL 75%乙醇進行洗滌,離心后得到RNA自然晾干,用無酶水溶解,得到正常及膽囊癌組織RNA。按照逆轉錄試劑盒說明書配置逆轉錄體系(莖環法),用PCR儀按如下條件反應:預變性,95℃,20 s;變性,95 ℃,10 s;退火,60 ℃,20 s;延伸,70 ℃,10 s;40個循環,每個樣本的目的基因與內參基因U6的循環閾值的差異為△Ct,處理組與對照組△Ct的差異值為△△Ct。以2-△△Ct來表示基因的相對表達量,檢測miR-181b-3p在正常及膽囊癌組織中的表達情況。
1.2.3miR-181b-3p模擬物及抑制物的轉染選取處于對數生長期的GBC-SD細胞制備細胞懸液,以密度3.5×105個/mL接種于6 cm培養皿中,待細胞生長至70%左右時,分別將模擬物、抑制物及對照轉染入每個皿中,分別設為miR-181b-3p過表達組、低表達組及對照組。24 h時換液,48 h時提取RNA,通過PCR驗證轉染效率。
1.2.4Trasnwell小室侵襲實驗Matrigel基質膠用無血清培養基按1∶8稀釋,加入小室上室面,于37℃30 min水化基底膜。制備轉染48 h后的GBCSD細胞懸液(用不含血清的培養基重懸),密度為2× 105個/mL,每個小室中加入200 μL,下室加入含10%血清的培養基600 μL,置于培養箱中培養24~36 h后用PBS洗兩遍,4%多聚甲醛固定30 min,0.1%結晶紫染色30 min,用棉簽擦去上室面細胞,顯微鏡拍照并統計。
1.2.5波形蛋白、E-鈣黏蛋白表達測定依據蛋白提取試劑盒說明書提取轉染48~72 h后的GBCSD細胞蛋白,檢測蛋白濃度并計算上樣量,依次進行電泳、轉膜、封閉、一抗4℃孵育過夜、二抗37℃孵育2 h及化學發光等步驟,圖片采用Image Lab軟件分析灰度值。
1.3統計學方法采用SPSS 23.0對實驗數據進行分析、整理。計量資料采用均數±標準差表示,方差檢驗齊性,兩組比較采用t檢驗,Transwell實驗結果3組比較采用單因素方差分析和LSD-t檢驗,以P<0.05為差異具有統計學意義。
2 結果
2.1miR-181b-3p在膽囊癌組織及癌旁組織中的表達PCR結果顯示,8例膽囊癌組織中miR-181b-3p相對表達量(9.22±5.74)明顯高于對應的正常組織(2.54±1.27),差異有統計學意義(t=3.213,P=0.006 3,圖1)。
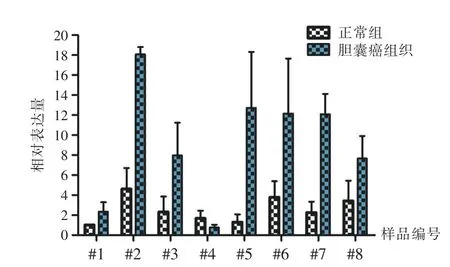
圖1 8例膽囊癌組織及正常組織中miR-181b-3p相對表達量Fig.1 Relative expression of miR-181b-3p in gallbladder carcinoma and paired normal tissues(8 cases)
2.2 細胞轉染效率檢測將構建好的miR-181b-3p模擬物、抑制物及對照分別轉染入GBC-SD細胞系中,48 h后提取RNA并用PCR進行驗證,結果顯示過表達組相對表達量(423.10±77.64)明顯高于對照組的1(t=9.432,P=0.011 1;圖2A);低表達組相對表達量(0.32±0.05)明顯低于對照組的1(t=9.416,P=0.002 0;圖2B),證實其模擬物可以有效增加GBC-SD細胞miR-181b-3p的表達,而抑制物可以有效減低其表達。
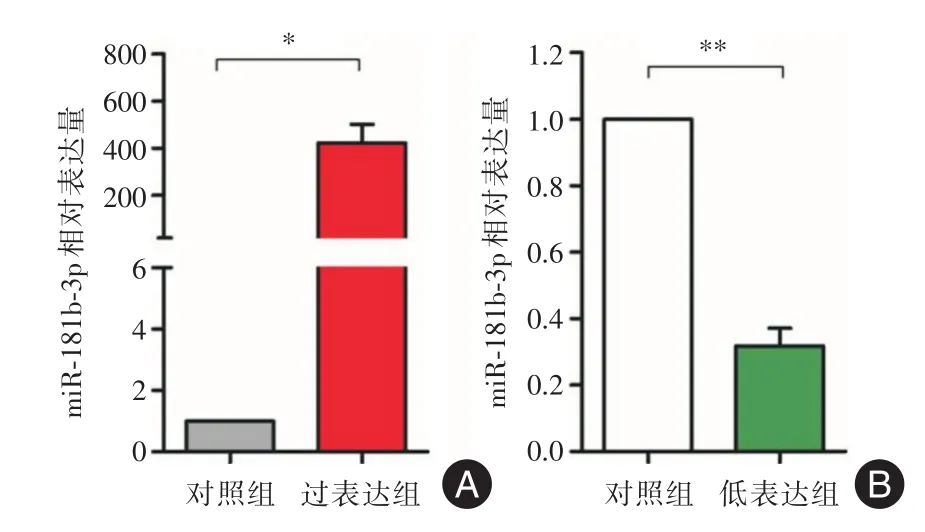
圖2 轉染miR-181b-3p模擬物、抑制物及對照組轉染后GBC-SD細胞中miR-181b-3p的相對表達量Fig.2 Relative expression of miR-181b-3p in GBC-SD cells when transfected with miR-181b-3p mimic,inhibitor and control
2.3 Transwell實驗檢測miR-181b-3p對GBC-SD侵襲能力的影響Transwell實驗結果表明,在膽囊癌細胞系GBC-SD中,過表達組侵襲轉移的細胞數量為(811.40±179.53)個,明顯高于對照組的(231.00 ± 61.22)個(LSD-t=8.357,P=0.000 9);而低表達組侵襲轉移的細胞數量為(28.80±13.81)個,明顯低于對照組的(231.00±61.22)個(LSD-t=2.912,P=0.001 2;圖3)。
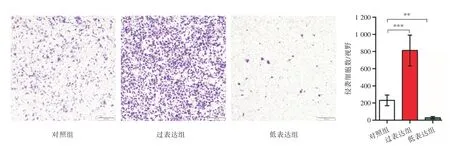
圖3 miR-181b-3p對膽囊癌細胞侵襲轉移能力的影響Fig.3 Effect of miR-181b-3p on invasion of GBC-SD cells(× 100)
2.4 Western blot檢測波形蛋白、E-鈣黏蛋白表達對轉染了miR-181b-3p模擬物、抑制物及對照的GBC-SD細胞進行Western blot檢測,結果顯示相比于對照組過表達組波形蛋白表達增多,E-鈣黏蛋白表達減少;而低表達組波形蛋白表達減少;E-鈣黏蛋白表達增多(圖4)。
2.5 組織中E-鈣黏蛋白與miR-181b-3p表達的相關關系通過對組織中miR-181b-3p與E-鈣黏蛋白表達量的檢測發現,E-鈣黏蛋白的表達與組織中miR-181b-3p的含量呈負相關關系(圖5)。
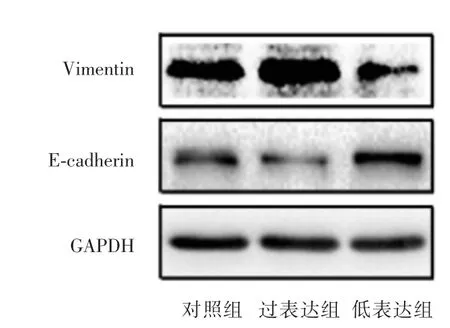
圖4 miR-181b-3p對GBC-SD細胞中波形蛋白、E-鈣黏蛋白表達的影響Fig.4 Effect of miR-181b-3p on the expression of vimentin and E-cadherin in GBC-SD cells
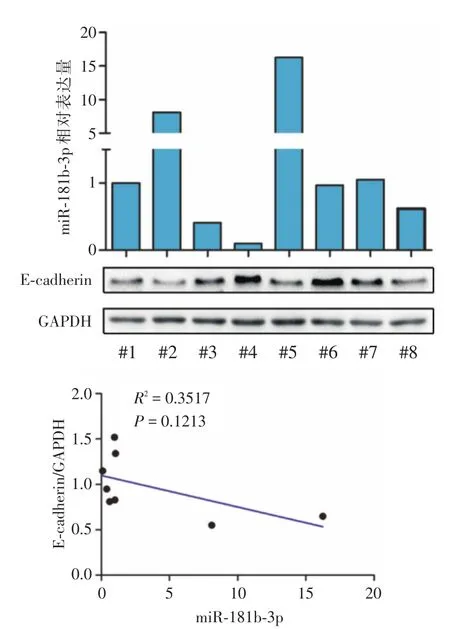
圖5 8例膽囊癌組織中E-鈣黏蛋白表達與miR-181b-3p含量的相關關系Fig.5 Correlation between expression of E-cadherin and miR-181b-3p in gallbladder carcinoma tissues(8 cases)
3 討論
膽囊癌是一類惡性程度極高的腫瘤,其進展隱匿而迅速,易發生侵襲轉移,使得大部分膽囊癌在發現時就已屬于晚期,5年總生存率僅為5%[16]。研究認為,miRNA在癌癥的侵襲轉移過程中起著重要作用[17]。miR-181b-3p定位于人類基因組1號染色體,大小為21 bp,基因序列為CUCACUGAACAAUGAAUGCAA[18]。近年來的研究發現,miR-181家族與白血病、肝癌、前列腺癌、宮頸癌等多種癌癥的發生發展有關[19-20]。在乳腺癌中,miR-181b-3p可能促進了乳腺癌細胞的上皮-間充質轉化,進而增強了其侵襲轉移能力[15]。E-鈣黏蛋白(E-cadherin)等細胞黏附分子表達的減少以及細胞角蛋白細胞骨架轉化為波形蛋白(Vimentin)為主的細胞骨架是上皮-間充質轉化過程的顯著特征[21-23]。本研究通過檢測膽囊癌組織中miR-181b-3p、E-鈣黏蛋白、波形蛋白的表達量,著重探究miR-181b-3p與膽囊癌細胞的上皮-間充質轉化之間的關系及其在膽囊癌侵襲轉移過程中的作用。
本研究通過PCR檢測正常膽囊組織與膽囊癌組織中的miR-181b-3p表達情況,首次闡明了膽囊癌組織中的miR-181b-3p含量明顯高于正常組織。通過構建miR-181b-3p模擬物及抑制物,本研究實現了膽囊癌細胞中miR-181b-3p的上調與下調,并且通過Transwell實驗,進一步證明過表達miR-181b-3p能顯著提高膽囊癌細胞的侵襲轉移能力,而下調miR-181b-3p降低了其侵襲轉移能力。這些結果提示miR-181b-3p在膽囊癌中扮演了促進侵襲轉移的角色。在LIU等[24]的研究中,miR-181b直接作用于HMGB1并且是一個抑制非小細胞肺癌侵襲的調節因子。ZHOU等[25]也發現miR-181b能夠抑制神經膠質瘤細胞的增殖和侵襲。雖然上述研究與本研究結果不同,但是考慮到腫瘤擁有各自獨特的性質,其同一個因子也并非單一調控下游靶基因,因此miRNA對腫瘤侵襲的調控可能會有不同的結果。本研究還證實miR-181b-3p能升高波形蛋白的表達,同時減少E-鈣黏蛋白的表達。通過進一步研究膽囊癌組織中miR-181b-3p與E-鈣黏蛋白的表達情況,發現E-鈣黏蛋白的表達與組織中miR-181b-3p的含量呈負相關關系。這些結果有力證實,miR-181b-3p促進了膽囊癌細胞的上皮-間充質轉化,進而增強了其侵襲轉移能力。
綜上所述,EMT是膽囊癌細胞發生侵襲轉移的重要方式。miR-181b-3p在膽囊癌組織中高表達,其通過促進膽囊癌細胞的上皮-間充質轉化而促進其侵襲轉移。因此干預miR-181b-3p的表達并通過其調控EMT可對腫瘤進展過程產生關鍵性影響,進而可能提高患者生存率。miR-181b-3p在膽囊癌的惡性進展中扮演著的重要調控角色,有望成為膽囊癌診治的靶點之一。遺憾的是,miRNA靶向降解目標基因的RNA從而發揮轉錄后調控的功能,而本研究尚未進行miR-181b-3p靶基因的尋找和其功能的鑒定。miR-181b-3p在調節膽囊癌侵襲發生的機制仍有待進一步闡明。

