植物乳桿菌發酵對獼猴桃抗氧化物質含量及抗氧化活性的影響
張業芳,唐 詩,周 艷*,楊 娜,張清海
(貴州醫科大學 食品安全學院,貴州 貴陽 550000)
獼猴桃(Actinidia)屬于獼猴桃科獼猴桃屬漿果類藤本植物,又名奇異果、楊桃、基維果。其果汁多肉厚,質地柔軟,含有豐富的糖、蛋白質、礦物質、維生素、多酚、黃酮類化合物[1]。研究表明,獼猴桃具有潤腸通便[2]、抑制癌細胞增殖[3-4]、調節脂肪細胞分化[5]等生理功能。因此,獼猴桃成為了消費者日常食用較多的水果之一。近年,我國獼猴桃產業發展迅速,已經成為了世界上獼猴桃種植面積和產量最大的國家,在陜西、四川、貴州、浙江等地形成了一定的產業規模。
獼猴桃屬于典型的呼吸躍變型水果,采摘后容易變軟,甚至失去食用價值,每年由此而造成的損失高達25%[6]。因此,深入研究獼猴桃的營養、保健價值,開發獼猴桃系列健康食品是促進我國獼猴桃產業可持續、健康發展的必由途徑。益生菌發酵果蔬類制品由于能改善新鮮蔬菜的感官特性,并提高果蔬的營養價值,以及良好的健康促進作用[7-8],引起了學術界和市場的強烈關注。研究表明,乳酸菌發酵提供的酸性環境,可以保護維生素不被氧化[9];同時乳酸菌影響果蔬多酚的組成,進而影響果蔬的抗氧化能力[10-11]。DI C R等[12]發現,通過植物乳桿菌(Lactobacillus plantarum)發酵的番茄汁在保藏過程中能維持抗壞血酸含量在120~140mg/L,而直接保藏的番茄汁其含量下降至60~90mg/L;XIAO Y等[13]研究顯示,相比于未發酵的大豆乳清,植物乳桿菌B1-6發酵大豆乳清能提高其總酚酸和異黃酮苷元的含量,提高自由基清除能力,降低脫氧核糖核酸(deoxyribonucleic acid,DNA)的氧化損傷;BISAKOWSKI B等[14]利用植物乳桿菌S1對紅洋蔥發酵72 h,促使槲皮素二糖苷向抗氧化活性更強的槲皮單糖苷的轉化。然而,益生菌發酵對果蔬抗氧化活性變化的機制并不清楚。
因此,本研究以貴州優勢獼猴桃品種——“貴長”為研究對象,在實驗室前期研究得到的植物乳桿菌發酵獼猴桃果漿的最適發酵條件基礎上,分析獼猴桃果漿在發酵過程中總酚酸、總黃酮及維生素C(vitamin C,VC)含量和抗氧化活性的變化,分析抗氧化物質含量與抗氧化活性的相關性,并采用液質聯用(liquid chromatography-mass spectrum,LC-MS)儀測定酚酸和黃酮的組成,探討植物乳桿菌發酵對獼猴桃果漿抗氧化活性影響的因素,同時可以為獼猴桃乳酸菌發酵飲料生理功能的進一步探討提供理論支撐。
1 材料與方法
1.1 材料與試劑
1.1.1 菌株
植物乳桿菌凍干粉:山東中科嘉億生物工程有限公司。
1.1.2 試劑
草酸、碳酸氫鈉、碳酸鈉、無水乙醇、甲酸(均為分析純):天津市科密歐化學試劑有限公司;2,6-二氯靛酚鈉鹽、福林酚試劑、1,1-二苯肼-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH):北京索萊寶科技有限公司;2,2′-聯氮-雙(3-乙基苯并噻唑啉-6-磺酸)二胺鹽(2,2′-azino-bis(3-ethylbenzothiazolin-6-sulfonic acid)diammonium salt,ABTS)(純度≥98%)、抗壞血酸標準品(純度≥99%)、甲醇(色譜純):美國Sigma公司。
1.2 儀器與設備
LT1002C型電子天平:常熟市天量儀器有限責任公司;721型可見分光光度計:上海菁華科機儀器有限公司;Waters Xevo TQ-S Micro三重四極桿LC-MS儀:美國Waters公司。
1.3 方法
1.3.1 植物乳桿菌發酵獼猴桃果漿的制備
按照文獻[15]中植物乳桿菌發酵獼猴桃果漿的最佳工藝條件制備獼猴桃果漿,測定其理化指標(乳酸菌活菌數、總酸含量、pH值)、抗氧化物質(維生素C、總酚酸、總黃酮)含量及其抗氧化活性(DPPH自由基清除能力、ABTS自由基清除能力)、酚酸和黃酮的組成。
1.3.2 理化指標的測定
乳酸菌活菌數的測定:參照國標GB 4789.35—2016《食品微生物學檢驗乳酸菌檢驗》進行測定[16]。
總酸含量的測定:參照國標GB/T 12456—2008《食品中總酸的測定》中酸堿滴定法檢測總酸含量[17]。
pH的測定:采用pH計測定獼猴桃果漿的pH值。
1.3.3 抗氧化物質含量的測定
VC含量的測定:參照國標GB/T 5009.86—2016《食品中抗壞血酸的測定》,采用2,6-二氯靛酚法檢測VC的含量[18]。
總酚酸含量的測定:取10 mL發酵后的獼猴桃果漿樣品,加入30 mL體積分數80%的甲醇,在60℃、450 W條件下超聲20 min,離心取上清,待測。采用福林酚法檢測樣品中總酚酸的含量[19]。以沒食子酸質量濃度(x)為橫坐標,吸光度值(y)為縱坐標繪制沒食子酸標準曲線。標準曲線回歸方程為y=0.009 0x+0.103 5,R2=0.999 4。
總黃酮含量的測定:采用亞硝酸鈉-硝酸鋁比色法測定樣品中總黃酮的含量[20]。以蘆丁質量濃度(x)為橫坐標,吸光度值(y)為縱坐標測繪制蘆丁標準曲線。標準曲線回歸方程為y=0.001 6x+0.005 5,R2=0.999 2。
1.3.4 抗氧化能力的測定
DPPH自由基清除能力的測定參考文獻[19],并稍作修改:取一定量的各處理獼猴桃果漿于4500r/min條件下離心10 min,取上清待測。吸取各待測樣本45 μL,加入5 mL DPPH溶液,漩渦振蕩混勻,37℃條件下避光水浴30 min,在波長517 nm處測定吸光度值,記為A1,同時以45 μL蒸餾水替代樣品作對照,其所測得的吸光度值為A2。DPPH自由基清除率的計算公式如下:

ABTS自由基清除能力的測定參考文獻[19],并稍作修改:取一定量的各處理獼猴桃果漿于4 500 r/min條件下離心10min,取上清待測。吸取各待測樣本50μL,加入5mL ABTS溶液,漩渦振蕩混勻,37℃條件下避光水浴30 min,在波長746 nm處測定吸光度值,記為A1,同時以50 μL蒸餾水替代樣品作對照,其所測得的吸光度值為A2。ABTS自由基清除率的計算公式如下:

1.3.5 多酚組成的測定
分別取發酵前、后的獼猴桃果漿樣品的提取液,經過0.22 μm的有機濾膜過濾后備用。采用LC-MS法測定樣品中的酚酸和黃酮的組成[21]。
液相色譜條件:色譜柱為WatersACQUITYUPLCBEH C18(2.1 mm×100 mm);流動相A為0.25%甲酸水溶液;流動相B為0.25%甲酸-甲醇溶液;流速為0.3 μL/mL;進樣量為10 μL;柱溫為35℃;光電二極管陣列(photo-diode array,PDA)檢測,200~500 nm連續掃描。梯度洗脫程序見表1。
質譜檢測條件:多反應監測(multiple reaction monitoring,MRM)模式,噴霧電壓2.0 kV,錐孔電壓30 V,脫溶劑溫度400℃,脫溶劑氣(N2)1 000 L/h。質譜掃描條件:電噴霧電離(electronic spray ionization,ESI)正離子模式(噴霧電壓3.0 kV,錐孔電壓30 V,脫溶劑溫度400℃,脫溶劑氣(N2)1 000 L/h,掃描范圍100~2 000 m/z);ESI負離子模式(噴霧電壓0.5 kV,錐孔電壓30 V,脫溶劑溫度400℃,脫溶劑氣(N2)1 000 L/h,掃描范圍100~2 000 m/z)。

表1 梯度洗脫程序Table 1 Gradient elution program
采用峰面積歸一化法進行定量,其結果用相對含量(%)表示。
1.3.6 統計學分析
實驗均重復3次,結果以平均數±標準誤差(xˉ±s)表示。采用SPSS 17.0軟件中的單因素方差分析對試驗數據進行處理,數據多重比較采用Turkey法,P<0.05表示差異有統計學意義。采用Person進行相關性分析。
2 結果與分析
2.1 獼猴桃果漿發酵過程中理化指標的變化
獼猴桃果漿經植物乳桿菌發酵后,發酵過程中乳酸菌數、總酸含量和pH值的變化如圖1所示。
由圖1A可知,隨著發酵時間的延長,獼猴桃果漿中植物乳桿菌的含量呈現先降低后增高的趨勢,與發酵0 h相比,發酵7 h時,植物乳桿菌的活菌數(5.82 lgCFU/g)顯著降低(P<0.05),隨后逐漸升高;發酵28 h時,植物乳桿菌的活菌數為9.95 lgCFU/g。由圖1B可知,隨著發酵時間的延長,獼猴桃果漿中總酸的含量逐漸升高,與發酵0 h相比,發酵14 h時,總酸含量顯著升高(P<0.05),為7.97 g/kg;發酵28 h時,總酸含量達到16.18 g/kg。由圖1C可知,隨著發酵時間的延長,獼猴桃果漿的pH值逐漸降低,發酵14 h后,pH值與初始發酵時的pH值呈現顯著差異(P<0.05);發酵28 h時pH值為4.43。發酵初期,植物乳桿菌的含量降低,可能是對發酵體系不適應,經過一段時間的適應后,植物乳桿菌利用體系中營養物質(碳水化合物、蛋白質等)快速增殖,產生乳酸等小分子有機酸,從而使總酸的含量升高、pH值下降。
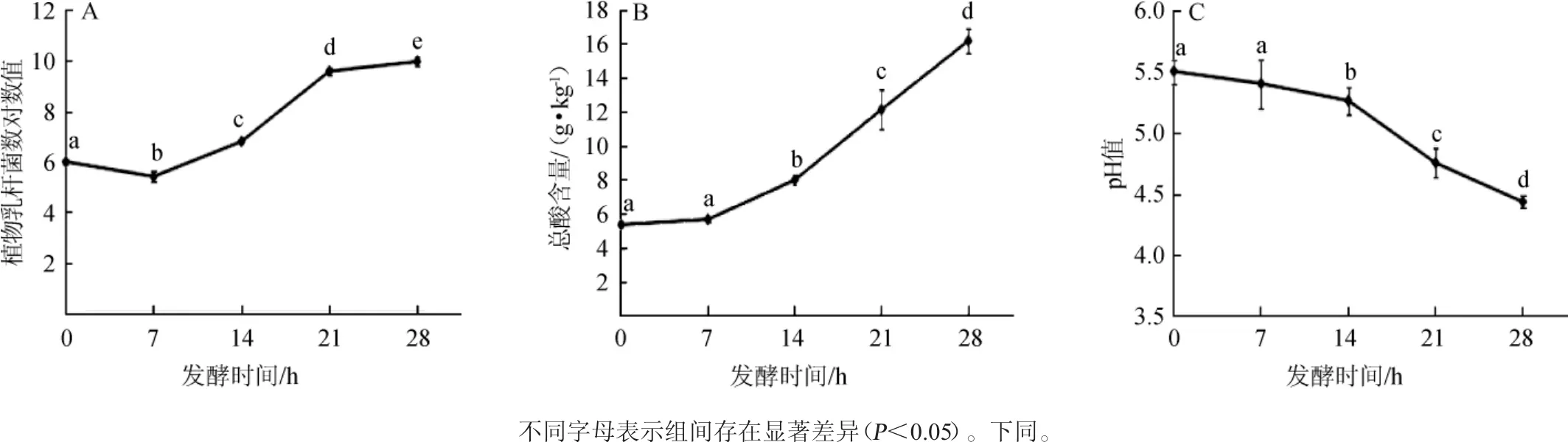
圖1 發酵過程中獼猴桃果漿中植物乳桿菌數(A)、總酸含量(B)和pH值(C)的變化Fig.1 Changes of Lactobacillus plantarumcount(A),total acid content(B)and pH value(C)in kiwifruit pulp during fermentation process
2.2 植物乳桿菌發酵對獼猴桃果漿中抗氧化物質含量的影響
植物乳桿菌發酵對獼猴桃果漿中抗氧化物質含量的影響結果見圖2。
由圖2A可知,與發酵前獼猴桃果漿中的總酚酸含量(103.16mg/100g)相比,發酵14h時,獼猴桃果漿中的總酚酸含量(108.55 mg/100 g)無顯著提高(P>0.05);發酵21 h時,總酚酸含量(150.73mg/100g)顯著提高(P<0.05);發酵28 h時,總酚酸含量上升至168.04mg/100g,較發酵前提高62.89%。
由圖2B可知,隨著發酵時間的延長,獼猴桃果漿中總黃酮的含量呈現先升高后降低的趨勢。與發酵前(21.75mg/100 g)相比,發酵7 h時,總黃酮含量(34.50 mg/100 g)顯著升高(P<0.05);到發酵21 h時,總黃酮含量達到最高,為42.55 mg/100 g;發酵21 h后,總黃酮的含量開始降低;發酵28 h時,總黃酮的含量為36.75 mg/100 g,但仍顯著高于發酵前(P<0.05),較發酵前提高68.97%。結果表明,植物乳桿菌發酵有利于提高獼猴桃果漿中總酚酸和總黃酮的含量,與SZWAJGIER D等[22-23]的研究結果一致。
由圖2C可知,發酵過程中獼猴桃果漿中VC的含量比較穩定,在發酵過程中無顯著差異性(P>0.05)。分析原因可能是乳酸菌代謝產生大量乳酸,降低體系pH值,形成了一個酸性環境,使VC含量相對穩定[9,12]。

圖2 發酵過程中獼猴桃果漿中總酚酸(A)、總黃酮(B)及VC(C)含量的變化Fig.2 Changes of the contents of total phenolic acid(A),total flavonoids(B)and VC(C)in kiwifruit pulp during fermentation process
2.3 植物乳桿菌發酵對獼猴桃果漿抗氧化能力的影響
乳酸菌發酵果蔬對果蔬抗氧化能力的影響比較復雜。PIANPUMEPONG P等[24]發現植物乳桿菌發酵能增強姜黃的鐵離子還原能力,同時降低小鼠血液中自由基數量;DI C R等[25]應用戊糖片球菌(Pediococcus pentosaceus)SWE5和植物乳桿菌FP3混合發酵甜櫻桃果泥,提高了其抗氧化能力;同時也有文獻報道[26-27],乳酸菌發酵能降低果蔬對自由基的清除能力。植物乳桿菌發酵對獼猴桃果漿抗氧化能力的影響結果見圖3。
由圖3A可知,與發酵前獼猴桃果漿的DPPH自由基清除率(46.79%)相比,發酵7 h時,植物乳桿菌對獼猴桃果漿的DPPH自由基清除率(46.33%)無顯著影響(P>0.05);發酵14h時,DPPH自由基清除率(58.13%)顯著提高(P<0.05);發酵28 h時,獼猴桃果漿對DPPH自由基的清除率為75.25%,與發酵前相比提高60.82%。
由圖3B可知,與發酵前獼猴桃果漿的ABTS自由基的清除率(54.60%)相比,發酵7 h時,獼猴桃果漿對ABTS自由基的清除率(51.24%)略微降低(P>0.05);發酵28 h時,其對ABTS自由基的清除能力(69.19%)顯著提高(P<0.05),較發酵前提高了26.72%。由此可知,植物乳桿菌發酵獼猴桃果漿有利于提高獼猴桃果漿的抗氧化能力。

圖3 發酵過程中獼猴桃果漿的DPPH自由基(A)及ABTS自由基(B)清除率的變化Fig.3 Changes of scavenging rate of DPPH free radical(A)and ABTS free radical(B)of kiwifruit pulp during fermentation process
2.4 相關性分析
為了進一步分析植物乳桿菌發酵獼猴桃果漿過程中引起獼猴桃果漿抗氧化能力變化的因素,將自由基清除能力與總酚酸、總黃酮以及VC的含量進行相關性分析。DPPH自由基清除能力與總酚酸、總黃酮以及VC的含量的相關性分析結果見圖4。
由圖4可知,植物乳桿菌發酵后的獼猴桃果漿中總酚酸的含量與DPPH自由基清除能力呈正相關性,R2=0.892,P=0.000;總黃酮含量與DPPH自由基清除能力呈正相關性,R2=0.603,P=0.017;VC含量與DPPH自由基清除能力無相關性。
ABTS自由基清除能力與總酚酸、總黃酮以及VC的含量的相關性分析結果見圖5。

圖4 DPPH自由基清除能力與總酚酸(A)、總黃酮(B)、VC(C)含量的相關性分析Fig.4 Correlation analysis of DPPH radical scavenging capacity with total phenolic acid(A),total flavonoids(B)and VC(C)contents

圖5 ABTS自由基清除能力與總酚酸(A)、總黃酮(B)、VC(C)含量的相關性分析Fig.5 Correlation analysis of ABTS radical scavenging capacity with total phenolic acid(A),total flavonoids(B)and VC(C)contents
由圖5可知,植物乳桿菌發酵后的獼猴桃果漿中總酚酸的含量與ABTS自由基的清除能力呈正相關,R2=0.785,P=0.001;總黃酮含量與ABTS自由基清除能力呈正相關,R2=0.519,P=0.047;VC含量與ABTS自由基清除能力無相關性。
由此得出,植物乳桿菌發酵過程中,獼猴桃果漿的自由基清除能力主要與總酚酸和總黃酮的變化有關。
2.5 植物乳桿菌發酵對獼猴桃果漿酚酸和黃酮組成的影響
經相關性分析,獼猴桃經植物乳桿菌發酵后,影響了總酚酸和總黃酮的含量,而它們的變化與抗氧化能力密切相關,因此通過LC-MS檢測植物乳桿菌發酵前、后獼猴桃果漿中酚酸和黃酮組成的變化,結果如表2所示。
由表2可知,發酵前獼猴桃果漿中共檢測出7種物質,以新綠原酸、兒茶素和咖啡酸為主,占總量的89.5%。獼猴桃果漿經植物乳桿菌發酵后,共檢測出9種物質,新綠原酸、6,7-二羥基香豆素和原兒茶酸相對含量較高,占總量的80.21%。與發酵前相比,咖啡酸未檢出,新增加了6,7-二羥基香豆素、芥子酸、原兒茶酸。分析原因可能是植物乳桿菌在發酵過程中,會產生一些酚酸脫羧酶,使酚類物質之間實現相互轉化,從而改變其抗氧化活性[28]。兒茶素又稱單寧,可在兒茶素加氧酶的作用下代謝生成原兒茶酸和間苯三酚羧酸[29]。ALBERTO M R等[30]研究發現,從葡萄酒中分離的希氏乳桿菌(Lactobacillushilgardii)具有代謝兒茶素和沒食子酸的能力。推測獼猴桃果漿中新檢測出的原兒茶酸可能是植物乳桿菌代謝兒茶素生成的。而芥子酸和6,7-二羥基香豆素如何產生,還值得進一步研究。

表2 植物乳桿菌發酵對獼猴桃果漿中酚酸和黃酮組成的影響Table 2 Effect of Lactobacillus plantarumfermentation on phenolic acid and flavonoids composition in kiwifruit pulp
由此得出,植物乳桿菌可能參與了獼猴桃酚酸和黃酮的代謝轉化,進而引起發酵后獼猴桃果漿抗氧化能力增強。
3 結論
本研究探討了植物乳桿菌發酵對獼猴桃果漿中抗氧化物質含量及抗氧化能力的影響。結果表明,植物乳桿菌發酵過程中,獼猴桃果漿中植物乳桿菌活菌數、總酸含量升高,pH值下降;顯著提高了獼猴桃果漿中總酚酸和總黃酮的含量(P<0.05),進而提高獼猴桃果漿的抗氧化能力;獼猴桃果漿抗氧化能力的變化與總酚酸、總黃酮含量的變化密切相關;植物乳桿菌發酵參與了獼猴桃酚酸和黃酮的代謝轉化,植物乳桿菌發酵后的獼猴桃果漿中新生成了2,6-二羥基香豆素、芥子酸和原兒茶酸。因此,植物乳桿菌發酵提高獼猴桃果漿抗氧化能力,是一種提高獼猴桃營養價值的加工方式。但是,植物乳桿菌發酵對果蔬酚酸和黃酮發生代謝轉化的機制,以及這一變化對果蔬的生物活性產生何種影響并不明確,需要進一步研究。

