PNN在乳腺癌組織中的表達及其與轉移的關系
史生鴻,李旭軍,張威,姜靜,段百蕓,錢飚,莊志剛
作者單位: 315010寧波,寧波市第二醫院(史生鴻、李旭軍、張威、姜靜、段百蕓、錢飚);上海市第一婦嬰保健院(莊志剛)
乳腺癌作為女性常見的惡性腫瘤,呈現逐年上升和年輕化趨勢,嚴重威脅女性的身心健康[1-2]。目前,乳腺癌的治療已取得顯著進展,然而對于惡性腫瘤患者來說最重要的致命原因為腫瘤的轉移,如能提前發現腫瘤是否轉移并找出判斷轉移的腫瘤生物學標記物對乳腺癌的防治具有十分重要的意義[3]。傳統觀點認為,橋粒相關蛋白(PNN)是參與細胞連接的相關基因[4]。其不僅能促使上皮細胞緊密粘連,抑制細胞從靜止向運動狀態轉化;而且參與調節mRNA前體的選擇性剪接和轉運mRNA到細胞核中[5-6]。近期研究發現,PNN基因在多種腫瘤的發生發展過程中起著重要作用[7-10]。本研究探討PNN的表達與乳腺癌轉移的關系,為研究乳腺癌的轉移機制提供新的參考資料,為探索乳腺癌的治療提供新的靶點。現報道如下。
1 資料與方法
1.1 標本及臨床病理資料 收集2015-2017年間寧波市第二醫院乳腺癌根治術后石蠟包埋組織 80例及新鮮乳腺癌、癌旁組織80對。80例石蠟標本均為女性,年齡32~71歲,平均(51.5±2.4)歲;TNM分期:Ⅰ期+Ⅱ期43例,Ⅲ期+IV期37例;淋巴結轉移53例,無淋巴結轉移27例;非浸潤性癌11例,浸潤性癌69例。80對新鮮乳腺癌、癌旁組織標本保存于-80℃冰箱內,癌旁組織分別取自標本上切緣或下切緣。所有石蠟標本都經病理檢查證實,臨床資料完整,并均統一重新切片,HE染色確定病理診斷及進行組織學分級。患者術前均未接受放、化療或內分泌治療等任何抗腫瘤治療。
1.2 方法 凍存的80對新鮮乳腺癌及癌旁組織取出后研磨成勻漿狀,各置入1.5 ml離心管中,TRIzol(美國Invitrogen,貨號140501,規格100 ml)法抽提總RNA。取抽提的總RNA通過逆轉錄試劑盒(美國Thermo,貨號00422714,規格 100rxns)進行逆轉錄反應,獲得cDNA,-20℃保存備用。按試劑盒提供的條件進行RT-qPCR反應,根據反應結果的數據,通過公式2-△△Ct計算PNNmRNA的相對表達水平。RT-qPCR總反應體積為10l,包括:SYBRGreen PCRMasterMix(美國羅氏,貨號22682700,規格5ml)5l,正向引物0.5l,反向引物0.5l,逆轉錄出的DNA模板4.5l,其余用dd H2O補齊。引物序列:PNN基因(由深圳華大基因設計合成)正向引物:5’-GGTCTACAAAGGGAAGC-3’,反向引物: 5’-TTTGGCACTAGCACATT-3’;內參GAPDH(由深圳華大基因設計合成)正向引物:5’-AAGCCTGCCGGTGACTAAC-3’,反向引物:5’-GCATCACCCGGAGGAGAAAT-3’。
80例女性乳腺癌石蠟標本進行PNN蛋白表達的檢測,實驗嚴格按照免疫組織化學染色S-P試劑盒(北京百奧萊博科技有限公司,貨號SNM504,規格160張片)進行。組織切片常規脫蠟至水,阻斷內源性過氧化物酶,放入EDTA抗原修復液,PBS沖洗,兔血清封閉,滴加兔抗人PNN多克隆抗體(美國Thermo,貨號 PA5-63689,1∶1000),4 ℃冰箱過夜,PBS沖洗,滴加二抗(武漢博士德生物工程有限公司,貨號BA1054,1∶2000),PBS沖洗,滴加DAB顯色劑,復染,常規脫水、透明,封片,顯微鏡觀察,以PBS代替一抗作為陰性對照。PNN陽性信號呈棕褐色顆粒,主要定位于細胞核。參照Hadi等[11]的免疫組織化學反應結果的判定標準,綜合考慮切片中陽性細胞占所觀察同類細胞數的百分比和陽性細胞著色強度兩項指標,半定量判斷結果。
1.3 統計方法 應用SPSS18.0軟件包進行分析。計數資料采用2檢驗。P<0.05為差異有統計學意義。
2 結果
2.1 PNN在乳腺癌及癌旁組織中的表達 80對乳腺癌組織與癌旁組織進行RT-qPCR檢測,發現PNN在乳腺癌中的表達明顯高于癌旁組織(P<0.05)。PNN在乳腺癌中的高表達率為67.5%(54/80)。見封二彩圖1。
2.2 PNN表達與乳腺癌臨床病理特征關系 免疫組化結果顯示 PNN在乳腺癌不同臨床分期中的表達水平差異有統計學意義(P<0.05);PNN的表達水平與淋巴結轉移存在相關性(P<0.05),而與年齡、腫瘤大小、臨床分級及病理分型等無關(均P>0.05)。見表1。乳腺癌細胞中PNN的陽性表達在鏡下主要出現在細胞核中,為棕褐色顆粒。Ⅲ期+IV期PNN的陽性表達率顯著性高于Ⅰ+Ⅱ期,見封二彩圖2。
史生鴻,李旭軍,張威,等.PNN在乳腺癌組織中的表達及其與轉移的關系(見正文第1566頁)

圖2 PNN在不同分期乳腺癌組織中的陽性表達(DAB染色,×10)
3 討論
乳腺癌是一類生物特征各異的疾病,乳腺癌的發生、發展是由多基因、多階段作用的結果[12]。傳統的乳腺癌治療方案普遍存在復發難治現象、晚期患者生存率低、三陰性、化療或內分泌耐藥等問題[13]。隨著分子生物學的快速發展,分子指標的靶向治療成了目前的研究熱點之一。
PNN能穩定中間纖絲與細胞橋粒的結合狀態,并增強上皮細胞的黏附性,減少細胞形態的變化,防止發生上皮細胞運動。在上皮細胞黏附的建立和維持中起著不可或缺的作用[14-15]。近幾年研究發現,PNN與腫瘤也密切相關。繼Hodgkinson等[16]2012年首次提到PNN的高表達可能與化療耐藥的乳腺癌相關后,其他國內外學者也陸續發現PNN在移行細胞癌[7]、腎細胞癌[7]、卵巢癌[8]、結直腸癌[9]和肝癌[10]等腫瘤中扮演著抑癌或癌基因的角色,并通過不同的調控機制,參與細胞的生物學功能;且PNN的表達與腫瘤患者的預后密切相關。然而PNN在乳腺癌中的研究甚少。
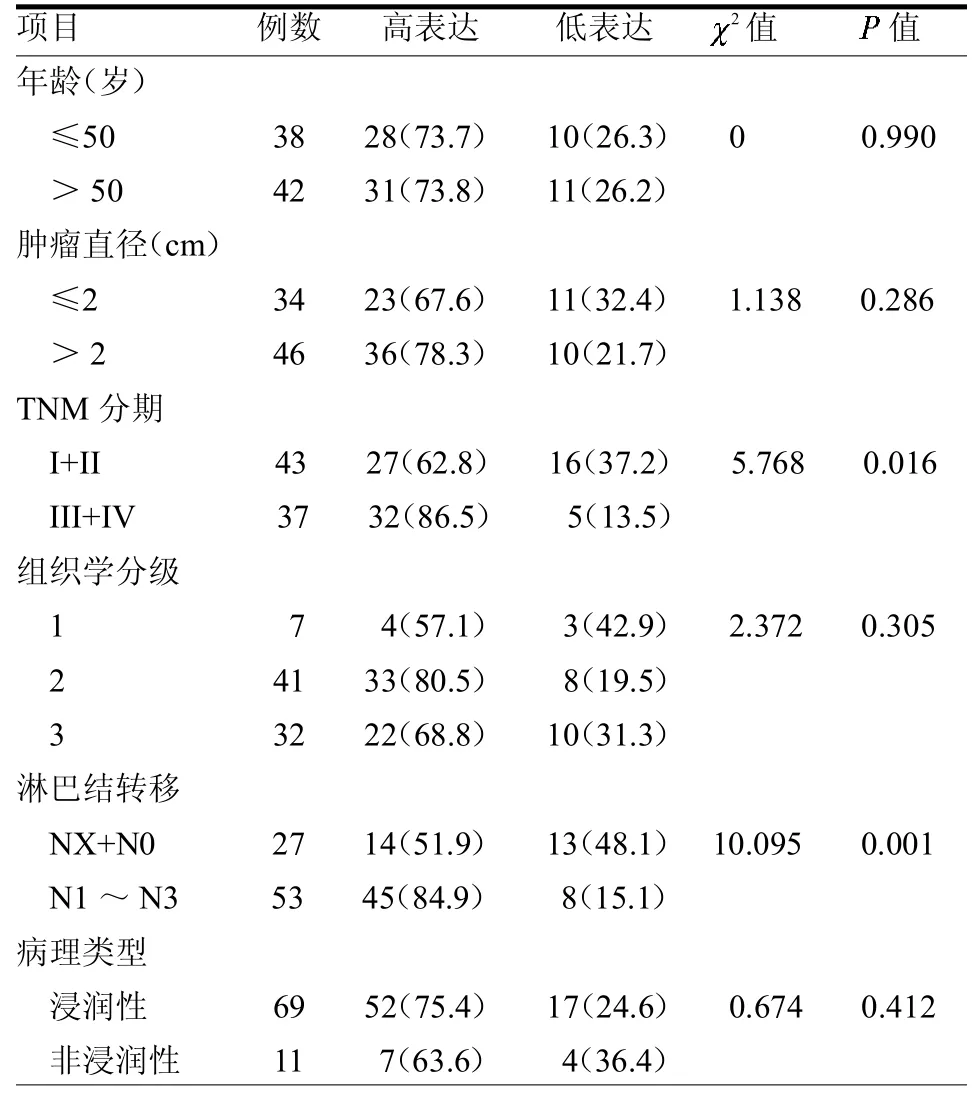
表1 PNN的表達與乳腺癌臨床病理特征的關系 例(%)
本研究結果顯示新鮮乳腺癌組織中的 PNN表達水平高于癌旁組織(P<0.05);80例乳腺癌石蠟標本中,PNN在乳腺癌不同臨床分期中的表達水平差異有統計學意義(P<0.05);PNN的表達水平與淋巴結轉移存在相關性(P<0.05)。這說明PNN表達與乳腺癌臨床病理特征,生物學行為有密切關系,是反映乳腺癌轉移的重要生物學標記物之一[17]。
癌基因的激活或抑癌基因的突變是惡性腫瘤發生和發展的分子學基礎。檢測PNN在乳腺癌中表達,可提高對乳腺癌惡性表型判斷的準確性,有助于深入了解腫瘤發生發展機制,并可為鑒別診斷、判斷預后和基因治療提供依據。人們對PNN在腫瘤中的研究剛起步,尤其是其蛋白的表達和調控研究尚不多,機制尚在探索階段。因此,拓展研究參與調控PNN表達的機制,將為以PNN為靶點的腫瘤靶向治療提供實驗依據。

