4株纖維酶產生菌的篩選及其酶活力測定
李季蓉 楊紅 劉曉輝 姜慧明 李林翰


摘要:從大連龍湖濕地公園土壤中分離獲得了經剛果紅染劑染色后產生明顯透明圈的4株真菌,經形態學鑒定分別是枝孢霉屬(Cladosporium sp.)、鐮孢屬(Fusarium sp.)、漆斑霉屬(Myrothecium sp.)和青霉屬(Penicillium sp.),其中鐮孢屬產生透明圈相對直徑最大為1.63 cm,枝孢霉屬形成透明圈次之為1.60cm。通過酶活力測定比較:枝孢霉屬的纖維素降解酶活力最高2.09IU/mL,鐮孢屬次之1.39 IU/mL。兩種真菌降解纖維素形成的透明圈大小與酶活力呈負相關。
關鍵詞:纖維素降解;酶活力;真菌
中圖分類號:Q814
文獻標識碼:A
文章編號:1674-9944( 2019) 24-0215-03
1 引言
隨著社會經濟的發展,能源短缺已經成為世界各國關注的熱點問題,新的可開發的再生資源亟待我們去探索、研究。纖維素是自然界中廣泛存在的一類碳水化合物和可再生的生物資源[1],其結構中含有大量高能氫鍵,具有降解難、水解難的特點,自然界中只有10%左右的纖維素被人類利用,絕大部分天然纖維素在自然壞境中被微生物分解轉化[2]。由于很多微生物可以產生促進纖維素降解的各種酶類[3,4],從不同環境下分離得到的各類真菌、細菌等微生物中不乏具有較好纖維素降解能力的菌株[5-7]。本文從濕地土壤中分離獲得4株具有纖維素降解能力的真菌菌株,并對其酶活力進行測定,為這些菌株的進一步開發利用和菌株發酵研究提供理論研究基礎。
2 材料與方法
2.1 供試材料
土壤樣品于2018年5月采自大連龍湖濕地公園,分別從水庫濕地、草甸濕地、濱海濕地3種不同類型的土壤中,各采集多份土壤樣品存放無菌試管中,帶回實驗室后立即進行樣本的分離培養。
2.2 供試培養基
孟加拉紅培養基(MEA):葡萄糖10g,蛋白胨5g,KH2P041 g,MgS04.7H20 0.5g,瓊脂20g,1/3000孟加拉紅溶液100 mL。馬鈴薯葡萄糖瓊脂培養基:PDA培養基粉。纖維素一鈉培養基:1000 mL去離子水,Na2HPO42.5g,KH2PO41.5g,蛋白胨2.5g,CMC-Na 20g,瓊脂20 g,pH值調節至7.0~7.5。液體發酵培養基:馬鈴薯200g,葡萄糖20 g,1000 mL去離子水。
2.3 主要試劑
剛果紅溶液:按照1g藥品加1000 mL水的比例配制剛果紅溶液。NaCI溶液:在1000 ml_去離子水中加入58.5 g NaCI攪拌溶解,配制濃度為1 mol/L。DNS試劑:配置方法見魏群[8]。醋酸一醋酸鈉緩沖液:稱取乙酸鈉10. 52 g溶解在450 mL蒸餾水中,用冰醋酸將溶液pH值調至4.8左右,最后定容至500 mL。葡萄糖標準溶液:稱取100 mg的干燥葡萄糖溶于50 mL蒸餾水中,再定容至100 mL,配制成濃度為1 g/L。
2.4 試驗方法
2.4.1 具有纖維素降解能力真菌的分離
稱取10g濕地土壤裝入有90 mL無菌水的三角瓶中,震蕩搖勻樣品lO min成土壤懸浮液后在21℃恒溫搖床中150 r/min震蕩1h,使土壤中的微生物均勻分散。移液槍吸取1 mL菌懸液至裝有9 mL無菌水的試管中,依次稀釋至10-4濃度,吸取1 mL 10-4濃度的菌懸液于MEA培養基上涂勻,25℃恒溫培養箱中培養5~10 d。將MEA培養基中培養出真菌移植到PDA培養基上純化培養。如有雜菌則多次進行純化。
2.4.2 纖維素降解菌的初篩
把PDA培養基中培養7 d的菌落用直徑為5 mm的打孔器打孔,將菌苔接種至CMC- Na培養基中25℃培養5~7 d,待菌落直徑生長到約2 cm時,將配制好的剛果紅溶液倒人培養基中,液體沒過培養基約1 cm,反應15 min左右瀝干培養基加入NaCI溶液,15 min后倒去NaCI溶液,觀察是否有透明圈形成并記錄透明圈直徑。
2.4.3 纖維素降解菌的纖維素酶活力測定
將剛果紅染色出現透明圈的菌株接種到液體發酵培養基中,25℃下200 r/min條件下恒溫搖床培養箱中培養7d。取發酵液lOmL于離心管中,在3000 r/min、4℃低溫離心機中離心15 min得到粗酶液,4℃儲存備用。
在玻璃試管中加入1 ml_羧甲基纖維素一鈉溶液,2 mL醋酸一醋酸鈉緩沖液,每支試管中分別加入1 mL上述粗酶液,45℃水浴30 min。混合液冷卻至常溫時加入2 mL DNS試劑,沸水浴5 min,取出冷卻至常溫,用蒸餾水定容體系至25 mL,測定溶液在540 mm處的OD值。設置對照組:將粗酶液沸水浴10 min滅活后再加入,其他溶液與實驗組一致,并一同操作。
繪制葡萄糖標準曲線:取15個玻璃試管,每個試管中分別加入O、0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9、1.O、1.1、1.2、1.3、1.4 mL的葡萄糖標準溶液,加入醋酸一醋酸鈉緩沖液定容至5 mL,再分別加入2 mLDNS試劑,沸水浴10 min,冷卻至常溫,用蒸餾水定容至25 mL,測定溶液在540 mm處的OD值。以葡萄糖含量為橫坐標,OD值為縱坐標繪制標準曲線,給出回歸方程。
定義酶活單位為單位時間內,使得纖維素水解生成1μg葡萄糖的酶液量。酶活力(IU/mL)=(葡萄糖含量(mg)×稀釋倍數×5.56)/(反應液中加入的酶液量(ml)×時間(min))。
將試驗組測得的每個菌株的OD平均值代入葡萄糖標準曲線的回歸方程中,算出葡萄糖含量,再根據公式算出酶活力。
2.4.4 菌株形態鑒定
觀察真菌菌落培養特征,刮取少量菌絲制片,顯微鏡下觀察孢子形態、產孢結構等確定菌株的生物學分類地位。
3 結果與分析
3.1 纖維素降真菌的初篩結果
纖維素是CMC- Na培養基中唯一的碳來源,剛果紅與纖維素化學反應出現深紅色復合物,纖維素酶水解物葡萄糖周圍則出現透明圈。透明圈大可以初步鑒定出菌株降解纖維素的能力強。
試驗中共篩選出30株真菌菌落,其中剛果紅染色后呈現透明圈的菌株有4株,如圖1所示。通過測量菌落直徑、透明圈直徑等數據得出粗略結果,如表1所示,14號菌株的透明圈最大,其次是11號,15號和29形成透明圈較小。
3.2 纖維素降解酶活力測定
3.2.1 葡萄糖標準曲線的繪制
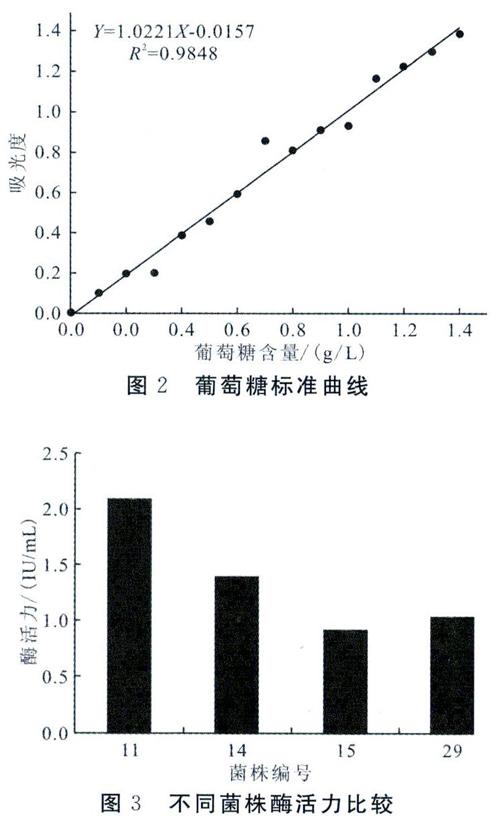
試驗以葡萄糖含量為橫坐標,540 nm下OD值為縱坐標,繪制葡萄糖標準曲線如圖2,回歸方程為y=1. 022x-0. 0157。
3.2.2 4個菌株纖維素降解酶活力比較
由圖3可知,所獲得4株可產生明顯透明圈的真菌菌株中,11號菌株酶活力明顯高于其它3個菌株,下一步可對11號菌株的產酶特性的研究展開深入研究。
3.3 真菌鑒定結果
通過分離純化培養獲4個真菌菌株,對其菌落特征(顏色,菌落質地、生長速度等)觀察,采用壓片法對每個菌株的孢子形態、產孢結構等形態結構在顯微鏡下觀察,并查閱相關文獻[9],11號菌株為枝孢霉屬(Clados-porium sp.),14號菌株為鐮孢屬(Fusarium sp.),15號菌株為漆斑霉屬(Myrothecium sp.),29號菌株為青霉屬(PeniciILium sp.)(圖4)。
4 結論與討論
本實驗通過利用羧甲基纖維素鈉培養基和剛果紅透明圈染色法,初步篩選出4株能夠產生透明圈且具有纖維產降解能力的真菌,其中lI號枝孢霉屬(Clados-porzum sp.)酶活力最高,其次是14號鐮孢屬(Fusari-um sp.),29號青霉屬(Penicillium sp.)和15號漆斑霉屬(Myrothecium sp.)酶活力值較低。但在透明圈篩選中,14號菌株透明圈比11號大,但其酶活力沒有11號高,這可能與菌種在發酵液中培養時生長速度不同而導致產生的菌種的生物量差異而導致產酶量的差異,也可能是不同菌株產生的酶活力對環境因子差異導致。針對以上存在問題,將對11號和14號菌株開展酶生理特性的研究,在揭示二者產酶活力差異同時,為產酶菌株的開發利用奠定理論基礎。
參考文獻:
[1]Liu DY. Zhang RF,Yang XM,et al.Thermostable cellulase pro-duction of Aspergillus fumigatus 25under solid - state fermenta-tion and its application in degradation of agricultural wastes[J].International biodeterioration&biodegradation, 2011, 65(5):717 -725.
[2]王丹,林建強,張蕭,等,直接生物轉化纖維素類資源生產燃料乙醇的研究進展[J].山東農業大學學報(自然科學版),2002(4):525-529.
[3]2hang Q, Lo CM, Ju LK. Factors Affecting Foaming Behavior in-Cellulose Fermentationby Trichoderma reesei Rut C- 30[J].Bioresource Technology, 2007, 98(4): 753~ 760.
[4]汪維云,朱金華,吳守一.纖維素科學及纖維素酶的研究進展[J].江蘇理工大學學報,1998(3):20-28.
[5]Soloveva IV, Okunev ON, Vel'kov VV, et al.The SelectionandProperties of Penicillium verruculosum Mutants with EnhancedProduction of Cellulases and Xylanases[J]. Microbiology. 2005,74(2):141-146.
[6]孫迅,王宜磊,鄧振旭,等.四株降解半纖維素細菌的分離和鑒定[J].菏澤師專學報,1997(2):17~20.
[7]張慶芳,馬菁玲,孔秀琴,等.半纖維素酶高產菌株的篩選、鑒定及產酶條件的研究[J].中國沼氣,2015,33(5) :11~15.
[8]魏 群,生物工程技術實驗指導[M].北京:高等教育出版社,2002.
[9]Barron G.I..1964.A new genus of the Hyphomycetes from soil[J]. Mycologia,2016(56):1~518.
收稿日期:2019-10-29
基金項目:大連民族大學創新訓練項目(編號:201812026063);國家青年科學基金項目(編號:31800007)
作者簡介:李季蓉(1997-),女,大連民族大學環境與資源學院學生。
通訊作者:楊紅(1978-),女,副教授,博士,主要從事真菌分類方向研究。

