氧化苦參堿改善肝硬化大鼠細胞凋亡性腸黏膜損傷的機制
文劍波 陳衛國 張瀟 江麗萍 胡兆鵬 周云
肝硬化門靜脈高壓通過破壞肌動蛋白細胞骨架和緊密連接復雜結構,增加腸上皮細胞的凋亡和改變刷狀緣以及表面活性劑層的組成損傷腸黏膜機械屏障,而大量腸黏膜上皮細胞的凋亡破壞了腸上皮細胞間緊密連接(TJ)的結構,損傷腸黏膜屏障的功能。Bcl-2、Bax是Bcl-2家族中作用相反、有同源結構域的一組基因,與腸上皮細胞的凋亡有著密切的聯系。現代藥理研究表明,氧化苦參堿(OMT)具有抗氧化[1]、抗腫瘤[2]、抗凋亡[3]、抗炎[4]、抗病毒[5]、抗纖維化[6]等多種藥理作用。有研究發現,OMT通過抑制Caspase-3和Bax的表達,增加Bcl-2的表達抗細胞凋亡及增加抗氧化酶活性減少新生大鼠缺氧缺血性腦損傷[7]。本實驗旨在探究改良四因素復合造模法制備的肝硬化大鼠模型中,OMT能否通過上調Bcl-2和下調Bax的表達來抑制腸黏膜上皮細胞的凋亡,從而改善腸黏膜損傷。
資料和方法
一、材料
(一)實驗動物 正常雄性SD大鼠30只,體質量(200±20) g(湖南斯萊克景達實驗動物有限公司提供)。置于萍鄉市人民醫院動物實驗中心飼養,溫度18~22 ℃,自由攝食及飲水。
(二)實驗試劑及儀器 四氯化碳溶液、醫用橄欖油(上海國藥集團化學試劑有限公司),TRIZOL(美國INVITROGEN公司),逆轉錄試劑盒(美國Genecopoeia公司),羅氏Tunel試劑盒(美國Sigma公司),苦參素注射液(江蘇正大天晴藥業股份有限公司),PCR儀(美國Bio-Rad公司),電泳儀(北京六一儀器廠)等。
二、方法
(一) 分組及模型準備 30只SD大鼠,隨機分為空白組(4只)、肝硬化造模組(26只)。空白組:常規飼養9周后,按體質量肌注5%葡萄糖水4周,消毒自來水及飼料自由攝入,標記為空白對照組A組;肝硬化造模組:采用改良四因素復合造模法(苯巴比妥鈉誘導、CCl4橄欖油溶液皮下注射、乙醇甘草甜味素溶液作為飲用水)9周后制成肝硬化成模大鼠(16只),造模過程中,分別于第5、7、9 周各隨機抽取1只大鼠行肉眼及光鏡下觀察肝臟病理改變,觀察是否造模成功。取肝硬化成模大鼠16只,隨機選擇8只予以40% CCl4橄欖油溶液皮下注射及按體質量肌注5%葡萄糖水4周,標記為模型組B組;剩余8只予以40% CCl4橄欖油溶液皮下注射及按體質量肌注OMT葡萄糖水4周,標記為治療組C組;B組和C組消毒飼料及含甘草甜味素的10%乙醇溶液自由攝入。
(二)TUNEL法檢測腸組織中腸上皮細胞的凋亡 固定、取材、石蠟包埋、切片后按羅氏TUNEL說明書對各組大鼠末端回腸黏膜組織腸上皮細胞行凋亡檢測,并計算凋亡率。
(三)RT-PCR法檢測大鼠腸組織Bcl-2和Bax的mRNA表達 引物合成(引物序列見表1)、TRIZOL法抽提大鼠回腸末端組織總RNA、反轉錄合成第一鏈cDNA、cDNA擴增、瓊脂糖凝膠電泳、Gelpro4.0版凝膠光密度分析軟件分析圖像結果。
(四)統計學分析
結 果
一、肉眼及光鏡下肝臟病理改變
造模過程中,分別于第5、7、9 周各隨機抽取1只大鼠行肉眼及光鏡下觀察肝臟病理改變。結果顯示,9周末大鼠肝臟明顯肝硬化(如圖1)。說明肝硬化大鼠造模成功。
二、 TUNEL腸組織腸上皮細胞凋亡結果
模型組(圖2B)回腸上皮細胞凋亡率明顯高于空白對照組(圖2A) (40.98%±2.19%對7.87%±1.83%),差異有統計學意義(P<0.01);治療組(圖2C)凋亡率低于模型組(28.27%±2.30%對40.98%±2.19%),差異有統計學意義(P<0.05)。(如圖2,3)
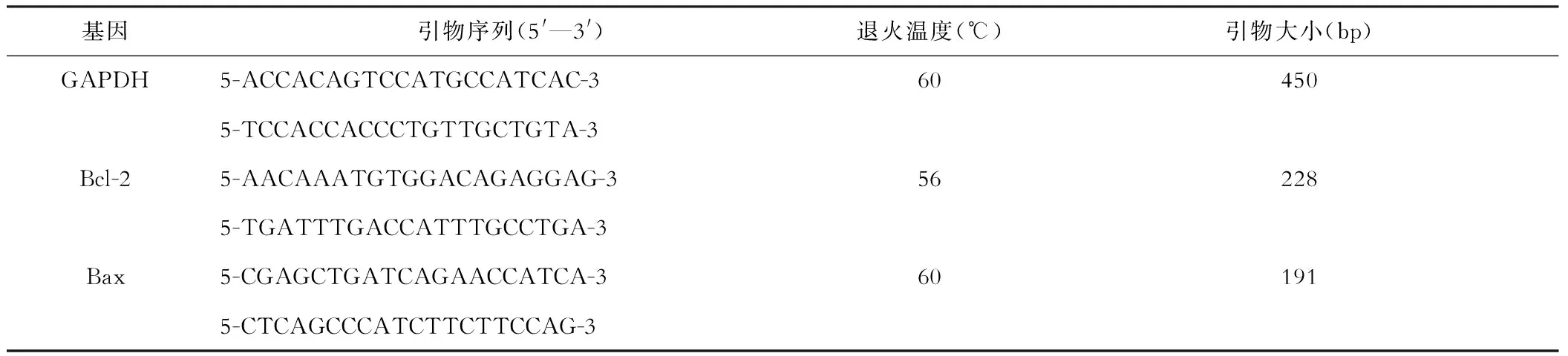
表1 引物序列

圖1 肉眼觀察肝臟及鏡下病理表現(HE,×100)

A:空白對照組;B模型組;C藥物治療組

注:A:空白對照組; B:模型組; C:治療組.**P<0.01:模型組對空白對照組,*P<0.05:治療組對模型組
圖3回腸組織TUNEL染色細胞凋亡率條形圖
三、回腸組織中Bcl-2和Bax mRNA表達結果
電泳結果表明,A組中Bcl-2 mRNA呈現高表達,Bax mRNA呈現低表達。B組Bcl-2 mRNA的表達明顯低于A組,差異有統計學意義(P<0.01);Bax mRNA表達明顯高于A組,差異有統計學意義(P<0.01);C組Bcl-2 mRNA的表達水平明顯增加高于B組,差異有統計學意義(P<0.05);Bax mRNA的表達水平明顯減少低于B組,差異有統計學意義(P<0.05)。(如圖4、5、6)

注:A:空白對照組; B:模型組; C:治療組
圖4Bcl-2和Bax mRNA電泳圖

注:A:空白對照組; B:模型組; C:治療組.**P< 0.01:模型組對空白對照組,*P<0.05:治療組對模型組
圖5Bcl-2 mRNA水平比較

注:A:空白對照組; B:模型組; C:治療組.**P< 0.01:模型組對空白對照組,*P<0.05:治療組對模型組
圖6Bax mRNA水平比較
討 論
肝硬化后期門靜脈高壓、營養不良低蛋白血癥、腸道動力不足、內毒素血癥、促炎性細胞因子TNF-α的水平升高[8]、氧化應激(OS)等都可導致大量腸上皮細胞發生凋亡,而腸上皮細胞大量凋亡減少了上皮細胞群的數量引起TJ的分離、腸通透性增加,進而損害腸黏膜機械屏障。細胞凋亡基因Bcl-2、Bax可以分別以同源及異源二聚體存在,當Bax高表達時形成同源二聚體Bax-Bax誘導細胞凋亡;而Bcl-2高表達時則形成異源二聚體Bcl-2-Bax抑制細胞凋亡。且隨著Bcl-2表達增加,同源二聚體Bax-Bax大量分離與Bcl-2形成更加穩定的異源二聚體Bcl-2-Bax,從而抑制同源二聚體Bax-Bax誘導的細胞凋亡,因此,Bcl-2/Bax的比值可以判斷細胞生存還是死亡[9]。OMT是從豆科槐屬植物苦參中提取的具有四環喹嗪啶類結構的生物堿,有文獻報道可通過促進Bcl-2表達而抑制苯巴比妥鈉誘導的肝細胞凋亡[10]。另一項研究表明,相較于醛固酮抑制劑螺內酯通過抑制鈣蛋白酶/凋亡誘導因子(AIF)介導的信號通路導致心肌細胞凋亡,OMT具有同樣的效果而無高鉀血癥的副作用[11]。本研究也驗證了OMT可通過調控細胞凋亡基因Bcl-2、Bax的表達抑制腸黏膜上皮細胞的凋亡,與其他研究結果一致。
本研究TUNEL法檢測腸上皮細胞凋亡結果表明,模型組腸細胞凋亡率明顯高于空白對照組,經OMT治療后,藥物治療組細胞凋亡率明顯下降低于模型組;肝硬化大鼠腸組織Bcl-2 mRNA表達明顯低于空白對照組,Bax mRNA表達高于空白對照組,經過OMT治療后,藥物治療組Bcl-2 mRNA的表達水平明顯增加高于模型組,Bax mRNA的表達水平明顯減少低于模型組。這提示OMT治療可通過上調細胞凋亡基因Bcl-2mRNA、下調Bax mRNA的表達,從而抑制腸黏膜上皮細胞的凋亡。前期研究發現CCl4誘導的肝硬化大鼠腸黏膜受到嚴重破壞,而OMT可以減輕腸黏膜絨毛的水腫以及修復腺上皮柱狀結構,并顯著降低炎性細胞浸潤而改善肝硬化大鼠的腸組織損傷。其機制可能一方面OMT通過抑制NF-κB介導的炎癥信號通路降低腸黏膜炎癥細胞因子如TNF-α、IL-6的濃度水平及減輕腸源性內毒素血癥改善肝硬化大鼠腸上皮屏障功能[12];另一方面,其機制可能是OMT通過上調肝硬化大鼠回腸組織中凋亡相關基因Bcl-2 mRNA的表達、下調Bax mRNA的表達抑制腸黏膜上皮細胞的凋亡,從而改善腸黏膜損傷,發揮保護腸黏膜屏障功能的作用。

