動脈灌注化療栓塞聯(lián)合放射粒子植入治療原發(fā)性肝癌患者療效及其對肝組織TRF1和TRF2表達的影響*
陳 向,汪寶林,吳 琛,唐勁草,張 弛,褚朝順
動脈灌注化療栓塞術(shù)(TACE)是針對肝臟腫瘤的有效治療方法,療效確切,已經(jīng)得到廣泛的應(yīng)用,但單純TACE治療的遠期療效并不理想[1~3]。腫瘤病灶內(nèi)125I放射粒子植入是一種可以對病灶精確定位的新型放療手段,能夠有效提高局部病灶的放射劑量。目前,關(guān)于TACE聯(lián)合放射粒子植入治療原發(fā)性肝癌(PLC)患者的臨床應(yīng)用報道較多,且療效肯定[4]。端粒重復(fù)序列結(jié)合因子(telomeric repeat binding factor 1/2,TRF1/2)是調(diào)節(jié)端粒結(jié)合蛋白,對維持端粒的正常結(jié)構(gòu)和功能非常重要[5],對于腫瘤細胞DNA復(fù)制、染色體運動和端粒長度的調(diào)節(jié)等生物學活動也具有重要的意義,與多種腫瘤的發(fā)生、病情進展和轉(zhuǎn)移密切相關(guān)[6]。本研究探討了TACE聯(lián)合放射粒子植入術(shù)治療的PLC患者肝組織TRF1和TRF2表達的變化,現(xiàn)將結(jié)果報道如下。
1 資料與方法
1.1 一般資料 2012年12月~2015年12月我院和南京醫(yī)科大學第一附屬醫(yī)院接受治療的PLC患者108例,男66例,女42例;年齡38~71歲。符合原發(fā)性肝癌診斷標準[7]。腫瘤形態(tài)為彌漫型18例,結(jié)節(jié)型40,塊狀型50例;Child A 級30例,B級66例,C級12例。納入患者均未接受過任何放療和化療治療,預(yù)計生存時間大于6個月,經(jīng)影像學檢查未發(fā)現(xiàn)其它部位轉(zhuǎn)移。排除標準:(1)存在TACE治療禁忌證;(2)血白細胞計數(shù)小于3.0×109/L、血小板計數(shù)小于80×109/L;(3)存在心血管系統(tǒng)疾病或腎功能損害者;⑷存在其他部位惡性腫瘤。采用擲硬幣法將患者隨機分為對照組54例和觀察組54例,兩組年齡、性別、腫瘤形態(tài)、Child分級等一般資料比較差異無統(tǒng)計學意義(P>0.05),具有可比性。本研究方案經(jīng)我院醫(yī)學倫理委員會批準。患者簽署知情同意書。
1.2 治療方法 在對照組,行TACE治療,行局部麻醉后,經(jīng)股動脈穿刺插入導(dǎo)管,造影確認腫瘤位置、大小、數(shù)目,明確相關(guān)供血動脈情況,緩慢注射吡柔比星(深圳萬樂藥業(yè)有限公司,國藥準字H10930105)20~40 mg,奧沙利鉑(江蘇奧賽康藥業(yè)股份有限公司,國藥準字H20051985)50 mg和碘化油,取吡柔比星20 mg與48%碘化油10 ml比例混合,碘化油用量為10~15 ml。術(shù)后采取常規(guī)護肝治療;在觀察組,行放射粒子植入術(shù)聯(lián)合TACE治療,在TACE治療1周后,將患者體位固定,行CT平掃,明確腫瘤大小、位置、癌旁組織結(jié)構(gòu),在體表標記。將CT掃描數(shù)據(jù)、125I治療劑量和125I放射粒子活性等參數(shù)傳輸至計算機系統(tǒng)。采用Dany CT確定臨床治療靶區(qū),并根據(jù)CT導(dǎo)航系統(tǒng)進行定位穿刺,確認針尖穿刺至治療靶區(qū)后,通過針鞘將已確定劑量的125I放射粒子植入。再次行CT掃描復(fù)查,觀察放射粒子分布情況,術(shù)畢,拔出穿刺針,對穿刺部位進行消毒、包扎。兩組患者均實施3~4次TACE治療,觀察組僅進行1次放射粒子植入,治療結(jié)束后隨訪12 m。
1.3 臨床療效評估 采用世界衛(wèi)生組織關(guān)于實體腫瘤療效的評定標準[8]評定療效,即完全緩解(CR):所有病灶消失;部分緩解(PR):病灶體積減少至少50%;病情穩(wěn)定(SD):體內(nèi)腫瘤病灶體積減少小于50%或增加不大于25%;進展或惡化(PD):病灶體積增加至少25%或出現(xiàn)新的病灶。客觀緩解率(RR)為CR和PR之和除以總例數(shù)(×100%)。
1.4 血清腫瘤標志物檢測 采用ELISA法測定血清癌胚抗原(carcino-embryonic antigen,CEA)和甲胎蛋白(α-fetoprotein,AFP)水平,試劑盒購自聯(lián)科生物科技有限公司。
1.5 肝癌組織TRF1和TRF2表達檢測 分別于治療前和治療1月后行肝活檢穿刺檢查,獲取肝組織,采用免疫組化染色(S-P)法檢測。鼠抗人TRF1單克隆抗體和兔抗人TRF2單克隆抗體及其配套試劑盒均購自上海酶聯(lián)生物科技有限公司。由兩名病理科醫(yī)生閱片,遵循隨機單盲原則,在400倍下避開切片邊緣選取5處不重疊視野觀察,計數(shù)TRF1和TRF2陽性細胞數(shù)。陽性判斷標準[9]:細胞漿或細胞核內(nèi)見棕黃色或棕色顆粒分布者,判定為陽性;陰性判斷標準:胞漿內(nèi)無棕黃色顆粒染色為陰性。采用半定量綜合評分法對TRF1和TRF2的表達進行評估,評估標準:染色積分=染色強度分數(shù)×染色細胞百分比;細胞染色計分:0分為無染色細胞,1分為陽性細胞小于10%;2分為染色陽性細胞在11%~50%;3分為50%~75%,4分為超過75%的細胞染色陽性;染色強度:0分為無染色,1分為淺黃色,2分為棕黃色,3分為棕褐色。綜合評分:0~2分為不表達,記為陰性;3~5分為弱表達,記為弱陽性;6~8分記為中等陽性;9~12分記為強陽性。
1.6 統(tǒng)計學方法 應(yīng)用SPSS 19.0統(tǒng)計軟件對本研究數(shù)據(jù)進行統(tǒng)計分析,計數(shù)資料采用x2檢驗,計量資料以(±s)表示,采用 t檢驗。以 P<0.05 被認為差異存在統(tǒng)計學意義。
2 結(jié)果
2.1 臨床療效比較 在治療后3 m,觀察組客觀緩解率顯著高于對照組(x2=4.441,P<0.05,表1)。患者男性,46歲。肝右葉見巨大占位,約13.3×16.1 cm,邊界欠清,增強呈快進快出,內(nèi)見壞死區(qū),肝門部見多發(fā)稍大淋巴結(jié);在介入治療術(shù)后,肝右葉巨大占位較前縮小,最大截面約為10.1×13.3 cm,周圍肝實質(zhì)密度降低,病灶內(nèi)可見斑片狀致密影和少許氣體樣密度,增強后未見明顯強化,肝門處和腹主動脈周圍可見多發(fā)稍大淋巴結(jié)。
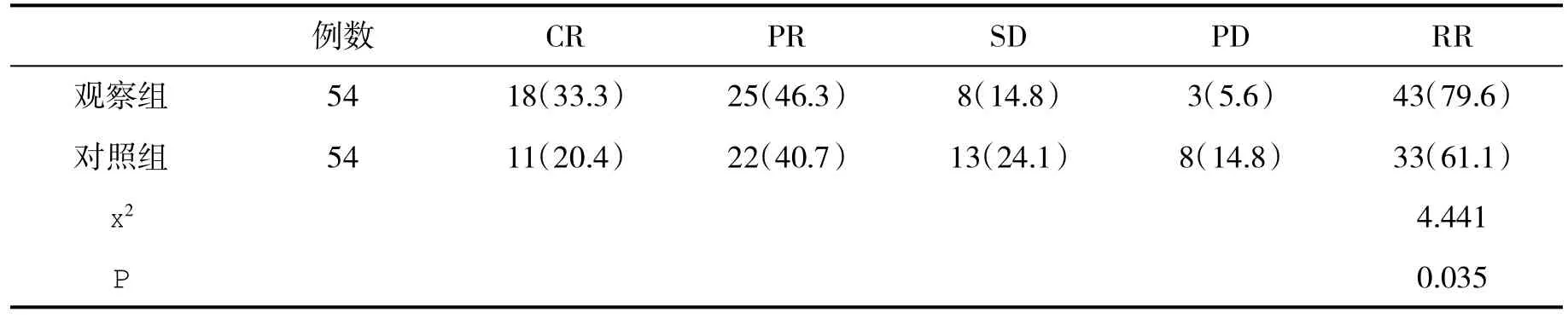
表1 兩組近期療效[(n)%]比較
2.2 兩組血清CEA和AFP水平比較 在治療3月時,觀察組血清CEA和AFP水平顯著低于對照組(P<0.01,表2)。
表2 兩組血清CEA和AFP水平(±s)比較

表2 兩組血清CEA和AFP水平(±s)比較
與對照組比,①P<0.05
例數(shù) CEA(ng/ml) AFP(μg/L)對照組 治療前 54 520.6±55.2 2420.2±290.3治療后 54 312.5±33.9 1080.1±121.3觀察組 治療前 54 526.1±51.1 2371.4±245.2治療后 54 273.7±38.1② 820.4±130.3②
2.3 兩組治療前后肝組織TRF1和TRF2表達的比較 觀察組癌旁肝組織TRF1表達量為(9.7±2.3),顯著高于癌組織的【(4.2±1.8),P<0.01】,而觀察組癌組織TRF2表達量為(9.2±2.2),顯著高于癌旁肝組織的【(3.8±2.6),P<0.01,圖1~圖3】。
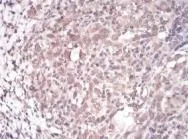
圖1 癌旁肝組織TRF1陽性表達在細胞漿中可見棕褐色顆粒(SP,400×)
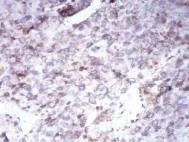
圖2 肝癌組織TRF1呈輕度陽性表達(SP,400×)

圖3 肝癌組織TRF2陽性表達在細胞核和細胞漿中可見棕褐色顆粒(SP,400×)
2.4 兩組生存率比較 觀察組1 a生存率顯著高于對照組 [96.3%(52/54)對 85.2%(46/54),x2=3.967,P=0.046]。
3 討論
本研究采用TACE聯(lián)合放射粒子植入術(shù)治療PLC患者客觀緩解率為79.6%,明顯高于對照組的61.1%。分析認為肝動脈為腫瘤的主要供血動脈,TACE通過對肝動脈注入化療藥物,對腫瘤細胞具有直接的殺傷作用,同時還能阻斷病灶的供血,促進腫瘤凋亡[10]。放射粒子植入術(shù)能夠精確定位腫瘤靶區(qū)域,局部大劑量放療能夠大大提高臨床療效。兩者作用機制不同,聯(lián)合使用能產(chǎn)生發(fā)揮協(xié)同作用,且經(jīng)TACE治療后能夠有效改善腫瘤細胞對放療的敏感性,進而提高臨床治療效果[11,12]。
研究發(fā)現(xiàn),細胞端粒功能異常是導(dǎo)致細胞異變,繼而引發(fā)癌癥發(fā)生的重要原因[13,14]。端粒的結(jié)構(gòu)和功能與細胞在增殖過程中DNA復(fù)制、細胞老化、細胞程序性死亡密切相關(guān)。惡性腫瘤細胞核內(nèi)具有生物學活性較高的端粒酶,導(dǎo)致端粒的結(jié)構(gòu)和功能異常,實現(xiàn)腫瘤細胞在一定程度上的持續(xù)性增長,是導(dǎo)致病情發(fā)生和惡化的重要因素。TRF1和TRF2是影響細胞端粒結(jié)構(gòu)、活性和功能的重要蛋白。TRF1能夠特異性調(diào)節(jié)結(jié)合DNA的端粒數(shù)量,從而對端粒長度實現(xiàn)負性調(diào)節(jié)作用,而TRF2的生物學功能是維持端粒結(jié)構(gòu)穩(wěn)定,保持端粒長度的動態(tài)平衡,影響細胞的增殖和凋亡。國外研究表明,惡性腫瘤組織TRF1的表達明顯降低而TRF2較正常組織明顯增高[15]。國外研究學者發(fā)現(xiàn)PLC患者TRF1和TRF2異常表達為PLC發(fā)病的獨立危險因素,TRF1和TRF2表達水平與臨床分期密切相關(guān)。他們認為對患者血TRF1和TRF2含量進行動態(tài)監(jiān)測,對于疾病的診斷、病情及預(yù)后的評估具有重要意義[16]。Bouhlel L et al[17]指出,非小細胞肺癌患者血TRF2水平較健康對照人群明顯增高。因此,探討臨床常用治療方案對肝癌患者TRF1和TRF2表達的影響,對于臨床治療以及預(yù)后預(yù)測具有重要意義。采用TACE聯(lián)合125I治療能夠明顯調(diào)節(jié)患者肝組織TRF1和TRF2表達。原發(fā)病灶腫瘤邊緣血管重建和腫瘤細胞增殖等活動中均有TRF1和TRF2的參與,進而影響腫瘤細胞增殖過程中的DNA復(fù)制。肝癌患者外周血TRF2呈異常增高,TRF1明顯下降。肝動脈為肝腫瘤主要的血供來源,TACE將化療藥物直接灌注到相關(guān)腫瘤供血血管,阻斷病灶血供,抑制血管增生,促進細胞凋亡,相關(guān)因子明顯下降。TACE聯(lián)合放射粒子植入術(shù)治療患者病灶治療區(qū)域局部放療劑量較高,射線能直接破壞腫瘤細胞DNA雙鏈結(jié)構(gòu),另一方面通過放射治療使水分子電離生成自由基,對腫瘤細胞DNA同樣具有殺傷作用,能夠有效抑制腫瘤細胞的分裂、生長,能防止病情的惡化和轉(zhuǎn)移,且對于病灶邊緣區(qū)域內(nèi)的殘留組織供血,TACE無法直接阻斷,而放療則可以有效殺滅該區(qū)域的腫瘤細胞。此外,相關(guān)研究已經(jīng)證實125I放射粒子植入能夠改善肝癌患者機體免疫功能,增強自身防御機制[18]。兩種方案聯(lián)合治療無交叉耐藥,同時能夠提高腫瘤細胞對化療藥物的敏感性,增強化療的療效,抑制腫瘤血管的新生,縮小病灶體積,改善患者的預(yù)后。

