小桐子CDPK及相關激酶基因家族的 全基因組鑒定及表達分析
王海波,郭俊云,辛 胡,劉 潮,高 永,代冬琴,唐利洲
(1.曲靖師范學院 云南高原生物資源保護與利用研究中心,云南省高校云貴高原動植物遺傳多樣性及生態適應性進化 重點實驗室,生物資源與食品工程學院,云南曲靖 655011;2.西南林業大學 林學院,昆明 650224)
在植物的整個生命周期中,受到外界多種生物與非生物環境因素的影響,在長期的進化中,植物形成了一套復雜的網絡信號系統,經過胞外信號感知、膜上信號轉換、胞內信號轉導,及基因表達與蛋白活性可逆調控,以適應多變的外界環境[1]。Ca2+作為第二信使,在植物信號轉導途徑中發揮重要作用,在植物體中多種信號途徑都會促發胞內Ca2+濃度的變化,進而通過鈣信號感應器(CDPK-SnRK超家族)將信號傳遞至下游級聯系統,包括:鈣依賴蛋白激酶(Calcium-dependent protein kinase,CDPK/CPK)、鈣依賴蛋白激酶相關激酶(CDPK-related protein kinase,CRK)、磷酸烯醇式丙酮酸羧化酶激酶(Phosphoenolpyruvate carboxylase kinase,PPCK)、磷酸烯醇式丙酮酸羧化酶激酶相關激酶(PEP carboxylase kinase-related kinase,PEPRK)及鈣與鈣調素依賴蛋白激酶(Calcium and calmodulin-dependent protein kinase,CCaMK)等[2-4]。CDPK是植物與部分原生生物(Protozoa)特有的一類絲氨酸/蘇氨酸蛋白激酶,作為典型的Ca2+傳感器,可不需要鈣調素(Calmodulin,CaM)而被Ca2+直接激活[5]。典型的植物CDPK蛋白屬于單體蛋白,僅由1條多肽鏈組成,從N端到C端包含4個結構域(功能區),即N端可變區[包含豆蔻酰化(Myristoylation)與棕櫚酰化(Palmitoylation)位點]、具有催化活性的Ser/Thr蛋白激酶區、活性控制的自抑制連接區以及包含2~4個EF-hand基序負責結合Ca2+的CaM調控區[6-7]。催化區由約300個氨基酸殘基組成,具有典型的Ser/Thr蛋白激酶結構域,且不同物種中同源性較高。自抑制連接區由20~30個氨基酸殘基組成,在沒有Ca2+存在時,負責結合催化區的激酶結構域從而抑制其活性。調控區通過2~4個結合Ca2+的EF hands基序控制自抑制區的抑制活性[8]。CDPK調控區通過結合Ca2+解除自抑區對激酶區的抑制作用從而激活CDPK的活性,特別的獨特結構使其同時具有Ca2+感應器與效應器的功能,在Ca2+信號轉導過程中發揮核心作用。另外,CRK未鑒定到自抑區以及調控區的EF-hand基序,而CCaMK的自抑區與鈣及鈣調素結合結構域重疊,且調控區僅包含3個EF-hand基序,PPCK與PEPRK都包含激酶結構域,而PEPRK在N端與C端還包含可變區,但兩者都沒有結合Ca2+的EF-hand基序[7-9]。
研究表明,CDPK在植物的大部分器官中都有分布,且參與植物生長發育的大部分過程,如細胞骨架建成、氣孔運動、小分子跨膜轉運、碳氮代謝以及生物與非生物脅迫響應等。目前,已經對許多植物從全基因組水平進行CDPK及相關基因家族鑒定,CDPK基因家族包括擬南芥34個[8]、水稻31個[9]、玉米40個[10]、楊樹30個[11],CRK基因家族包括擬南芥8個[12]、水稻5個[9]、楊樹9個[11]、番茄6個[13];另外,在擬南芥中分別鑒定到PPCK、PEPRK、CCaMK基因2、2、0個[8],對應水稻中包括0、2、1個[9]。小桐子(JatrophacurcasL.)屬大戟科(Euphorbiaceae)麻瘋樹屬(Jatropha)落葉灌木或小喬木,作為世界公認的具有巨大開發潛力的能源樹種,其種子含油量高、品質好,是加工生物柴油的優質原料,具有廣闊的開發利用前景。日本Kazusa DNA研究所在2011年公布小桐子基因組測序數據[14],為從基因組水平上分析小桐子CDPK及相關激酶基因家族提供條件。本研究對小桐子CDPK及相關激酶基因家族從全基因組水平進行鑒定,并對其序列特征、進化關系及表達特性進行分析,為進一步研究CDPK及相關激酶家族基因的功能奠定基礎。
1 材料與方法
1.1 小桐子CDPK及相關激酶基因家族的鑒定
根據Cheng等[12]鑒定的模式植物擬南芥的CDPK及相關激酶基因家族登錄號,從擬南芥TAIR數據庫(https://www.arabidopsis.org/)下載擬南芥34個CDPK基因、8個CRK基因、2個PPCK基因、2個PEPRK基因以及水稻的1個CCaMK基因[9]蛋白質序列,通過ClustalX進行多重序列比對,利用Hmmer 3.0軟件的Hmmbuild程序將比對文件生成CDPK結構域的隱馬可夫HMM模型,同時,從GenBank下載小桐子最新注釋蛋白質數據庫。基于以上模型,利用Hmmer 3.0軟件的Hmmsearch程序對小桐子蛋白質數據庫進行檢索(參數設置:閾值E<1e-10,序列相似性>50%),得到候選的小桐子CDPK及相關激酶蛋白質序列,利用Excel腳本去除重復序列。將非冗余的候選序列利用Pfam與CDD在線工具進行CDPK激酶結構域分析,得到最終的小桐子CDPK及相關激酶家族蛋白質序列。
1.2 小桐子CDPK及相關激酶家族基因及蛋白質的特征分析
根據鑒定的小桐子CDPK及相關激酶蛋白質登錄號,從GenBank下載其對應的基因序列、mRNA序列以及CDS(Coding sequence,CDS)序列。利用ProtParam工具(http://web.expasy.org/protparam/)對CDPK及相關激酶蛋白質進行氨基酸數目、理論分子質量(Mw)、等電點(pI)等基本參數的分析。亞細胞定位采用CELLO服務器V2.5(http://cello.life.nctu.edu.tw/)進行鑒定。利用PROSITE(http://prosite.expasy.org/)在線分析工具對CDPK及相關激酶蛋白質序列進行motif分析。利用ClustalX(Version 2.0)進行序列相似性比對,然后用MEGA 6.0軟件通過鄰接法(NJ)構建系統進化樹,并采用自展法(Bootstrap)進行檢驗。利用GenDOC軟件對ClustalX比對結果進行CDPK及相關激酶蛋白的保守結構域分析。通過CDS序列與基因序列比對以確定基因內含子與外顯子的結構,并利用GSDS(Gene Structure Display Server,http://gsds.cbi.pku.edu.cn/)繪制基因結構圖。另外,染色體定位以Wu等[15]構建的小桐子遺傳連鎖圖譜進行錨定,并通過MapChart(Version 2.1)繪制基因定位圖。
1.3 小桐子CDPK及相關激酶家族基因的表達分析
從GenBank的SRA數據庫下載小桐子不同器官的Illumina高通量測序數據(葉片SRR1639660、根SRR1639659、種子SRR1639661)。通過Bowtie2與Samtools工具將鑒定到的小桐子CDPK及相關激酶家族基因與測序數據進行比對,得到各CDPK及相關激酶基因的表達reads數據,之后通過Cufflinks程序計算每個基因的表達量FPKM(Fragments Per Kilobase per Million)值,進行以2為底的對數轉化,并設置以基因與器官同時進行聚類,聚類方法選擇層次聚類法(Hierarchical Clustering)。另外,將鑒定的小桐子CDPK及相關激酶家族基因序列對低溫轉錄組數據[16]進行比對,通過編號得到各基因在對照與12 ℃低溫處理12、24及48 h的低溫數字基因表達譜(Digital Gene Expression,DGE)[17]中的原始表達標簽CleanTaq數據,進一步通過TPM(Transcript per Million Clean Tags)獲得標準化的基因表達量[18-19],經過log2(處理TPM/對照TPM)轉化,得到小桐子CDPK及相關激酶家族基因在低溫處理下的差異表達數據。利用R軟件(Version 3.4.1)的gplots與pheatmap函數進行聚類分析及熱圖(heatmap)的繪制。
2 結果與分析
2.1 小桐子CDPK及相關激酶基因家族的鑒定與序列特征
在小桐子全基因組共鑒定到17個CDPK基因,分別命名為JcCDPK1-JcCDPK17,5個CRK基因(JcCRK1-JcCRK5)、2個PPCK基因(JcPPCK1、JcPPCK2)、4個PEPRK基因(JcPEPRK1.1、JcPEPRK1.2、JcPEPRK2.1、JcPEPRK2.2)及1個CCaMK基因(JcCCaMK)(表1)。理化參數分析結果表明,小桐子JcPPCK1與JcPPCK2基因(1 389 bp、1 574 bp)與蛋白(271 aa、276 aa)序列較短,CDPK及相關激酶基因長度分布在2 904(JcCDPK15)~9 631(JcCDPK14)bp,蛋白序列長度分布在466(JcPEPRK2.1)~630(JcCRK5)aa。其中,等電點有明顯的家族特異性,CDPK基因家族的Ⅰ、Ⅱ及Ⅲ亞族、PPCK基因家族Ⅰ亞族、CCaMK基因家族成員的等電點都偏酸性與中性,分布在5.31(JcCDPK10)~7.21(JcCDPK11),而CDPK基因家族的Ⅳ亞族、CRK基因家族及PPCK基因家族Ⅱ亞族都偏堿性,分布在8.43(JcPEPRK2.2)~9.02(JcCDPK17)。CELLO亞細胞定位顯示,小桐子CDPK基因家族主要定位細胞質(15個)、其次為細胞核(2個,JcCDPK2與JcCDPK17),CRK基因家族定位細胞核與葉綠體,PPCK基因家族都定位細胞質,PEPRK基因家族定位細胞核與細胞膜,而CCaMK定位細胞核。
2.2 小桐子CDPK及相關激酶基因家族的系統進化與基因結構
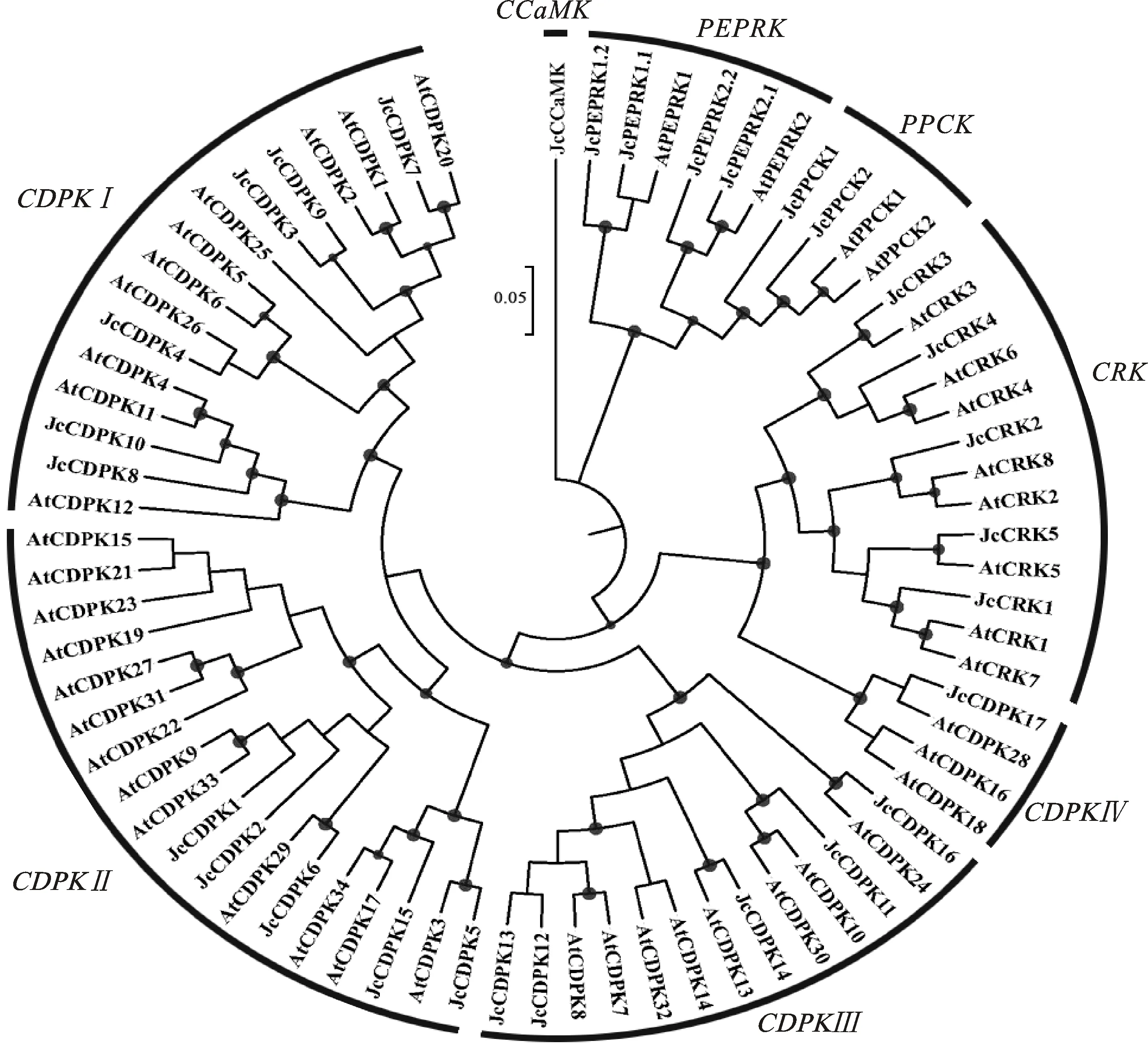
根據Harbak等[8]關于擬南芥CDPK及相關激酶基因家族的分類標準,通過MEGA構建小桐子與擬南芥CDPK及相關激酶基因家族進化樹(圖1、圖2),可見小桐子與擬南芥聚類結果(圖1)與小桐子單獨聚類結果(圖2)完全吻合,小桐子CDPK基因家族也聚類為Ⅰ、Ⅱ、Ⅲ、Ⅳ 4個亞族,基因數量分別為6、5、6、1,較擬南芥對應亞族基因10、13、8、3數量少,其中第Ⅳ亞族只有JcCDPK17基因。另外,小桐子CRK、PPCK及PEPRK基因家族分別鑒定到5、2、4個基因,對應擬南芥中包含8、2、2個基因,CCaMK基因家族在擬南芥中未發現,而在小桐子中鑒定到1個對應JcCCaMK基因,與Asano等[9]在水稻中鑒定到OsCCaMK1(GenBank登錄號:AC097175)的報道一致。
結合小桐子29個CDPK及相關激酶家族的聚類結果,基因結構分析顯示,小桐子CDPK基因家族除Ⅳ亞族JcCDPK17包含12個外顯子外,其他3個亞族都包含6~9個外顯子(圖2、表1),且首尾外顯子都與5-UTR與3-UTR區域重合,中間為分散且長度較短的外顯子。其中,Ⅰ亞族除JcCDPK4(9個外顯子),都包含7個外顯子,且都鑒定到5-UTR與3-UTR區域;Ⅱ亞族除JcCDPK15(6個外顯子),都包含8~9個外顯子,而JcCDPK2與JcCDPK15分別缺失5-UTR與3-UTR區域;Ⅲ亞族包含7~9個外顯子,而JcCDPK16缺失5-UTR區域。同時,小桐子CRK基因家族成員都包含11個外顯子,且外顯子分布規律完全一致,PPCK基因家族成員都包含2個外顯子,PEPRK基因家族包含3~5個外顯子,且Ⅰ(JcPEPRK1.1、JcPEPRK1.2)與Ⅱ(JcPEPRK2.1、JcPEPRK2.2)亞族成員基因結構一致,而CCaMK基因家族的唯一成員JcCCaMK包含7個外顯子。
黑色圓點表示Bootstrap檢驗值的大小 Bootstrap values were represented by black dots
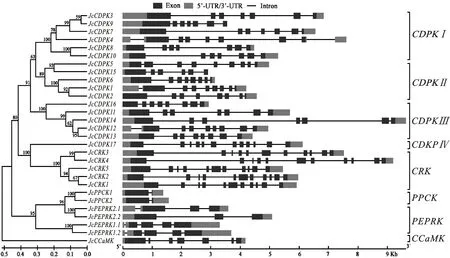
圖2 小桐子CDPK及相關激酶基因家族的基因結構Fig.2 Gene structure of J.curcas CDPK and its related kinase genes family

2.3 小桐子CDPK及相關激酶氨基酸序列分析
為了分析小桐子CDPK及相關激酶的保守序列,通過多序列比對鑒定到小桐子CDPK家族成員的N-端可變區、激酶結構區、自抑區及EF-hand調控區4個保守結構域以及其他激酶成員的激酶結構域。其中,N-端可變區氨基酸序列整體變化較大,而前8個氨基酸殘基相對保守,PROSITE分析顯示該區域是與CDPK及相關激酶修飾調控相關的序列,通過ExPASY的N-Myristoylation與CSS-plam 4.0工具分析29個小桐子CDPK及相關激酶表明,有21個鑒定到與N-豆蔻酰化(N-Myristoylation)修飾相關的核心氨基酸殘基Cys,其中11個可能會發生N-豆蔻酰化修飾,另外,有24個可能會發生N-十六烷酰化(N-Palmitoylation)修飾(表1)。
CDPK及相關激酶都包含約300aa的核心激酶結構域,多序列比對結果表明,小桐子CDPK的激酶結構域保守性較高,鑒定到與CDPK激酶催化相關的保守序列C-E/A-G-G-E-L-F-D-R-I、H-R-D-L-K-P-E-N-F-L-F/L、D/E-V/I-V-G-S-P/A-Y-Y、A-P-E-V-L、D-V-W-S、G-V-M/I-L-Y-I-L-L、G-V-P-P-F-W、P-W-P-x-V/I-S、A-K-D-L-V以及H-P-W[20](圖3),以及催化活性中心的核心氨基酸殘基Asp(圖3三角形所示)。

實線表示激酶結構域的保守基序,三角形表示激酶結構域的催化核心Asp殘基 Solid line indicates conserved motifs in kinase domain ofJ.curcasCDPK,the triangle indicates the core catalytic Asp residue in the kinase domain
圖3小桐子CDPK激酶結構域多序列比對
Fig.3MultiplealignmentforconservedkinasedomainofJ.curcasCDPK
CDPK激酶調控區的EF-hand基序通過結合Ca2+從而解除自抑區對激酶結構域的抑制作用,其中,Ca2+主要結合EF-hand基序的Asp(D)或Glu(E),在小桐子CDPK激酶的調控區也鑒定到4個保守EF-hand基序(1st、2nd、3rd、4th EF-hand),以及對應的4個保守的序列D-x-D(圖4三角形所示),另外發現每個EF-hand基序的保守D-x-D序列之后都包含富含Glu(E)的一段保守序列E-E-L-K(1st EF-hand)、E-E-I/L-A/T(2nd EF-hand)、D/E-E-L(3rd EF-hand)以及E-F-A/V-T/A-M-M(4th EF-hand)(圖4)。

虛線表示自抑區,實線表示4個EF-hand保守基序;雙實線表示EF-hand基序的核心序列;三角形表示EF-hand基序的保守D-x-D殘基 Dotted and solid lines show conserved motifs of auto-inhibitory and EF-hands ofJ.curcasCDP,respectively,the double lines and the triangles represent the core sequences and the conserved D-x-D residues in the EF-hand,respectively
圖4小桐子CDPK自抑區與EF-hand區多序列比對
Fig.4Multiplealignmentforconserveddomainsandmotifsinauto-inhibitoryandEF-handregionsofJ.curcasCDPK
2.4 小桐子CDPK及相關激酶基因家族染色體定位
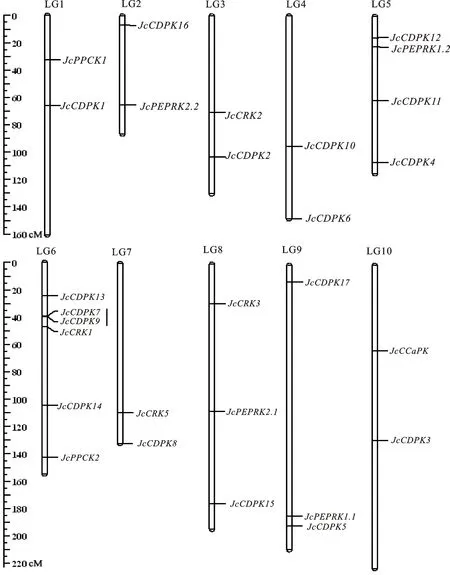
依據Wu等[15]構建的小桐子高密度遺傳連鎖圖譜,在染色體水平定位每個小桐子CDPK及相關激酶基因,結果表明,除11號染色體沒有基因分布外,28個小桐子CDPK及相關激酶基因(JcCRK4基因沒有染色體定位信息)不均勻地分布于其余10條染色體上,其中,6號染色體上的基因數量最多(6個),且發現該基因家族的串聯復制基因JcCDPK7/JcCDPK9,而1、2、3、4、7及10號染色體上的基因較少,各包含2個(圖5)。
2.5 小桐子CDPK及相關激酶家族基因的表達分析
基于小桐子葉片、根及種子轉錄組測序數據,得到小桐子29個CDPK及相關激酶基因的表達數據(圖6)。結果表明,29個CDPK及相關激酶基因,在葉片、根及種子中有24個基因都有表達,而3個基因都未鑒定到表達。其中,JcCDPK1、JcCDPK4、JcCDPK8、JcCDPK13及JcPEPRK1.2在3種器官中表達量都較高(log2FPKM>4.0),但JcCDPK9、JcCDPK15及JcCDPK16在3個器官中都沒有表達(log2FPKM<0)。其他基因存在器官表達特異性,在葉片、根及種子中表達量最高的基因分別為JcCDPK13、JcCDPK4及JcPEPRK2.2。另外,JcCDPK7在葉片與種子中有表達,而在根中不表達,JcCCaMK在根中有表達,而在葉片與種子中沒有表達。
豎線表示基因串聯復制 Vertical line indicates tandem duplication;刻度表示厘摩 Scale is in centiMorgans (cM);LG表示染色體 Chromosome
圖5小桐子CDPK及相關激酶家族基因的染色體定位
Fig.5ChromosomaldistributionofJ.curcasCDPKanditsrelatedgenefamily
通過DGE數據分析得到11個小桐子CDPK及相關激酶家族基因在低溫處理條件下的表達數據(圖7)。與對照相比,JcCDPK3在低溫脅迫12、24及48 h時都上調表達顯著,而JcPEPRK1.1與JcPEPRK2.2僅在低溫脅迫24 h上調表達顯著。另外,隨著低溫脅迫時間的延長,JcCDPK11、JcCRK3及JcCCaMK的表達量呈連續上升的趨勢,在低溫脅迫48 h時,表達量分別較對照提高4.23、7.41和2.25倍。聚類熱圖顯示,其他基因也屬于低溫誘導表達基因,其中,JcCDPK1在低溫脅迫24 h達到最大表達量,較對照提高1.56倍,而JcCDPK13、JcCDPK17、JcPPCK1及JcPPCK2都表現出2次上調表達峰值,分別在低溫脅迫48 h、12 h、48 h及12 h達到最大表達量。

圖6 小桐子CDPK及相關激酶家族基因的器官差異表達分析Fig.6 Differential expression of J.curcas CDPK and its related kinase gene family in different organs
3 討 論
有文獻[21]報道,在藻類與陸生植物分化之前CDPK家族基因就已經分為4個亞族。雙子葉植物擬南芥[8]、楊樹[11]及小桐子,單子葉植物水稻[9]與玉米[10]的CDPK家族基因進化分析結果也聚類為4個亞族,暗示CDPK基因功能的分化也是在單、雙子葉植物分化之前就已經完成。另外,CDPK屬多基因家族,不同物種中數量差異較大,如單子葉植物水稻31個[9]、玉米40個[10],雙子葉植物擬南芥34個[8]、楊樹30個[11]、草莓15個[22]、桃15個[23]。本研究鑒定的小桐子CDPK基因17個。從以上基因數量可以看出,CDPK家族基因在不同物種之間存在2倍關系。據報道[24],在顯花植物進化中,全基因復制事件是導致基因家族成員數目增加的重要途徑。以上結果也表明,大部分單子葉植物與部分雙子葉植物經歷了一次全基因組復制事件,而雙子葉植物只有少數發生以上事件,且是在單雙子葉植物分化之后發生的,說明小桐子CDPK家族基因在單雙子葉植物分化之前就已聚為4類不同功能的亞族,而分化之后,未發生全基因組復制事件。另外,在經歷全基因組復制的物種中還發現大量基因片段復制現象(Tandem duplication),如水稻的OsCPK25/26(相似性99.6%)、OsCPK3/16(91.9%)、OsCPK2/14(86.8%)、OsCPK24/28(86.5%)及OsCPK1/15(86.2%)[9],楊樹的PtCDPK2/3(相似性93.0%)、PtCDPK5/6(93.0%)、PtCDPK10/11(93.0%)、PtCDPK25/26(93.0%)、PtCCaMK1/2(93.0%)[11]等,而在雙子葉植物小桐子中只鑒定到JcCDPK7/JcCDPK9一對基因復制,也證明CDPK基因數量較多的植物在進化中大部分發生了全基因組復制事件,導致大量相似性較高的CDPK基因出現,而未發生復制事件的植物如小桐子只有極少數的基因片段復制。另外,CRK、PEPRK基因家族在擬南芥[8]、水稻[9]與小桐子基因組中都有分布,而PPCK與CCaMK基因家族存在物種特異性,如PPCK基因家族在擬南芥與小桐子中都包含2個成員,而水稻中未鑒定到[9],CCaMK基因家族在水稻與小桐子中都包含1個成員,而在擬南芥中未鑒定到[8]。
轉錄組表達數據顯示,小桐子CDPK及相關激酶基因有3種器官表達模式,第1類有顯著的器官表達特異性,如小桐子JcCDPK7在葉片與種子表達,而在根中沒有表達,JcCaMK在根中有表達,而在葉片與種子沒有表達,相同的研究結果在其他物種也有報道,如煙草NtCDPK1的轉錄本存在于莖、根及花中,而在葉片中未檢測到[25],小麥TaCPK13在葉片、幼穗及未成熟的種子中表達,而在根與莖中不表達[26]。第2類在不同的器官中沒有顯著表達差異,如小桐子JcCDPK1、JcCDPK4、JcCDPK13、JcCRK1及JcCRK5在考察的3種器官中表達量基本一致,類似研究如番茄LeCDPK1在葉片、莖、根及花中表達量基本相同,小麥TaCPK2在葉片、莖、根、幼穗及未成熟的種子中表達量沒有差異[26]。另外,鑒定發現JcCDPK15與JcCDPK16在小桐子不同器官中都未表達。第3類為所有器官都有表達,但存在表達差異性,如蠶豆VfCPK1在各個器官都有表達,但在下表皮和葉片中的表達量顯著高于莖與根[27],而小桐子的JcPPCK1在葉片、根及種子中都有表達,但葉片的表達量高于種子,JcCDPK14與JcPEPRK1.1在根與種子中表達量較高,而在葉片中較低(圖6)。以上3種表達模式暗示,部分小桐子CDPK及相關激酶基因屬于看家基因,在所有器官中都發揮作用,且可能參與大部分代謝途徑或信號轉導過程;相反,部分基因在特異器官或全部器官中都未見表達,推測可能是表達基因的同源基因,也可能是通過生物或非生物因子誘導才能表達的基因。同時,多數CDPK及相關激酶基因與植物逆境信號轉導相關。Sheen[28]發現擬南芥AtCDPK1與AtCDPK1a在干旱與鹽脅迫下表達量顯著上調。而本研究中JcCDPK3、JcCDPK11、JcCRK3及JcCCaMK在低溫脅迫下表達量增加明顯,屬于小桐子抗冷性及低溫信號轉導相關的基因(圖7)。

圖7 小桐子CDPK及相關激酶家族基因的低溫脅迫表達分析Fig.7 Expression profiles of J.curcas CDPK and its related kinase gene family under chilling stress

