不同分子特性玉米蛋白高F值活性肽的制備及其模擬消化吸收
王 鑫,侯 威,趙 磊,*,王成濤,*,盧 松
(1.北京食品營養(yǎng)與人類健康高精尖創(chuàng)新中心,北京市食品添加劑工程技術(shù)研究中心,北京工商大學(xué),北京100048;2.阜豐集團(tuán)內(nèi)蒙古阜豐生物科技有限公司,內(nèi)蒙古呼和浩特010030)
我國是全球第二大玉米生產(chǎn)國,占世界總產(chǎn)量的20%[1]。玉米黃粉是玉米濕法加工淀粉時(shí)產(chǎn)生的副產(chǎn)物,其中含有30%~70%的蛋白質(zhì)[2],可分為玉米醇溶蛋白、谷蛋白、球蛋白和白蛋白等成分[3]。但是由于其氣味和色澤獨(dú)特,口感粗糙,色氨酸、賴氨酸等人體必需氨基酸組成不充分,大大限制了其在食品行業(yè)中的應(yīng)用[4],在我國主要被用作動物飼料或發(fā)酵行業(yè)氮源,極少被綜合開發(fā)利用[5]。而在美、日等發(fā)達(dá)國家,一些蛋白加工企業(yè)對玉米黃粉進(jìn)行了充分挖掘,生產(chǎn)出一系列高附加值產(chǎn)品,玉米黃粉的價(jià)值得到了很大提高。
高 F值活性肽(High Fischer ratio peptide,HFRP)是一類由2~9個(gè)氨基酸殘基所組成的復(fù)合小肽,其顯著特征是支鏈氨基酸(Brand chain amino acid,BCAA)與芳香族氨基酸(Aromatic amino acids,AAA)含量的摩爾數(shù)比值(即F值)較高,一般應(yīng)大于20[6-7]。其中,BCAA 主要包括:纈氨酸(Val) 、亮氨酸(Leu)、異亮氨酸(Ile);AAA主要包括:色氨酸(Trp)、酪氨酸(Tyr)、苯丙氨酸(Phe)[8]。HFRP 是一種重要活性肽,具有抗疲勞、改善肝、腎、腸、胃疾病患者營養(yǎng)的功能[9-10]。玉米黃粉中 BCAA 所占比例為23.79%,BCAA與AAA比值高達(dá)4.8,這兩項(xiàng)指標(biāo)遠(yuǎn)高于其他谷類中的稻谷(3.81)、小麥(3.29)、高粱(4.6)和油料作物中的大豆(3.91)、蠶豆(3.97)、扁豆(3.32)[11],可以有效利用這一天然優(yōu)勢,并在蛋白酶酶解作用下進(jìn)一步降低芳香族氨基酸含量制備HFRP[12]。鄭喜群等[13]采用堿性蛋白酶和米曲霉固態(tài)發(fā)酵產(chǎn)生的羧肽酶依次水解玉米醇溶蛋白,制備HFRP;Cheison等[14]采用胰蛋白酶作為水解酶,得到制備HFRP的最佳條件。
HFRP經(jīng)口攝入、進(jìn)入機(jī)體發(fā)揮生理功能,需要面臨胃腸道的物理屏障和生化屏障雙重作用,前者主要包括由消化道粘膜層、細(xì)胞分泌系統(tǒng)、上皮細(xì)胞間的緊密連接等構(gòu)成的物理屏障,后者是指胃內(nèi)低pH、胃腸內(nèi)多種消化酶等消化降解[15]。因此,采用模擬胃腸消化模型和單層細(xì)胞模型,篩選出HFRP中可以被完整、高效吸收的肽。
本研究以玉米黃粉為原料,采用復(fù)合酶解法制備HFRP,利用活性炭吸附進(jìn)一步降低芳香族氨基酸比例,提高F值,并通過分子量、電荷性和疏水性將其分離純化,進(jìn)一步研究其吸收狀況和胃腸消化狀況,為新型活性肽保健食品的研究開發(fā)提供理論依據(jù)和技術(shù)支持,為玉米黃粉的綜合利用探索新道路。
1 材料與方法
1.1 材料與儀器
玉米黃粉 阜豐集團(tuán)有限公司;堿性蛋白酶(2×105U/g)、風(fēng)味蛋白酶(3.37×104U/g) 諾維信(中國)公司;胃蛋白酶(1×104U/g)、胰蛋白酶(1×104U/g) Solarbio公司;Octyl Sepharose 4 Fast Flow、Sephadex-G15、CM FF 16/10、DEAE FF 16/10、酪蛋白、L-酪氨酸 美國 Sigma公司;Caco-2細(xì)胞 北京金紫晶生物醫(yī)藥技術(shù)有限公司;不完全培養(yǎng)液MEM-EBSS 北京博爾金科技有限公司;胎牛血清、100 U/mL青-鏈雙抗 美國Ameresco公司;AKP檢測試劑盒、BCA微量蛋白檢測試劑盒 上海酶聯(lián)生物科技有限公司;其它試劑 均為分析純或色譜純。
L-8900氨基酸自動分析儀 日本日立公司;UV2450紫外可見光分光光度計(jì) 日本島津公司;YS-10小型高速粉碎機(jī) 北京燕山正德機(jī)械設(shè)備有限公司;HQ45恒溫?fù)u床 中國科學(xué)院武漢科學(xué)儀器廠;Supra高速冷凍離心機(jī) 韓國Hanil Science Industrial(翰尼科學(xué)產(chǎn)業(yè));ATN-300自動凱氏定氮儀 上海洪紀(jì)儀器設(shè)備有限公司;Sorvall Legend Micro 17R微量離心機(jī) 美國Thermo公司;FD-1B-80冷凍干燥機(jī) 南京普森儀器公司;purifier 10 AKTA蛋白純化系統(tǒng) 美國通用公司;Axiovert 200倒置顯微鏡 德國Zeiss公司;STX2跨膜電阻儀 世界精密儀器商貿(mào)(上海)有限公司W(wǎng)PI;HH-4水浴鍋 上海藍(lán)凱儀器儀表有限公司;Galaxy S CO2培養(yǎng)箱 英國RS Biotech公司;SpectraMax I3多功能酶標(biāo)儀 美國Molecular Devices公司;1290-Q-TOF-MS/MS液相色譜-質(zhì)譜聯(lián)用儀 美國安捷倫科技公司;MLS-3750高壓蒸汽滅菌鍋 日本三洋電機(jī)株式會社。
1.2 實(shí)驗(yàn)方法
1.2.1 理化指標(biāo)的測定 根據(jù)GB/T 5009.3-2016食品中水分的測定[16]中直接干燥法測定水分含量;根據(jù) GB/T 5009.4-2016 食品中灰分的測定[17]中灼燒稱質(zhì)量法測定灰分含量;根據(jù)GB/T 5009.5-2016食品中蛋白質(zhì)的測定[18]中凱氏定氮法(F=6.24)測定蛋白質(zhì)含量;根據(jù)GB/T 5009.6-2006食品中脂肪的測定[19]中索氏抽提法測定脂肪含量。將樣品置于水解管中,加入6 mol/L的HCl溶液,110℃真空水解24 h,冷卻后定容,過濾干燥,加入0.02 mol/L的HCl溶液室溫放置30 min,采用氨基酸自動分析儀測定除色氨酸外的氨基酸含量。
1.2.2 HFRP的制備 以玉米黃粉為原料,首先經(jīng)堿性蛋白進(jìn)行初次酶解(添加量1.25×104U/g底物、p H9、料液比1∶35、溫度 50 ℃、時(shí)間 3 h),將芳香族氨基酸暴露于肽端,然后通過風(fēng)味蛋白酶進(jìn)行二次酶解(添加量1.01×103U/g底物、p H7、溫度45℃、時(shí)間2.5 h),使芳香族氨基酸游離于酶解液中。利用活性炭對酶解液中游離氨基酸進(jìn)行吸附(添加量7%、pH4、溫度30℃、時(shí)間1.5 h),然后選擇桿菌肽(分子量1422.69 Da)、合成多肽1(分子量912.835 Da)、合成多肽 2(分子量 493.46 Da)、色氨酸(分子量204.213 Da)作為檢測標(biāo)準(zhǔn)物,依據(jù)其在 sephadex G-15自裝柱中保留時(shí)間的不同,確定所制備的活性肽的分子量范圍(上樣量100μL、樣品濃度10 mg/mL、流速0.3 mL/min、流動相為高純水、檢測波長280 nm)。收集2~9個(gè)氨基酸組成的HFRP(<1000 Da),對其進(jìn)行真空冷凍干燥,干燥溫度設(shè)為-52℃,時(shí)間36 h,-20℃儲存?zhèn)溆谩?/p>
1.2.3 不同分子量HFRP的分離 凝膠的預(yù)處理:取適量Sephadex G15填料,沸水煮30 min排除膠粒中的空氣,輕輕攪拌,靜置20 min后傾去破損漂浮的粒子,反復(fù)數(shù)次。裝柱:保持空柱垂直,沿上壁緩慢倒入凝膠液,保持填料始終處于 Tris-HCl緩沖液(0.5 mol/L,p H8.0)以下,至凝膠沉淀離柱上端1.5~2 cm處,利用緩沖液平衡過夜。加樣與洗脫:樣品質(zhì)量濃度為35 mg/mL,洗脫液為蒸餾水,洗脫流速0.5~1 mL/min之間,洗脫至 OD280<0.02。收集各組分,對其進(jìn)行真空冷凍干燥,干燥溫度設(shè)為-52℃,時(shí)間36 h,-20℃儲存?zhèn)溆谩_x擇合成多肽1(分子量912.835 Da)、合成多肽2(分子量493.46 Da)、色氨酸(分子量204.213 Da)作為分子量界限,對吸附后樣品分子量進(jìn)行檢測。
1.2.4 不同電荷性HFRP的分離 選用陽離子層析介質(zhì)CM FF 16/10和陰離子層析介質(zhì)DEAE FF 16/10裝柱進(jìn)行試驗(yàn),裝柱方法同1.2.3。樣品以2 mL/min的流速上柱,用50 mmol/L p H8.8 Tris-HCl緩沖液以5 mL/min流速洗脫至 OD280<0.02,隨后用 0~0.5 mol/L NaCl連續(xù)梯度,流速為2 mL/min洗脫。收集各組分,對其進(jìn)行真空冷凍干燥,干燥溫度設(shè)為-52℃,時(shí)間36 h,-20℃儲存?zhèn)溆谩?/p>
1.2.5 不同疏水性HFRP的分離 選用Octyl Sepharose 4 Fast Flow填料裝柱進(jìn)行試驗(yàn),裝柱方法同1.2.3。配置 2~3個(gè)柱體積 0.1 mol/L p H7.0 Na2HPO4溶液,1.7 mol/L(NH4)2SO4與樣品混合,經(jīng)過填料,使樣品完全吸附,然后按照100%~0%1.7 mol/L(NH4)2SO4梯度洗脫500 mL,洗脫液的流速控制在2 mL/min,洗脫至OD280<0.02。收集各組分,對其進(jìn)行真空冷凍干燥,干燥溫度設(shè)為-52℃,時(shí)間36 h,-20℃儲存?zhèn)溆谩?/p>
1.2.6 吸收模型的構(gòu)建 參考Xie等[20]的方法進(jìn)行細(xì)胞培養(yǎng)。將新購Caco-2細(xì)胞置于一次性細(xì)胞培養(yǎng)瓶(25 cm2)中,加入完全培養(yǎng)液(不完全MEMEBSS培養(yǎng)液、1%100 U/mL青-鏈雙抗(V/V)、10%胎牛血清(FBS,V/V)),于37℃、90%相對濕度、5%CO2培養(yǎng)箱中培養(yǎng)24 h后換液,之后隔天換液。在倒置顯微鏡下觀察,細(xì)胞融合度達(dá)到90%時(shí),用0.25%胰蛋白酶溶液消化5 min,待培養(yǎng)瓶中細(xì)胞成片脫落時(shí)加入完全培養(yǎng)液終止消化,利用一次性吸管吹打,將消化液轉(zhuǎn)入15 mL離心管,于1000 r/min離心5 min,棄去上清液,加入完全培養(yǎng)基進(jìn)一步吹散成單個(gè)細(xì)胞懸液,細(xì)胞計(jì)數(shù)后,調(diào)整細(xì)胞濃度為5×104個(gè)/mL。向Transwell轉(zhuǎn)運(yùn)板膜底側(cè)(BL側(cè))小池內(nèi)加入1.5 mL完全培養(yǎng)基,向膜上側(cè)(AP側(cè))小池內(nèi)加入稀釋好的含有細(xì)胞的混合培養(yǎng)液0.5 mL,置于CO2培養(yǎng)箱中培養(yǎng)21 d,期間每隔2 d更換一次完全培養(yǎng)液,直至Caco-2形成致密完整的單層細(xì)胞結(jié)構(gòu),并且分化成熟,可用于模擬吸收試驗(yàn)。
1.2.7 吸收模型評價(jià)
1.2.7.1 跨膜電阻(TEER)值測定 TEER值是反映細(xì)胞單層完整性的一個(gè)指標(biāo),一般TEER值在200~1000Ω·cm2范圍之內(nèi),值越大,細(xì)胞單層致密越完整[21]。吸棄培養(yǎng)液,小室內(nèi)外均加入37℃預(yù)熱的PBS溶液,重復(fù)三次,其中第三次放于培養(yǎng)箱中孵育30 min后連上細(xì)胞電位儀測電阻。
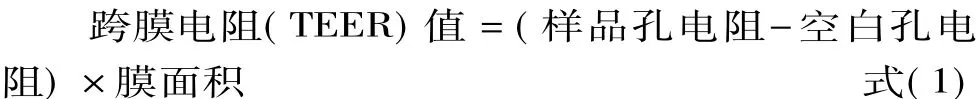
1.2.7.2 熒光黃透過率測定 預(yù)熱HBSS(0.4 g/L KCl、60 mg/L KH2PO4、8 g/L NaCl、60 mg/L Na2HPO4、0.35 g/L NaHCO3、1 g/L D-葡萄糖和 2.38 g/L HEPES,pH7.2)溶液到37℃。向 Transwell轉(zhuǎn)運(yùn)板AP側(cè)加入0.4 mL熒光黃(100 mg/mL)HBSS溶液,BL側(cè)加入0.6 mL空白HBSS溶液,在37℃,5%CO2培養(yǎng)箱中孵育1 h,從BL側(cè)取0.5 mL樣品液。利用酶標(biāo)儀(激發(fā)波長427 nm、發(fā)射波長536 nm)測定吸光值,依據(jù)以下公式計(jì)算表觀滲透系數(shù)。

式中:dQ/dt是單位時(shí)間藥物轉(zhuǎn)運(yùn)量(mg/s),A是轉(zhuǎn)運(yùn)膜表面積(cm2),C0是培養(yǎng)液中熒光黃原始濃度(μg/mL)。
1.2.7.3 堿性磷酸酶活性測定 堿性磷酸酶可分解磷酸苯二鈉,產(chǎn)生游離酚和磷酸,酚在堿性溶液中與4-氨基安替吡啉作用,經(jīng)鐵氰化鉀氧化生成紅色醌衍生物,根據(jù)紅色深淺可以測定酶活力的高低[22]。本實(shí)驗(yàn)使用 AKP試劑盒按說明書步驟,分別在Transwell膜的兩側(cè)取樣,測定堿性磷酸酶活力。根據(jù)標(biāo)準(zhǔn)曲線方程計(jì)算堿性磷酸酶活力,結(jié)果以金氏單位(37℃時(shí),與基質(zhì)作用15 min產(chǎn)生1 mg酚為一個(gè)金氏單位)表示。

1.2.8 Caco-2細(xì)胞模型轉(zhuǎn)運(yùn)方法 利用HBSS溶液將不同分子特性的各個(gè)活性肽組分溶解、稀釋成20 mg/mL的溶液,并調(diào)節(jié)其p H至7.0±0.1,在BL側(cè)加入1.5 mL的HBSS溶液,AP側(cè)加入0.5 mL的活性肽溶液,1.5 h后收集BL側(cè)溶液,對其進(jìn)行真空冷凍干燥,干燥溫度設(shè)為-52℃,時(shí)間36 h,-20℃儲存?zhèn)溆谩?/p>
1.2.9 體外模擬胃腸消化 參考Samaranayaka等[23]和Ruiz等[24]的方法進(jìn)行。模擬胃液:胃蛋白酶3.2 g、NaCl 2.0 g、濃鹽酸 7 mL、去離子水 1000 mL,調(diào)節(jié)p H2.0±0.1。模擬腸液:KH2PO46.8 g、0.2 mol/L NaOH 190 mL、胰蛋白酶10 g、去離子水 1000 mL,調(diào)節(jié)p H7.5±0.1。HFRP中可被吸收的多肽+胃液+腸液:用0.01 mol/L鹽酸(pH2.0)將不同分子特性的多肽樣品稀釋至10 mg/mL,按照上述方法配制模擬胃液,分別在37℃的條件下預(yù)熱10 min。按照酶與底物之比為1∶35(w/w)分別混合模擬胃液與底物,并于37℃保持2 h。2 h后,用0.9 mol/L NaHCO3將消化液pH調(diào)節(jié)至5.3,再用2 mol/L NaOH調(diào)節(jié)p H至7.5,按照酶與底物的比例為1∶50(w/w)將配制好的模擬腸液與胃消化液混合,2 h后腸消化完畢,沸水浴滅酶10 min,冷卻至室溫后,真空冷凍干燥至粉末(-52 ℃,36 h),-80 ℃儲存?zhèn)溆谩?.2.10 多肽結(jié)構(gòu)鑒定 采用HPLC-Q-TOF鑒定經(jīng)細(xì)胞轉(zhuǎn)運(yùn)后膜下側(cè)(BL側(cè))組分結(jié)構(gòu),其中液相條件為:Agilent Zorbax Eclipse Plus C18 2.1×50 mm,1.8μm色譜柱、柱溫30℃、流動相為0.1%甲酸水溶液(A)和0.1%甲酸乙腈溶液(B),線性梯度洗脫:0~60 min,B 10% ~60%、流速 1.0 mL/min、進(jìn)樣量10μL;質(zhì)譜條件為:電噴霧離子源ESI、正離子模式、毛細(xì)管電壓3500 V、噴嘴電壓500 V、碰撞能80 eV、干燥器溫度300℃、流量5.0 L/min、鞘氣(N2)溫度150℃、鞘氣流量 1 L/min、離子掃描范圍 50~1000 m/z;二級質(zhì)譜碰撞電壓15 eV。正、負(fù)離子一級質(zhì)譜全掃描及二級質(zhì)譜全掃描分析。
1.3 數(shù)據(jù)處理
實(shí)驗(yàn)結(jié)果用珚X±SD表示,數(shù)據(jù)處理采用Excel軟件。
2 結(jié)果與分析
2.1 玉米黃粉的基本成分及氨基酸組成
玉米黃粉常規(guī)測定結(jié)果見表1。其中蛋白質(zhì)含量高達(dá)59.17%。進(jìn)一步利用氨基酸分析儀對玉米黃粉中氨基酸組成進(jìn)行分析(表2),可以看出玉米黃粉中Leu、Val、Ile等支鏈氨基酸含量較高,分別為16.96%、4.37%、2.31%,占總氨基酸含量的23.64%,而Tyr和Phe等芳香族氨基酸含量較低,分別為2.83%和4.85%,占總氨基酸含量的7.68%;另外,Ala、Val、Pro、Met、Ile、Leu 和 Phe 屬于疏水性氨基酸,總量占氨基酸總量的54.03%,表明玉米蛋白是一種疏水程度較大的蛋白,這一特殊組成也是造成玉米中蛋白質(zhì)水溶性差的主要原因。
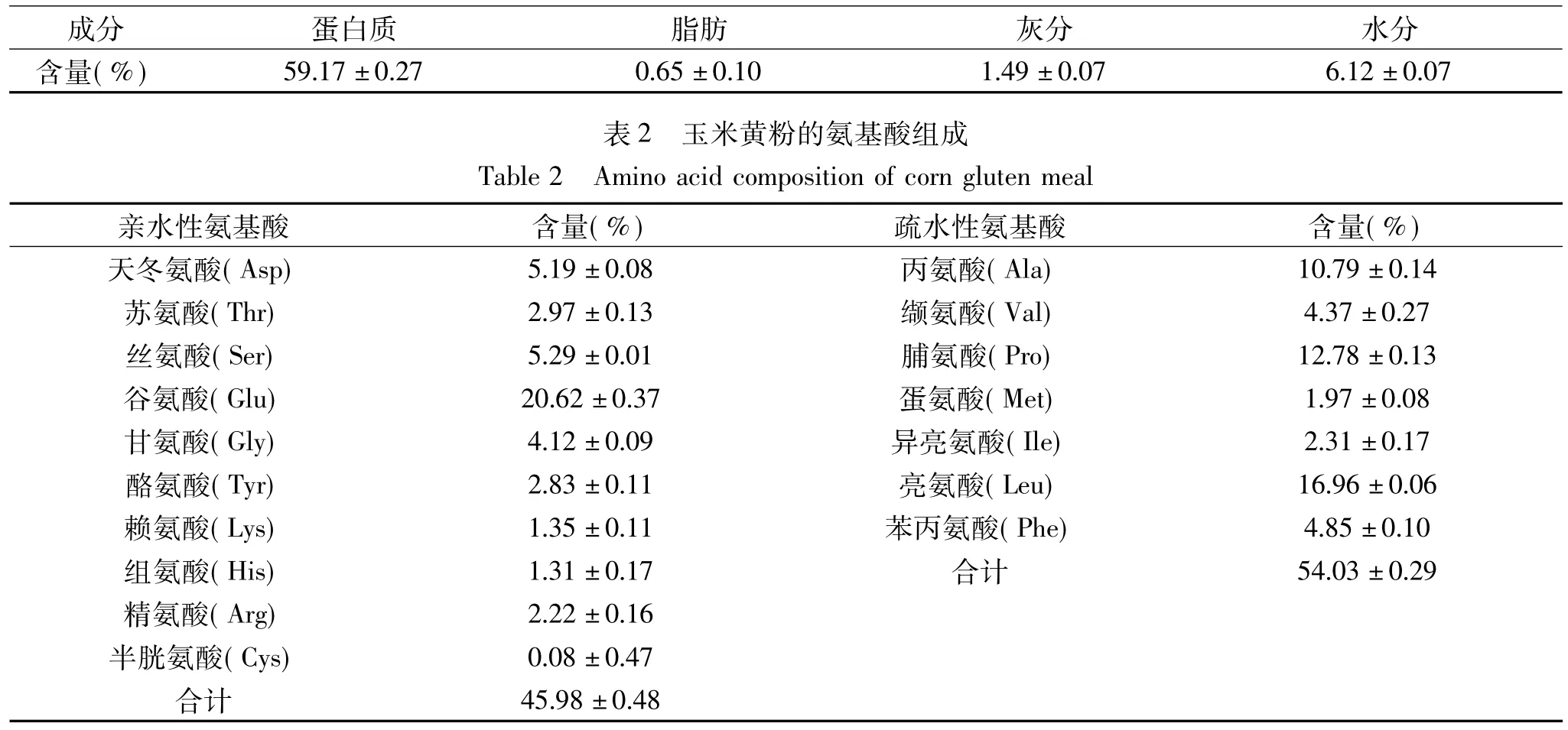
表1 玉米黃粉的基本成分Table 1 Basic components of corn gluten meal
2.2 不同分子量HFRP的制備結(jié)果
由圖1可見,HFRP經(jīng)Sephadex G15分離后得到SE-F1、SE-F2和 SE-F3,共3個(gè)組分。根據(jù)凝膠色譜吸附原理[25],分子量 SE-F1(493.46~912.835 Da) >SE-F2(204.213~493.46 Da) >SE-F3( <204.213 Da),并且SE-F1組分的含量最多。分別將3個(gè)組分多次收集,冷凍干燥后備用。
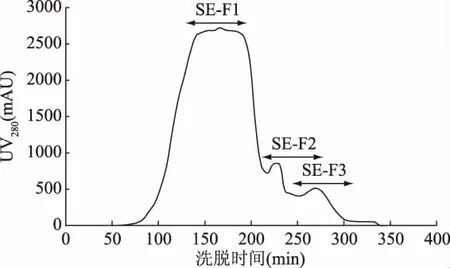
圖1 高F值活性肽的Sephadex G15凝膠柱分離圖譜Fig.1 The spectrum of high Fischer ratio peptide on a column of Sephadex G-15
2.3 不同電荷性HFRP的制備結(jié)果
為分離得到不同電荷特性的活性肽組分,本試驗(yàn)按照1.2.4中提供的方法,將制備得到的HFRP進(jìn)行分離,得到帶有不同電荷的組分(CM-Fx和DE-Fx),陽離子和陰離子層析分離結(jié)果分別見圖2和圖3。圖2中HFRP經(jīng)陽離子層析介質(zhì)CM FF 16/10分離,得到CM-F1、CM-F2和CM-F3共3個(gè)組分。根據(jù)陽離子層析原理,固定相本身帶有負(fù)電荷,當(dāng)待分離活性肽的電荷小于所使用平衡液的pH時(shí),多肽帶有負(fù)電,因此不被吸附,根據(jù)電荷性由弱到強(qiáng)依次被平衡液洗脫下來,而當(dāng)活性肽所帶的電荷大于平衡液的pH時(shí),多肽帶有正電而被吸附到樹脂的負(fù)電荷基團(tuán)上,這些多肽需要更高強(qiáng)度的鹽溶液下才能洗脫下來[26]。陰離子交換樹脂層析原理與陽離子交換樹脂層析原理相反。圖3中HFRP經(jīng)陰離子層析介質(zhì)DEAE FF 16/10分離,得到 DE-F1、DE-F2、DE-F3共3 個(gè)組分。分別將6個(gè)組分多次收集,冷凍干燥后備用。
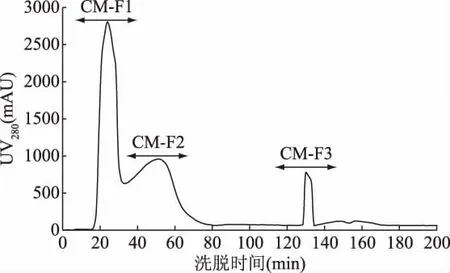
圖2 高F值活性肽的陽離子分離圖譜Fig.2 The spectrum of high Fischer ratio peptide on a column of cations
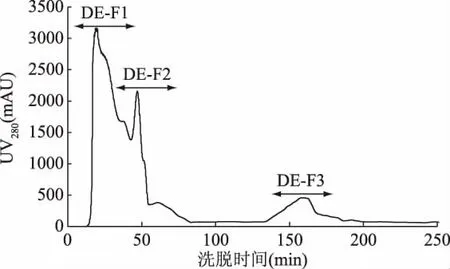
圖3 高F值活性肽的陰離子分離圖譜Fig.3 The spectrum of high Fischer ratio peptide on a column of anions
2.4 不同疏水性HFRP的制備結(jié)果
由圖4可知,HFRP經(jīng)疏水層析填料 Octyl Sepharose 4 Fast Flow洗脫后共出現(xiàn)3個(gè)峰,得到OC-F1、OC-F2和OC-F3共3個(gè)組分。隨著時(shí)間的延長,洗脫液中鹽離子濃度逐漸增大,被洗脫下來的組分,其疏水性越來越強(qiáng)[27],按照疏水強(qiáng)度排列為OC-F1<OC-F2<OC-F3。分別將3個(gè)組分多次收集,冷凍干燥后備用。
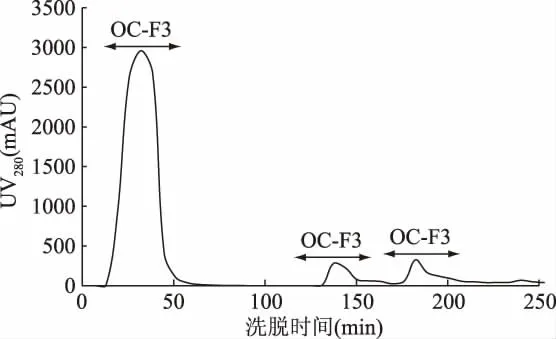
圖4 高F值活性肽的疏水性層析分離圖譜Fig.4 The spectrum of high Fischer ratio peptide on a column of hydrophobicity interaction chromatography
2.5 吸收模型評價(jià)
2.5.1 Caco-2細(xì)胞TEER值的測定結(jié)果 吸收模型構(gòu)建成功與否與Caco-2細(xì)胞接種量大小密切相關(guān),本試驗(yàn)通過在相同膜面積的小池中接種1.5、2.5、3.5、4.5、5.5×105個(gè)/cm2,選擇最佳接種量。由圖5可知,隨著培養(yǎng)時(shí)間的延長,Transwell轉(zhuǎn)運(yùn)板上Caco-2細(xì)胞成膜的完整性逐漸趨于完善。接種量為1.5×105個(gè)/cm2時(shí),第22 d TEER值仍沒有達(dá)到試驗(yàn)的最低要求(TEER值>200Ω/cm2),可見接種量較小,導(dǎo)致細(xì)胞沒有形成完整的膜結(jié)構(gòu)。接種量>2.5×105個(gè)/cm2時(shí),第8 d以后TEER值均有增長,第9 d達(dá)到400Ω/cm2。但是繼續(xù)培養(yǎng)后發(fā)現(xiàn),接種量為4.5×105個(gè)/cm2和5.5×105個(gè)/cm2的試驗(yàn)孔,TEER值在16 d之后呈現(xiàn)下降的趨勢,可能是由于細(xì)胞接種量過密導(dǎo)致的局部隆起、破裂產(chǎn)生孔洞,相比之下,接種量為2.5×105個(gè)/cm2和3.5×105個(gè)/cm2時(shí),TEER值穩(wěn)定增長并能保持在400Ω/cm2左右,說明在此接種范圍內(nèi)所造模型能夠形成完整的膜結(jié)構(gòu),綜合考慮選擇2.5×105個(gè)/cm2為最佳接種量,雖然在此接種量的條件下,TEER值在第10 d之后已經(jīng)達(dá)到試驗(yàn)要求,但是Caco-2細(xì)胞還只是分裂復(fù)制形成單層膜結(jié)構(gòu),并沒有開始分化形成類似于小腸的微絨毛結(jié)構(gòu),因此,吸收試驗(yàn)還應(yīng)在接種后第21 d后進(jìn)行試驗(yàn)。
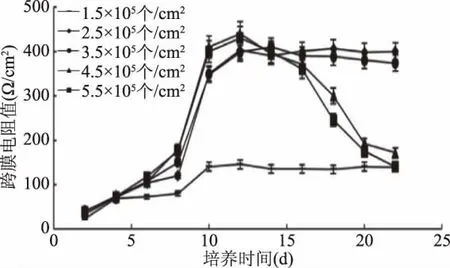
圖5 不同接種量不同的時(shí)間段12孔TransWell培養(yǎng)板細(xì)胞的跨膜電阻值Fig.5 TEER curves of the Caco-2 monolayer in a TransWell 12-well plate at different inoculation amounts and different periods
2.5.2 Caco-2細(xì)胞熒光黃通透率的測定結(jié)果 在21 d培養(yǎng)的Caco-2單細(xì)胞層熒光黃轉(zhuǎn)運(yùn)的熒光黃通透率(Papp)為(0.086±0.04) ×10-6cm/s,小于轉(zhuǎn)運(yùn)實(shí)驗(yàn)規(guī)定的 1.0 ×10-6cm/s[28],說明所形成的單細(xì)胞層完整性符合實(shí)驗(yàn)要求,可用于轉(zhuǎn)運(yùn)實(shí)驗(yàn)。
2.5.3 Caco-2細(xì)胞堿性磷酸酶活性的測定結(jié)果 在21 d培養(yǎng)的Caco-2單細(xì)胞層AP、BL側(cè)堿性磷酸酶活性 AP/BL>10[28],說明吸收模型分化完全。
本實(shí)驗(yàn)建立的 Caco-2細(xì)胞模型的 TEER值(200~1000 Ω/cm2)[20]、熒光黃通透率( < 1.0 ×10-6cm/s)[27]和堿性磷酸酶活性(AP/BL > 10)[29],符合體外模擬胃腸消化實(shí)驗(yàn)要求,可用于HFRP消化吸收特性的研究。
2.6 不同分子特性的HFRP BL側(cè)透過多肽一級質(zhì)譜測定結(jié)果
2.6.1 不同分子量的HFRP BL側(cè)透過多肽一級質(zhì)譜測定結(jié)果 向BL側(cè)加入p H7.2的HBSS 1.5 mL,向AP側(cè)加入20 mg/mL、pH7不同分子量的HFRP溶液0.5 mL,1.5 h后收集BL側(cè)溶液進(jìn)行質(zhì)譜鑒定。通過將BL側(cè)多肽排除空白(模擬腸液),得到寡肽群1(OP1,Oligo-Peptides1)。通過將寡肽群1與 AP側(cè)多肽的保留時(shí)間和母離子大小對比,來判斷可以完整通過模擬腸壁的多肽,得到寡肽群2(OP2,Oligo-Peptides2)。通過將寡肽群2(OP2,Oligo-Peptides2)與未經(jīng)模擬腸壁消化的不同分子量的HFRP組分對比,尋找具有相同保留時(shí)間和母離子大小的多肽,得到的寡肽群3(OP3,Oligo-Peptides3),OP3為可完整透過模擬腸壁的HFRP組分,選擇不同分子量的HFRP中具有代表性的譜峰進(jìn)行研究,數(shù)據(jù)分析結(jié)果如表3所示。由表3可知,從BL側(cè)檢測得到物質(zhì)的分子量<500,這一現(xiàn)象與Korhonen等[30]的研究中發(fā)現(xiàn)的通常只有2~6個(gè)氨基酸殘基的肽能夠完整通過腸壁,被完整吸收的理論相一致;同時(shí)可以發(fā)現(xiàn),分子量越小的多肽,越容易被完整吸收。同時(shí)小腸上皮細(xì)胞膜為磷脂雙分子層結(jié)構(gòu),導(dǎo)致脂溶性和疏水性強(qiáng)的寡肽易于透過細(xì)胞層進(jìn)入機(jī)體內(nèi)環(huán)境[31]。
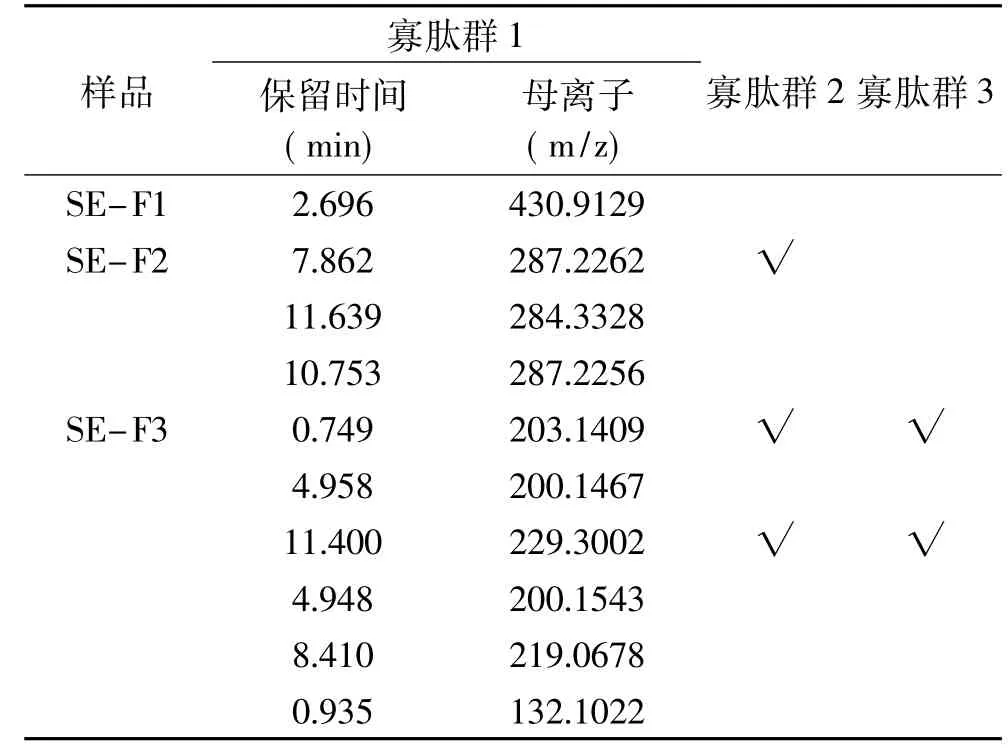
表3 不同分子量的HFRPBL側(cè)透過多肽一級質(zhì)譜圖表Table 3 First-order mass spectrometry chart of different molecular HFRPthrough BL side
2.6.2 不同電荷性的HFRP BL側(cè)透過多肽一級質(zhì)譜測定結(jié)果 向BL側(cè)加入p H7.2的HBSS 1.5 mL,向AP側(cè)加入20 mg/mL、p H7不同電荷性的HFRP溶液0.5 mL,1.5 h后收集BL側(cè)溶液進(jìn)行質(zhì)譜鑒定。由此得到寡肽群1(OP1,Oligo-Peptides1)、寡肽群2(OP2,Oligo-Peptides2)和寡肽群 3(OP3,Oligo-Peptides3)。此時(shí)得到OP3為可完整透過模擬腸壁的HFRP組分,選擇陽離子組分(CM-FX)和陰離子組分(DE-Fx)具有代表性的譜峰進(jìn)行研究,數(shù)據(jù)分析結(jié)果如表4和表5所示。由表4和表5對比可知,溶液中帶有正電荷的多肽比帶有負(fù)電荷的多肽更容易透過模擬腸壁,并且正電荷性越強(qiáng),其透過趨勢越明顯。Shimizu等[30]的研究中發(fā)現(xiàn)的帶有正電荷的物質(zhì)多數(shù)能夠通過親水的旁路途徑被轉(zhuǎn)運(yùn)吸收,而帶有負(fù)電的物質(zhì)不能通過該路徑,這一現(xiàn)象與此研究相符。
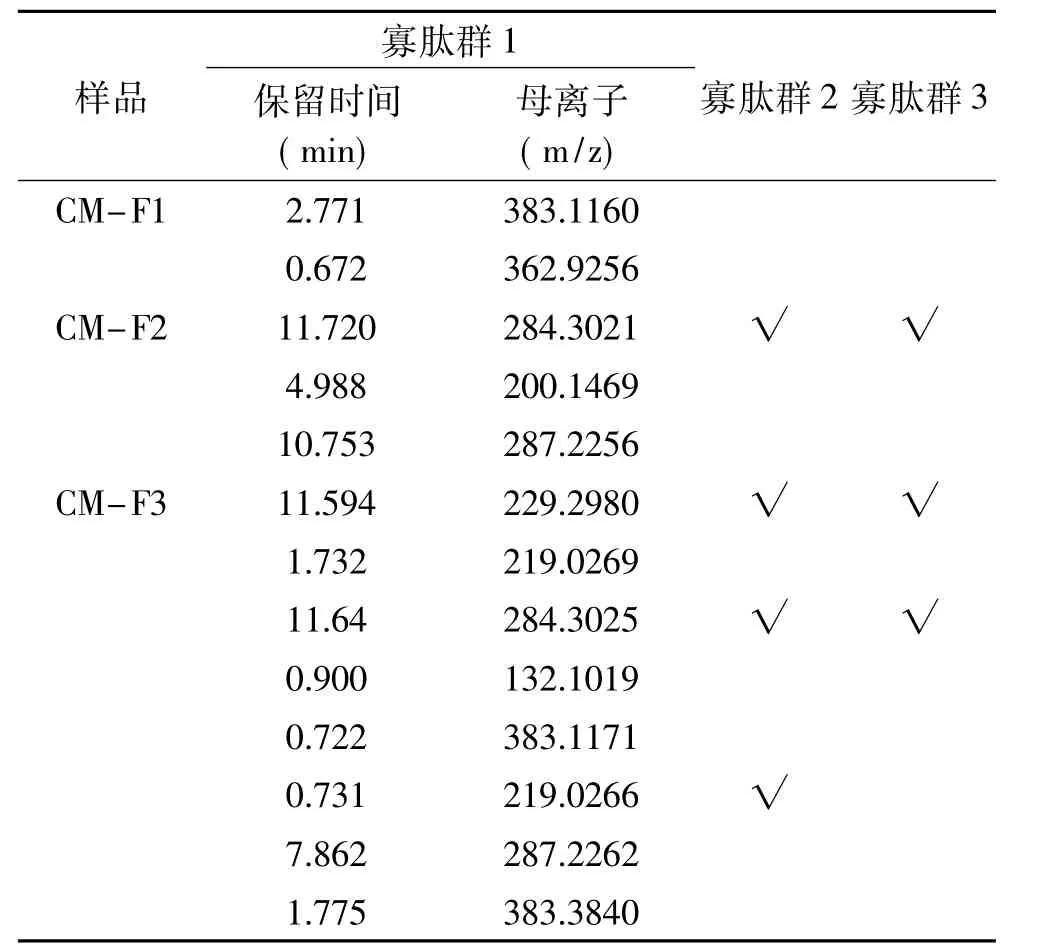
表4 不同電荷性(陽離子)的HFRPBL側(cè)透過多肽一級質(zhì)譜圖表Table 4 First-order mass spectrometry chart of different cations HFRP through BL side
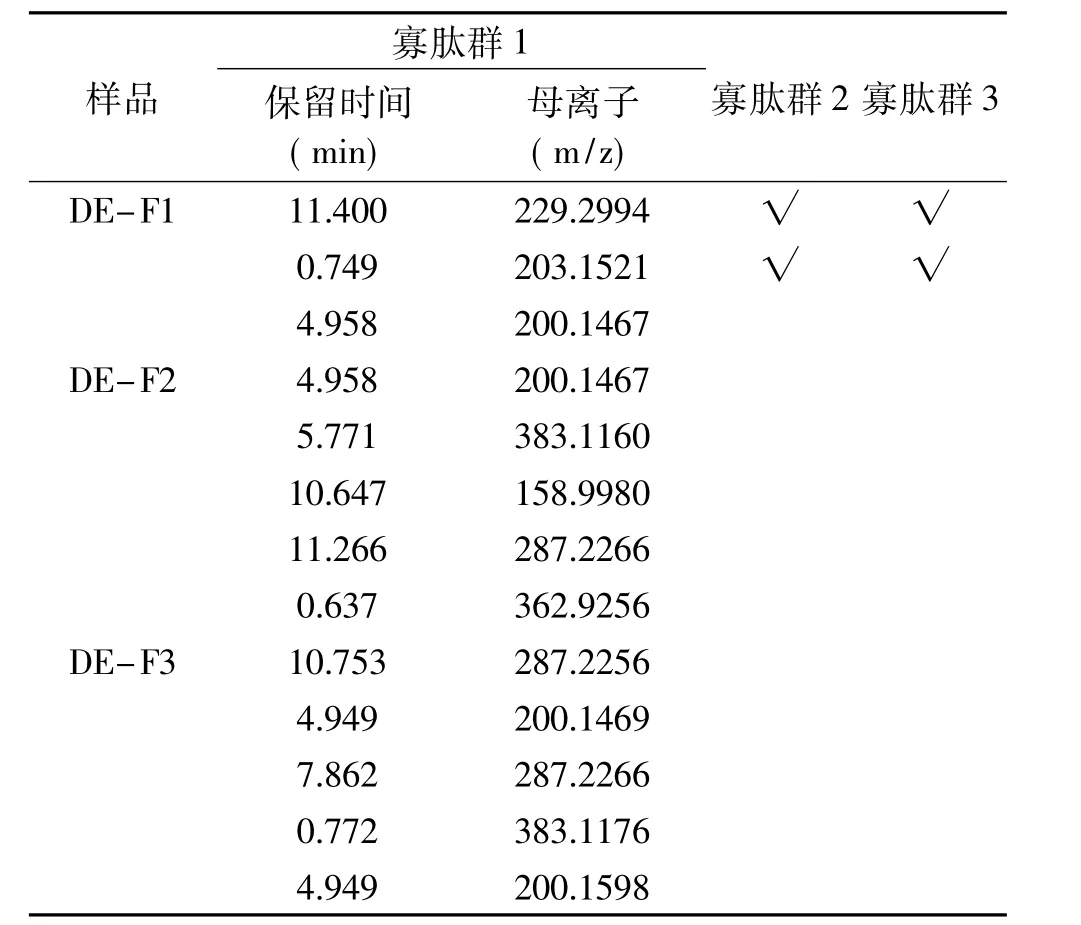
表5 不同電荷性(陰離子)的HFRP BL側(cè)透過多肽一級質(zhì)譜圖表Table 5 First-order mass spectrometry chart of different anions HFRPthrough BL side
2.6.3 不同疏水性的HFRP BL側(cè)透過多肽一級質(zhì)譜測定結(jié)果 向BL側(cè)加入p H7.2的HBSS 1.5 mL,向AP側(cè)加入20 mg/mL、p H7不同疏水性的HFRP溶液0.5 mL,1.5 h后收集BL側(cè)溶液進(jìn)行質(zhì)譜鑒定。由此得到寡肽群 1(OP1,Oligo-Peptides1)、寡肽群 2(OP2,Oligo-Peptides2)和寡肽群 3(OP3,Oligo-Peptides3)。此時(shí)得到OP3為可完整透過模擬腸壁的HFRP組分,選擇各疏水性組分(OC-FX)具有代表性的譜峰進(jìn)行研究,數(shù)據(jù)分析結(jié)果如表6所示。由表6可知,三種組分的疏水性強(qiáng)弱依次為OC-F3>OC-F2>OC-F1,隨著疏水性的增強(qiáng),靠近細(xì)胞膜更加容易,吸收轉(zhuǎn)運(yùn)通過細(xì)胞膜的多肽種類也依次增多。有研究[32]表明,某些肽的疏水性與其細(xì)胞透過率呈正相關(guān),并且主動運(yùn)輸途徑需要疏水性較高的肽參加才能完成轉(zhuǎn)運(yùn)吸收。
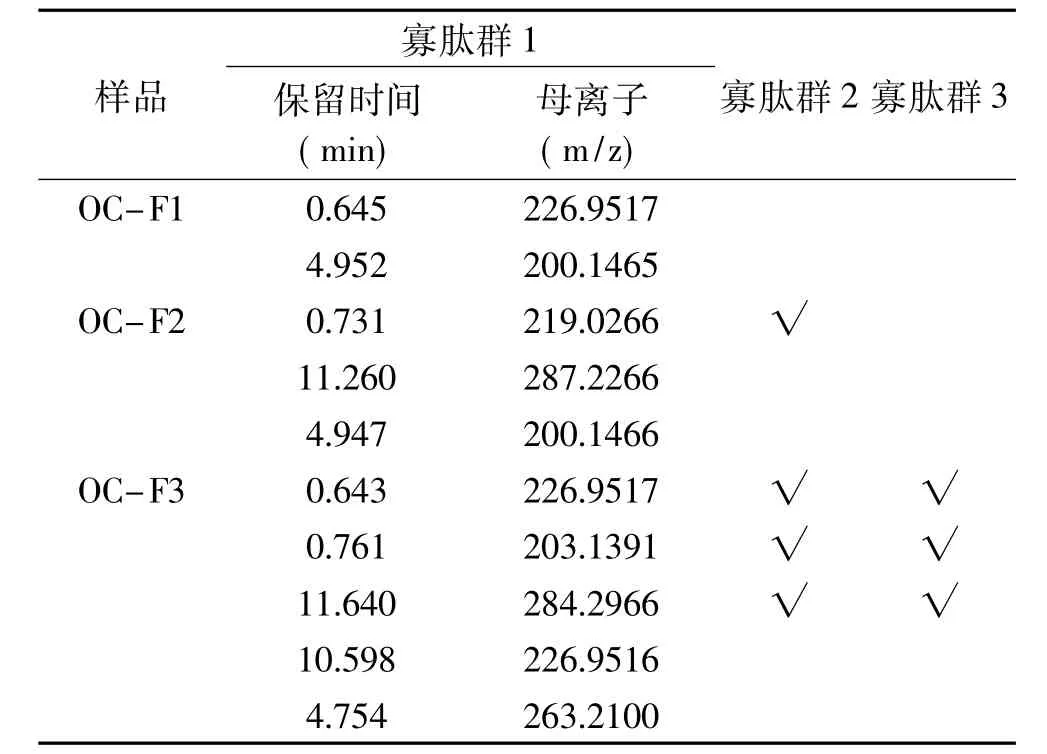
表6 不同疏水性的HFRPBL側(cè)透過多肽一級質(zhì)譜圖表Table 6 First-order mass spectrometry chart of different hydrophobicity HFRP through BL side
2.6.4 不同分子特性的高吸收多肽序列鑒定結(jié)果
選擇可以被腸壁完整吸收的不同分子特性多肽的寡肽群3,將其進(jìn)行二級質(zhì)譜掃描,根據(jù)子離子中出現(xiàn)的特征離子峰手動解譜,解譜結(jié)果較為復(fù)雜,只能鑒定出4種物質(zhì),結(jié)果見表7。由表7可知,得到的能夠透過模擬腸壁的寡肽結(jié)構(gòu)均為二肽,證明小分子多肽更容易透過腸壁結(jié)構(gòu)而被完整吸收。經(jīng)過分析,能夠完整透過腸壁的多肽分別為LA、IP、PL、HQ共4條。
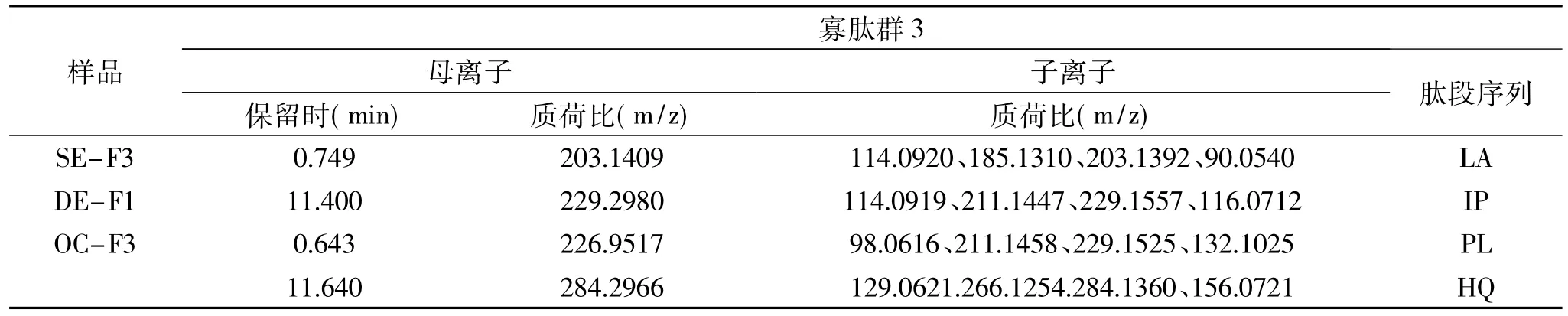
表7 目的離子二級質(zhì)譜圖表Table 7 Secondary ion mass spectrometry chart of target ions
2.6.5 高吸收組分中耐消化結(jié)構(gòu)鑒定結(jié)果 經(jīng)對比找到HFRP中4條多肽能夠完整通過模擬腸壁而結(jié)構(gòu)不被破壞,將這4條多肽與相對應(yīng)組分模擬胃腸消化后產(chǎn)物對比,即可驗(yàn)證這4個(gè)組分是否能夠耐受胃腸消化酶的裂解作用,經(jīng)過對比發(fā)現(xiàn),組分PL和HQ在胃腸消化液中同樣存在,并且出峰時(shí)間和母離子大小相當(dāng),子離子碎片相同,表明這兩個(gè)二肽可以在2 h胃液消化和2 h腸液消化下穩(wěn)定存在。
3 結(jié)論
本實(shí)驗(yàn)選用支鏈氨基酸含量高達(dá)23.79%的玉米黃粉為底物,通過堿性蛋白酶和風(fēng)味蛋白酶復(fù)合酶解制備得到HFRP,然后按照分子量、電荷性和疏水性進(jìn)行分離,進(jìn)行轉(zhuǎn)運(yùn)吸收試驗(yàn)。結(jié)果表明,HFRP中短肽LA、IP、PL和HQ能夠以完整形式被吸收,其中短肽PL和HQ既能耐受住胃液的消化,又能夠被腸壁在不破壞結(jié)構(gòu)的條件下完整吸收。由此推測,從此HFRP中分離鑒定出的短肽PL和HQ具有分子量小、在溶液中帶有正電荷、疏水性程度高的特性,且此特性的短肽具有優(yōu)先吸收和耐胃腸消化的特點(diǎn),為新型活性肽保健食品的研究開發(fā)提供一定理論依據(jù)和技術(shù)支持。

