枝瑚菌多糖的結(jié)構(gòu)及其免疫調(diào)節(jié)活性
董明明,丁 祥,2,宋 波,蔣 琳,劉 影,侯怡鈴,*
(1.西華師范大學(xué)生命科學(xué)學(xué)院,西南野生動(dòng)植物資源保護(hù)教育部重點(diǎn)實(shí)驗(yàn)室,四川南充637009;2.西華師范大學(xué)環(huán)境科學(xué)與工程學(xué)院,四川南充637009)
枝瑚菌(Ramaria flaccida(Fr.)Quél.)是一種常見(jiàn)的真菌科類。子實(shí)體小,分枝多且稠密,柄短,通常從柄基部分枝,菌肉柔軟,擔(dān)子細(xì)長(zhǎng)呈棍棒狀[1]。主要分布于安徽、西藏、貴州、云南、四川等地,多生于闊葉林或針葉林地上,一般成叢生生長(zhǎng),產(chǎn)量較高,但其子實(shí)體現(xiàn)多為野生采摘,未見(jiàn)有人工栽培的報(bào)道。有研究表明,該菌液體發(fā)酵菌絲體與子實(shí)體的化學(xué)組成極為相似,且菌絲產(chǎn)量可達(dá)到9.45 g/L[2-4]。此外,據(jù)報(bào)道,該科各屬含有很多別具風(fēng)味的食用菌,部分枝瑚菌對(duì)于艾氏癌(EC)和小白鼠肉瘤(S-180)有很強(qiáng)抑制作用,是我國(guó)野生食用真菌資源中極為寶貴的組成部分,所以該類真菌具有較大研究?jī)r(jià)值[5]。
食用菌多糖是食用菌子實(shí)體或菌絲中存在的一類活性多糖,是食藥用真菌中能夠起到保健和醫(yī)療的重要成份[6]。研究表明,食用菌多糖具有抗腫瘤、抗病毒、抗氧化、抗衰老、調(diào)節(jié)免疫機(jī)能、提高心肌保護(hù)、降血脂等生物活性,并且對(duì)人體毒副作用相對(duì)較小,受到越來(lái)越多人的關(guān)注[7-11]。
目前,對(duì)于枝瑚菌的研究主要在其成分含量測(cè)定以及抗氧化上,對(duì)枝瑚菌多糖的免疫調(diào)節(jié)活性方面還沒(méi)有報(bào)道[12]。本文采用熱水浸提法、Sevage法和乙醇醇沉得到粗多糖,再經(jīng)DEAE-52纖維素層析法純化枝瑚菌多糖。在提取分離到純化的枝瑚菌多糖基礎(chǔ)上,采用傅里葉變換紅外光譜儀(FT-IR),體外細(xì)胞培養(yǎng)法對(duì)其結(jié)構(gòu)和免疫調(diào)節(jié)活性兩個(gè)方面進(jìn)行了研究。通過(guò)此研究有助于開(kāi)發(fā)利用枝瑚菌多糖資源,并且為進(jìn)一步研究其免疫調(diào)節(jié)機(jī)制以及藥用價(jià)值方面提供理論參考。
1 材料與方法
1.1 材料與儀器
枝瑚菌子實(shí)體(Ramaria flaccida(Fr.)Quél) 四川省阿壩藏族羌族自治州小金縣,在西華師范大學(xué)丁祥教授鑒定后,放于烘箱中(65℃)烘干過(guò)夜,待其子實(shí)體樣本完全干燥后,4℃保存于西華師范大學(xué)生命科學(xué)學(xué)院,西南野生動(dòng)植物資源保護(hù)教育部重點(diǎn)實(shí)驗(yàn)室;DEAE-52纖維素柱 生興生物技術(shù)(南京)有限公司;透析袋 Sephadex G-200(Mw≥7 kDa) Biosharp公司;NaOH、NaCl和苯酚 生工科技(四川)有限公司;無(wú)水乙醇、濃硫酸、濃鹽酸 上緯精細(xì)化工(上海)有限公司,以上試劑均為分析純;小鼠巨噬細(xì)胞(RAW264.7)、T淋巴細(xì)胞、B淋巴細(xì)胞 金凱生物技術(shù)(成都)有限公司;Roswell Park Memorial Institute-1640培養(yǎng)基、雙抗、胎牛血清 Thermo Fisher Scientific公司(美國(guó));脂多糖(LPS) Sigma公司(美國(guó));細(xì)胞計(jì)數(shù)試劑盒(CCK-8試劑盒) 博升生物科技(上海)有限公司;中性紅試劑 生工生物工程(上海)股份有限公司;一氧化氮檢測(cè)試劑盒 碧云天生物技術(shù)公司;小鼠TNF α、IL-2、IL-6、IL-10 ELISA 免疫試劑盒 博士德生物工程(武漢)有限公司。
TU-1901/1900系列傅立葉紅外光譜儀 北京晶品賽思科技有限公司;BPN-80CH(UV)CO2細(xì)胞培養(yǎng)箱 上海一恒科學(xué)儀器有限公司;SE-CJ-1F型-超凈工作臺(tái) 蘇州安泰空氣技術(shù)有限公司;318Mc型-酶標(biāo)儀 上海三科儀器有限公司。
1.2 實(shí)驗(yàn)方法
1.2.1 枝瑚菌多糖的分離提取 精確稱取枝瑚菌子實(shí)體500 g,將其剪成小段放于烘箱中,65℃烘干過(guò)夜,第2 d取出子實(shí)體用粉碎機(jī)粉碎,將子實(shí)體粉末和蒸餾水以1∶30(g/mL)的比例在95℃的恒溫水浴鍋中水浴攪拌3 h,后將混合液10000 r/min離心15 min,收集上清液并且用旋轉(zhuǎn)蒸發(fā)儀旋轉(zhuǎn)濃縮至200 mL[13-14]。然后用 Sevage 法除去濃縮液中的蛋白質(zhì),然后加入三倍體積的無(wú)水乙醇并攪拌,出現(xiàn)絮狀沉淀物,收集沉淀并放入烘箱(65℃)干燥處理,得到枝瑚菌粗多糖[15]。將粗多糖加蒸餾水溶解,最終溶解的體積為200 mL。取3 mL加入到DEAE-52纖維素柱中,以5 mL/min的流速通過(guò),然后用150 mL蒸餾水過(guò)柱,收集洗脫液[16]。用硫酸-苯酚法測(cè)定洗脫液多糖[17]。將洗脫液濃縮至5 mL,用透析袋透析,持續(xù)3 d,早晚?yè)Q蒸餾水,除去小分子化合物,凍干[18]。得到純化的枝瑚菌多糖,命名為RF-S。
1.2.2 傅里葉變換紅外光譜儀(FT-IR)測(cè)定RF-S的結(jié)構(gòu) 取2 mg RF-S與200 mg干燥的KBr研磨混勻后壓片,用 FT-IR 在 4000~400 cm-1區(qū)間內(nèi)掃描[19]。
1.2.3 RF-S對(duì)巨噬細(xì)胞、B淋巴細(xì)胞和T淋巴細(xì)胞的增殖作用 采用細(xì)胞計(jì)數(shù)試劑盒(CCK-8法)測(cè)定RF-S對(duì)巨噬細(xì)胞、B淋巴細(xì)胞和T淋巴細(xì)胞的增殖影響[20-21]。將 PBS 緩沖液(NaCl 8 g+KCl 0.2 g+Na2HPO41.44 g+KH2PO40.24 g+H20 1000 mL)(p H=7)加入96孔板四周,其余每孔分別加入100μL的1×105CFU/mL濃度的細(xì)胞懸浮液,置于37℃、5%CO2的培養(yǎng)箱中培養(yǎng)24 h。空白對(duì)照組的每孔分別加入培養(yǎng)液(RPMI-1640培養(yǎng)基90%+胎牛血清10%+雙抗1%);陽(yáng)性對(duì)照組的每孔分別加入100μL脂多糖(LPS)溶液,終濃度為5μg/mL;RF-S藥物組的每孔分別加入100μL RF-S溶液(質(zhì)量終濃度為 0.625、1.25、2.5、5 μg/mL),繼續(xù)培養(yǎng) 24 h。然后每孔加入5μL CCK-8溶液孵育3 h,測(cè)定450 nm下吸光值,記錄結(jié)果,并拍照。其增值率(%)=[OD(實(shí)驗(yàn)組)-OD(空白對(duì)照組)]/OD(空白對(duì)照組)×100。注:實(shí)驗(yàn)組即為陽(yáng)性對(duì)照組和四個(gè)RF-S藥物組。
1.2.4 RF-S對(duì)巨噬細(xì)胞吞噬中性紅能力的影響 用中性紅法檢測(cè)RF-S對(duì)巨噬細(xì)胞吞噬能力的影響[22-23]。將 PBS緩沖液加入 96孔板四周,其余每孔分別加入100μL的1×105CFU/mL濃度的細(xì)胞懸浮液,置于37℃、5%CO2的培養(yǎng)箱中培養(yǎng)24 h。空白對(duì)照組:每孔分別加入100μL培養(yǎng)液;陽(yáng)性對(duì)照組:每孔分別加入100μL LPS溶液,終濃度為5μg/mL;RF-S藥物組:每孔分別加入100μL RF-S溶液(質(zhì)量終濃度為0.625、1.25、2.5、5 μg/mL),繼續(xù)培養(yǎng)24 h 吸出上清液丟棄,再每孔分別加入100μL 0.075%中性紅溶液,吞噬1~2 h后,吸出中性紅溶液。用PBS洗3次,最后每孔分別加入100μL的細(xì)胞裂解液(乙醇∶乙酸 =1∶1,v∶v)裂解 2 h,用酶標(biāo)儀檢測(cè)波長(zhǎng) 540 nm處的OD值。
1.2.5 RF-S對(duì)巨噬細(xì)胞吞噬熒光微球能力的影響 與中性紅的吞噬實(shí)驗(yàn)類似,加藥繼續(xù)培養(yǎng)后,吸出上清液,再每孔加入100μL預(yù)處理過(guò)的熒光微球(微球濃度為1 ×107/mL),吞噬1~2 h,吸出上清[24]。PBS洗3次,再加入100μL/孔細(xì)胞裂解液(乙醇∶乙酸 =1∶1,v∶v)裂解2 h,用酶標(biāo)儀檢測(cè)波長(zhǎng)505 nm 處的OD值。
1.2.6 RF-S對(duì)巨噬細(xì)胞釋放NO能力的影響 將PBS緩沖液加入96孔板四周,其余每孔分別加入100μL的濃度為1×105CFU/mL的巨噬細(xì)胞稀釋液,37℃培養(yǎng)24 h。空白對(duì)照和實(shí)驗(yàn)組各依次分別加入:100μL細(xì)胞培養(yǎng)液、終濃度為5μg/mL的LPS溶液(陽(yáng)性對(duì)照)以及不同濃度的RF-S(終濃度為1.25、2.5、5 μg/mL),5%CO2,37 ℃ 繼續(xù)培養(yǎng) 24 h。收集上清液,按照一氧化氮檢測(cè)試劑盒說(shuō)明書(shū)操作,酶標(biāo)儀檢測(cè)波長(zhǎng)540 nm處的OD值,用亞硝酸鈉標(biāo)準(zhǔn)曲線計(jì)算培養(yǎng)上清液中 NO 含量(μmol/mL)[25-26]。
1.2.7 RF-S 對(duì)巨噬細(xì)胞的釋放 IL-2、IL-6、IL-10和TNFα能力的影響 將PBS緩沖液加入96孔板四周,其余每孔分別加入100μL的濃度為1×105CFU/mL的巨噬細(xì)胞稀釋液,37℃培養(yǎng)24 h。空白對(duì)照和實(shí)驗(yàn)組各依次分別加入:100μL細(xì)胞培養(yǎng)液、終濃度為5μg/mL的LPS溶液(陽(yáng)性對(duì)照)以及終濃度為5 μg/mL 的RF-S,5%CO2,37 ℃繼續(xù)培養(yǎng)24 h。收集藥物組(LPS、RF-S)和空白對(duì)照組的上清液,按照ELISA免疫試劑盒中說(shuō)明書(shū)進(jìn)行操作,用酶標(biāo)儀測(cè)量波長(zhǎng) 450 nm 處的 OD 值[27-28]。
1.3 數(shù)據(jù)處理
所有數(shù)據(jù)均采用平均值±標(biāo)準(zhǔn)差表示,采用SPSS 18.0軟件進(jìn)行數(shù)據(jù)處理及分析,用t-test檢驗(yàn)差異的顯著性,與對(duì)照組對(duì)比,差異顯著用*表示(p<0.05),差異極顯著用**表示(p<0.01),差異不顯著(p>0.05)。
2 結(jié)果與分析
2.1 FTIR測(cè)定RF-S結(jié)構(gòu)
徐紅霞等[29]所研究的野生枝瑚菌多糖主要由甘露糖和葡萄糖兩種單糖組成,但對(duì)枝瑚菌多糖中單糖的成環(huán)形式等精細(xì)結(jié)構(gòu)未作報(bào)道。本實(shí)驗(yàn)采用傅里葉紅外光技術(shù)(FT-IR)測(cè)定RF-S結(jié)構(gòu),在如圖1所示RF-S的紅外光譜中,3427.72 cm-1為糖類分子內(nèi)或分子間氫鍵O-H的伸縮振動(dòng)峰,說(shuō)明存在分子間和分子內(nèi)氫鍵;2929.28 cm-1的吸收峰是C-H的伸縮振動(dòng)引起的;在1637.22 cm-1為C=O,C=C振動(dòng)峰;1401.89和1334.61 cm-1處的吸收峰,表明存在C-H的彎曲振動(dòng);1259.84 cm-1處的吸收峰是環(huán)上碳-氧(C-O)吸收峰。在 1200~1000 cm-1范圍內(nèi),1102.39、1079.46 和1045.50 cm-1為C-O-H 伸縮振動(dòng)和吡喃環(huán)中醚鍵C-O-C伸縮振動(dòng)。在884.99 cm-1的吸收峰是該多糖吡喃環(huán)的β-型異頭C-H變角振動(dòng)引起的。619.36 cm-1被認(rèn)為是由C-H搖擺振動(dòng)峰引起的。由此可初步證明此物質(zhì)為多糖結(jié)構(gòu),特征峰明顯,無(wú)其他結(jié)構(gòu)特征峰,應(yīng)為多糖純品,且其多糖中的單糖是以吡喃糖苷的形式存在[30]。
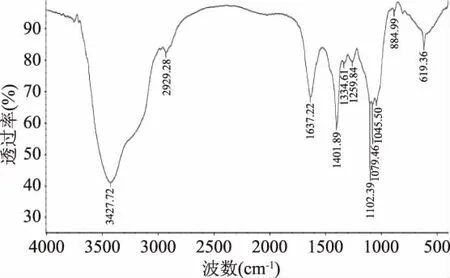
圖1 RF-S的紅外光譜圖Fig.1 Infrared spectrum of RF-S
2.2 RF-S對(duì)T淋巴細(xì)胞的增殖作用
多糖抗腫瘤性與多糖的抗氧化性和能提高機(jī)體免疫能力密切相關(guān)[31]。李華等[32]研究已表明,RF-S具有良好的抗氧化性。本實(shí)驗(yàn)運(yùn)用細(xì)胞學(xué)技術(shù),從體外水平,以巨噬細(xì)胞和淋巴細(xì)胞為靶細(xì)胞研究了RF-S的免疫調(diào)節(jié)活性。T淋巴細(xì)胞增殖效果如圖2所示,在0.625~5μg/mL濃度下,其增殖率與藥物的濃度劑量呈正相關(guān)關(guān)系。當(dāng)多糖濃度在0.625μg/mL時(shí),T淋巴細(xì)胞增殖率達(dá)20.32%(與空白對(duì)照組相比,差異極顯著(p<0.01)),當(dāng)濃度為 1.25、2.5μg/mL時(shí),增殖率分別為54.91%、57.01%(與空白對(duì)照組相比,差異極顯著(p<0.01)),超過(guò)了5μg/mL LPS的增殖效果。當(dāng)RF-S濃度為5μg/mL時(shí),T淋巴細(xì)胞增殖率達(dá)到了62.66%(與空白對(duì)照組相比,差異極顯著(p<0.01))。T淋巴細(xì)胞的增殖形態(tài)如圖3所示,隨著RF-S濃度逐漸增加,細(xì)胞分裂加快,細(xì)胞數(shù)增多。
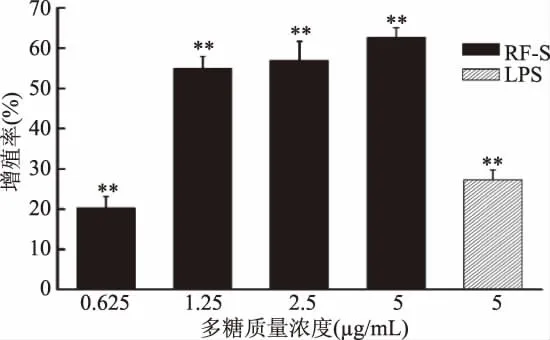
圖2 RF-S對(duì)T淋巴細(xì)胞的增殖作用Fig.2 The effect of RF-S on the proliferation of T lymphocytes注:**表示與空白對(duì)照組相比,差異極顯著(p<0.01);*表示與空白對(duì)照組相比,差異顯著(p<0.05),圖4、圖6、圖 8~圖 11 同。

圖3 RF-S對(duì)T淋巴細(xì)胞增殖形態(tài)的影響Fig.3 The cell morphology effect of RF-Son the proliferation of T cell注:(a)為空白對(duì)照組,(b)為L(zhǎng)PS組(5μg/mL);(c)~(f)為RF-S實(shí)驗(yàn)組,質(zhì)量濃度分別為0.625、1.25、2.5、5 μg/mL。圖5~圖7 同。
2.3 RF-S對(duì)B淋巴細(xì)胞的增殖作用
B淋巴細(xì)胞增殖效果如圖4所示,與空白對(duì)照組相比,RF-S藥物組與LPS組能極顯著地促進(jìn)B淋巴細(xì)胞增殖(p<0.01),并呈一定的劑量關(guān)系。當(dāng)RF-S濃度在5μg/mL時(shí),其增殖率達(dá)到最大,為67.05%(與空白對(duì)照組相比,差異極顯著(p<0.01))。圖5顯示,與空白對(duì)照組相比,RF-S藥物組的B淋巴細(xì)胞成團(tuán)明顯增大,數(shù)量明顯增加,當(dāng)濃度在5μg/mL時(shí),細(xì)胞成團(tuán)最大,數(shù)量最多。
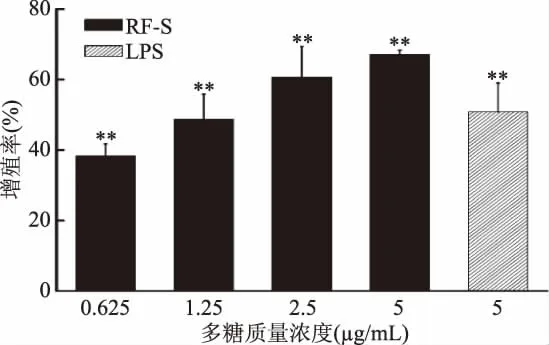
圖4 RF-S對(duì)B淋巴細(xì)胞的增殖作用Fig.4 The effect of RF-S on the proliferation of B lymphocytes

圖5 RF-S對(duì)B淋巴細(xì)胞增殖形態(tài)的影響Fig.5 The cell morphology effect of RF-Son the proliferation of B cell
2.4 RF-S對(duì)巨噬細(xì)胞的增殖作用
巨噬細(xì)胞增殖效果如圖6所示,當(dāng)加藥(RF-S和LPS)刺激時(shí),巨噬細(xì)胞的增值率極顯著高于未加藥的空白對(duì)照組(p<0.01),而且巨噬細(xì)胞數(shù)量的增加與RF-S的濃度呈劑量依賴關(guān)系。但RF-S在濃度為0.625~2.5μg/mL時(shí),增殖效果仍然不及LPS對(duì)巨噬細(xì)胞的增殖影響強(qiáng)。在5μg/mL的RF-S組中,巨噬細(xì)胞的增殖率明顯高于5μg/mL的LPS組。由圖7可看出,在藥物刺激下,巨噬細(xì)胞數(shù)量增加十分明顯。

圖6 RF-S對(duì)巨噬細(xì)胞的增殖作用Fig.6 The effect of RF-S on the proliferation of macrophage
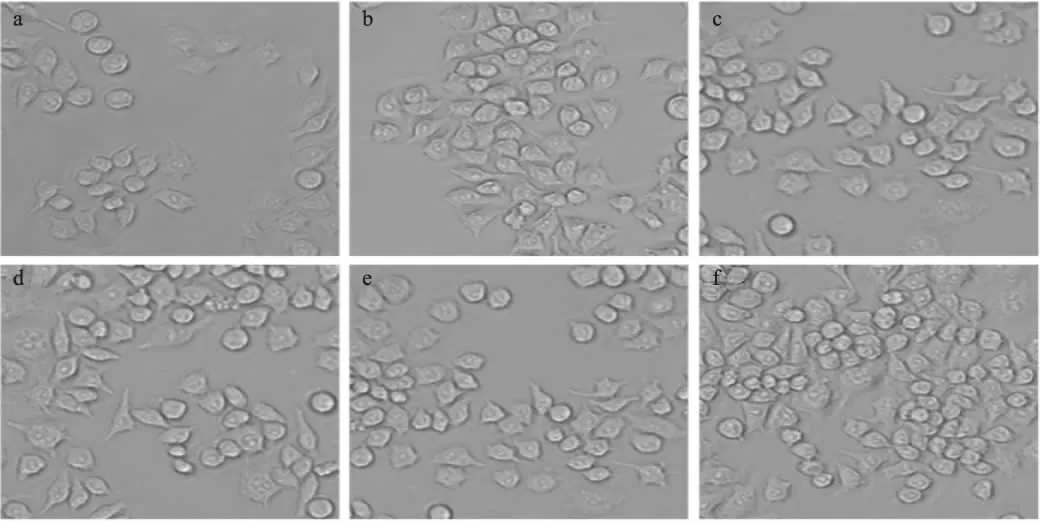
圖7 RF-S對(duì)巨噬細(xì)胞增殖形態(tài)的影響Fig.7 The cell morphology effect of RF-Son the proliferation of macrophages
2.5 RF-S對(duì)巨噬細(xì)胞吞噬中性紅能力的影響
巨噬細(xì)胞吞噬中性紅能力的結(jié)果如圖8所示,在RF-S濃度為1.25μg/mL時(shí),巨噬細(xì)胞吞噬中性紅的能力略有提高但未達(dá)顯著水平(p>0.05);在LPS(5 μg/mL)以及RF-S(2.5、5 μg/mL)刺激下,巨噬細(xì)胞吞噬中性紅的能力極顯著提高(p<0.01),當(dāng)RF-S在5μg/mL時(shí),藥物組的 OD值最大,略高于LPS組5μg/mL刺激下的OD值,在所有組中對(duì)中性紅的吞噬能力最強(qiáng)。
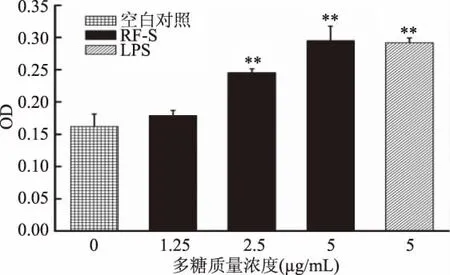
圖8 RF-S對(duì)巨噬細(xì)胞吞噬中性紅能力的影響Fig.8 Effect of RF-Son the ability of macrophages to swallow neutral red
2.6 RF-S對(duì)巨噬細(xì)胞吞噬熒光微球能力的影響
巨噬細(xì)胞吞噬熒光微球能力的結(jié)果如圖9所示,RF-S能夠以1.25~5μg/mL劑量的濃度提高巨噬細(xì)胞吞噬熒光微球的能力(p<0.01)。巨噬細(xì)胞吞噬熒光微球的能力與RF-S的濃度呈正相關(guān)。當(dāng)RF-S在5μg/mL時(shí),藥物組的OD值最大,表明此時(shí)巨噬細(xì)胞的吞噬能力最強(qiáng)。
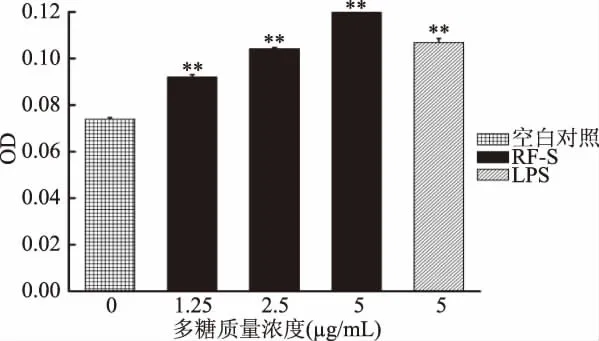
圖9 RF-S對(duì)巨噬細(xì)胞吞噬熒光微球能力的影響Fig.9 Effect of RF-Son the ability of macrophages to phagocytize fluorescent microspheres
2.7 RF-S對(duì)巨噬細(xì)胞釋放NO能力的影響
巨噬細(xì)胞釋放NO能力的結(jié)果如圖10所示,當(dāng)濃度在1.25~2.5μg/mL范圍之間時(shí),RF-S能刺激巨噬細(xì)胞產(chǎn)生NO,但未達(dá)顯著水平(p>0.05)。而在濃度為5μg/mL時(shí),RF-S可以非常顯著地刺激巨噬細(xì)胞產(chǎn)生NO(p<0.01),在三個(gè)RF-S藥物試驗(yàn)組中,NO釋放量最高;但與LPS 5μg/mL試驗(yàn)組比較,NO釋放量仍很低。
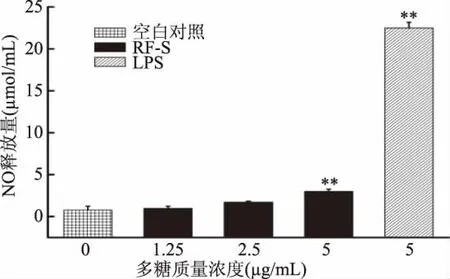
圖10 RF-S對(duì)巨噬細(xì)胞釋放NO能力的影響Fig.10 The effect of RF-Son the ability of macrophages to release NO
2.8 RF-S 對(duì)巨噬細(xì)胞釋放 IL-2、IL-6、IL-10 和TNFα能力的影響
巨噬細(xì)胞釋放 IL-2、IL-6、IL-10和 TNF α 能力見(jiàn)圖11,RF-S藥物組與LPS組均能促進(jìn)巨噬細(xì)胞分泌IL-2、IL-6、IL-10 和 TNF α。且5 μg/mL 的 RF-S刺激巨噬細(xì)胞分泌IL-2、IL-10和TNFα與空白對(duì)照組相比,具有極顯著的增強(qiáng)效果(p<0.01),對(duì)刺激巨噬細(xì)胞分泌IL-6有顯著增強(qiáng)效果(p<0.05)。

圖11 RF-S對(duì)巨噬細(xì)胞釋放 IL-2、IL-6、IL-10和 TNF α 能力的影響Fig.11 The effect of RF-Son the ability of macrophages to release IL-2,IL-6,IL-10 and TNF α
3 結(jié)論
本論文采用傅里葉紅外光技術(shù)(FT-IR)測(cè)定RF-S結(jié)構(gòu),紅外光譜顯示其有明顯的多糖結(jié)構(gòu)吸收峰,判斷該化合物為糖類化合物,且在884.99 cm-1處存在吸收峰,說(shuō)明其多糖中的單糖是以吡喃糖苷的形式存在。
在此基礎(chǔ)上本文進(jìn)一步對(duì)RF-S的免疫調(diào)節(jié)活性進(jìn)行了研究,結(jié)果表明,RF-S能極顯著地促進(jìn)巨噬細(xì)胞、T淋巴細(xì)胞和B淋巴細(xì)胞的增殖(p<0.01),并呈一定的劑量關(guān)系。在RF-S濃度為5μg/mL時(shí),巨噬細(xì)胞、T淋巴細(xì)胞和B淋巴細(xì)胞的增殖率分別為123%、62.66%和 67.05%;并且 T淋巴細(xì)胞隨著RF-S濃度增加,細(xì)胞分裂加快,細(xì)胞數(shù)增多;B淋巴細(xì)胞成團(tuán)明顯增大,數(shù)量明顯增加。其次,RF-S能夠極顯著提高巨噬細(xì)胞的吞噬能力(p<0.01),當(dāng)RF-S濃度在5μg/mL時(shí),巨噬細(xì)胞的吞噬能力最強(qiáng)。此外,RF-S能極顯著刺激巨噬細(xì)胞分泌IL-2、IL-10、TNFα和釋放NO(p<0.01),顯著刺激巨噬細(xì)胞分泌 IL-6(p<0.05)。
綜上所述,在體外實(shí)驗(yàn)中發(fā)現(xiàn),RF-S發(fā)揮抗腫瘤作用與調(diào)節(jié)巨噬細(xì)胞和淋巴細(xì)胞免疫功能有關(guān)。本論文對(duì)枝瑚菌多糖結(jié)構(gòu)和免疫調(diào)節(jié)活性研究的理論研究具有指導(dǎo)意義,對(duì)枝瑚菌資源的高值化利用和相關(guān)產(chǎn)品開(kāi)發(fā)具有很大價(jià)值,但其涉及的有關(guān)信號(hào)轉(zhuǎn)導(dǎo)通路與其分子機(jī)制還需進(jìn)一步驗(yàn)證。

