核因子κB受體活化因子通過TRPC6?NFATc1信號通路介導足細胞損傷
張鴻 梁順 杜玥 竇曹帥 張麗 談錦萍 劉雙信 梁馨苓 章斌,
1南方醫科大學第二臨床醫學院(廣州 510282);2廣東省人民醫院腎內科,廣東省醫學科學院(廣州510080)
足細胞脫落和足突融合是足細胞損傷的主要形式,也是腎小球疾病發生蛋白尿的主要原因之一。近年來足細胞研究[1]有大量報道,但其損傷機制未完全清楚。核因子κB受體活化因子(receptor activation of nuclear factor kappa B,Rank)是腫瘤壞死因子受體超家族I型跨膜蛋白,在破骨細胞的生成、淋巴細胞的發育[2]、乳腺癌的發生[3]等過程中發揮著至關重要的作用。在人類腎小球疾病患者及足細胞損傷動物模型中都發現足細胞損傷時,Rank 表達明顯升高[4];也有研究[5]報道Rank介導高糖誘導的足細胞損傷;這些研究提示Rank在足細胞損傷中發揮了重要的作用,但是其具體的分子機制仍不清楚。活化T細胞核因子(nu?clear factor of activated T?cells,NFAT)活化是導致足細胞損傷、凋亡、腎小球硬化的關鍵信號分子[6-9]。瞬時受體電位通道 6(transient receptor poten?tial channel 6,TRPC6)是足細胞膜通道蛋白,TRPC6的激活導致Ca2+內流增加,鈣調磷酸酶活化,NFATc1去磷酸化入核增加,加劇足細胞損傷[10]。本研究擬探究Rank對足細胞的效應及其機制是否與TRPC?NFATc1信號通路相關。
1 材料與方法
1.1 材料RMPI 1640培養基(CORNING);胎牛血清FBS、0.05%胰酶(Gibco);重組小鼠γ干擾素IFN?γ(ProSpec);Rank siRNA(廣州銳博);核漿蛋白提取試劑盒(凱基);podocin抗體、Ionomycin(Sigma);Rank、NFATc1、TRPC6抗體(Abcam);GAPDH 抗體(Bioworld);Synaptopodin抗體(Santa);Histone抗體(CST);熒光二抗488、熒光二抗555、Co?IP試劑盒(Thermo);SYBR GREEN(Takara);逆轉錄試劑盒、Trizol、lipofectamine 2000(Life Tech?nologies)。
1.2 足細胞培養條件性永生化小鼠足細胞系由美國J.RESIER教授(Rush University Medical Cen?ter,Chicago,IL,USA)惠贈。足細胞復蘇后用含10%FBS及(2~10)×104U/L的 IFN?γ培養基在33℃、含5%CO2培養箱中增殖,細胞融合達到75%~85%時轉入5%CO2、37℃培養箱中用5%FBS及不含IFN?γ的培養基中分化,在37℃培養10~12 d,足細胞分化成熟。所有足細胞實驗均在分化成熟后進行。
1.3 實驗分組(1)Ionomycin干預分組:Con組(空白對照組)、ionomycin組(ionomycin干預24 h);(2)Rank沉默效率驗證分組:Con組(空白對照組)、Scramble組(陰性對照組,Con?siRNA干預24 h)、Rank?siRNA#1、Rank?siRNA#2、Rank?siRNA#3(分別由對應Rank?siRNA干預24 h);(3)沉默Rank表達后分組:Con組(Ionomycin干預24 h)、Scramble組(Con?siRNA干預24 h后加入Ionomycin干預24 h)、Rank?siRNA#2組(Rank?siRNA#2干預24 h后加入Ionomycin干預24 h)。
1.4 細胞免疫熒光細胞爬片分化成熟后,用冰甲醇固定15 min,再用Triton X?100透化10 min,5%胎牛血清蛋白封閉30 min,孵育一抗在4℃搖床過夜,第2天避光孵育相應二抗及細胞核染料DAPI,用防熒光淬滅劑封片,激光共聚焦顯微鏡觀察。
1.5 siRNA轉染將50 nmol/L siRNA、250 μL opti?mem培養基與8 μL lipofectamine 2000、250 μL opti?mem培養基混勻靜置20 min,再加入含3.5 mL的無血清培養基細胞中,6 h后更換普通培養基再培養24 h。
1.6 Western印跡細胞成熟后加入蛋白裂解液(提取核蛋白加入核蛋白裂解液)刮取蛋白,用BCA法測量蛋白濃度,98℃10 min變性蛋白。制備合適濃度Western膠后,蛋白上樣,80 V電泳,200 mA 120 min電轉到PVDF膜上。再用5%牛奶封閉30 min,一抗4℃孵育過夜。第二天孵育相應二抗,化學發光液曝光,Image J軟件分析灰度值。
1.7 熒光定量PCR用Trizol提取mRNA,測定濃度,按逆轉錄試劑盒說明書使mRNA逆轉錄成cD?NA,按照SYBR Green PCR試劑盒說明書操作進行熒光定量PCR檢測目的基因表達。引物序列如下:Rank 正義鏈 5′?CCAGGAGAGGCATTATGAGC?A?3′,反義鏈 5′?ACTGTCGGAGGTAGGAGTGC?3′;GAPDH 正義鏈5′?AGGTCGGTGTGAACGGATTTG?3′,反義鏈 5′?TGTAGACCATGTAG TTGAGGTCA?3′。
1.8 免疫共沉淀(Co?IP)預冷PBS刮取蛋白后用細胞裂解液裂解(保留蛋白間連接),用磁珠Protein G封閉30 min,留取少量蛋白為Input組,加入Rank抗體特異吸附Rank蛋白復合體,4℃搖床過夜。加入磁珠Protein G與抗體Rank結合孵育30 min,用磁力架把磁珠Protein G?Rank抗體—Rank蛋白復合體拉下來,洗脫磁珠,變性蛋白,Western印跡檢測TRPC6蛋白。
1.9 統計學方法采用統計軟件SPSS 20.0進行統計學分析,符合正態分布計量資料用表示,組間比較用單因素方差分析,兩組間比較采用LSD檢驗進行,P<0.05為差異有統計學意義。
2 結果
2.1 足細胞Rank在Ionomycin刺激下表達增多用Ionomycin干預足細胞24 h后,熒光定量PCR及Western印跡結果均顯示與Con組相比,Ionomycin組足細胞中Rank表達上調(P<0.05)。見圖1A、1B。足細胞免疫熒光染色結果同樣顯示Ionomycin組中Rank表達明顯增加。見圖1C。
2.2 沉默Rank表達減少足細胞損傷通過熒光定量PCR篩選siRNA沉默效率,結果顯示Rank?siRNA#2的沉默效率最好,同時進一步通過West?ern印跡驗證Rank?siRNA#2的沉默蛋白表達效率也較高(P<0.05)。見圖2A、2B。Podocin是腎小球足細胞特異表達的跨膜蛋白,在維持足細胞形態和裂孔隔膜的結構與功能中發揮重要作用,Podocin蛋白表達下降是足細胞損傷的特征性標志[11]。通過沉默足細胞Rank表達(本研究后續沉默Rank實驗均使用Rank?siRNA#2)后,在Ionomycin損傷刺激下,足細胞標記蛋白Podocin表達較Con組上調(P<0.05)。見圖2C。
2.3 沉默Rank表達足細胞核NFATc1表達下調沉默Rank及Ionomycin干預后,Western印跡顯示Rank?siRNA#2組足細胞核NFATc1蛋白表達減少(P<0.05)。見圖3A。同樣干預下,足細胞免疫熒光染色結果顯示NFATc1主要在細胞核內表達,Rank?siRNA#2+Ionomycin組細胞核內 NFATc1表達減少。見圖3B。
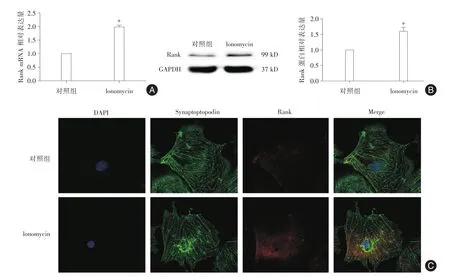
圖1 Ionomycin誘導足細胞Rank表達Fig.1 The expression of RanK was upregulated in ionomycin?treated podocytes
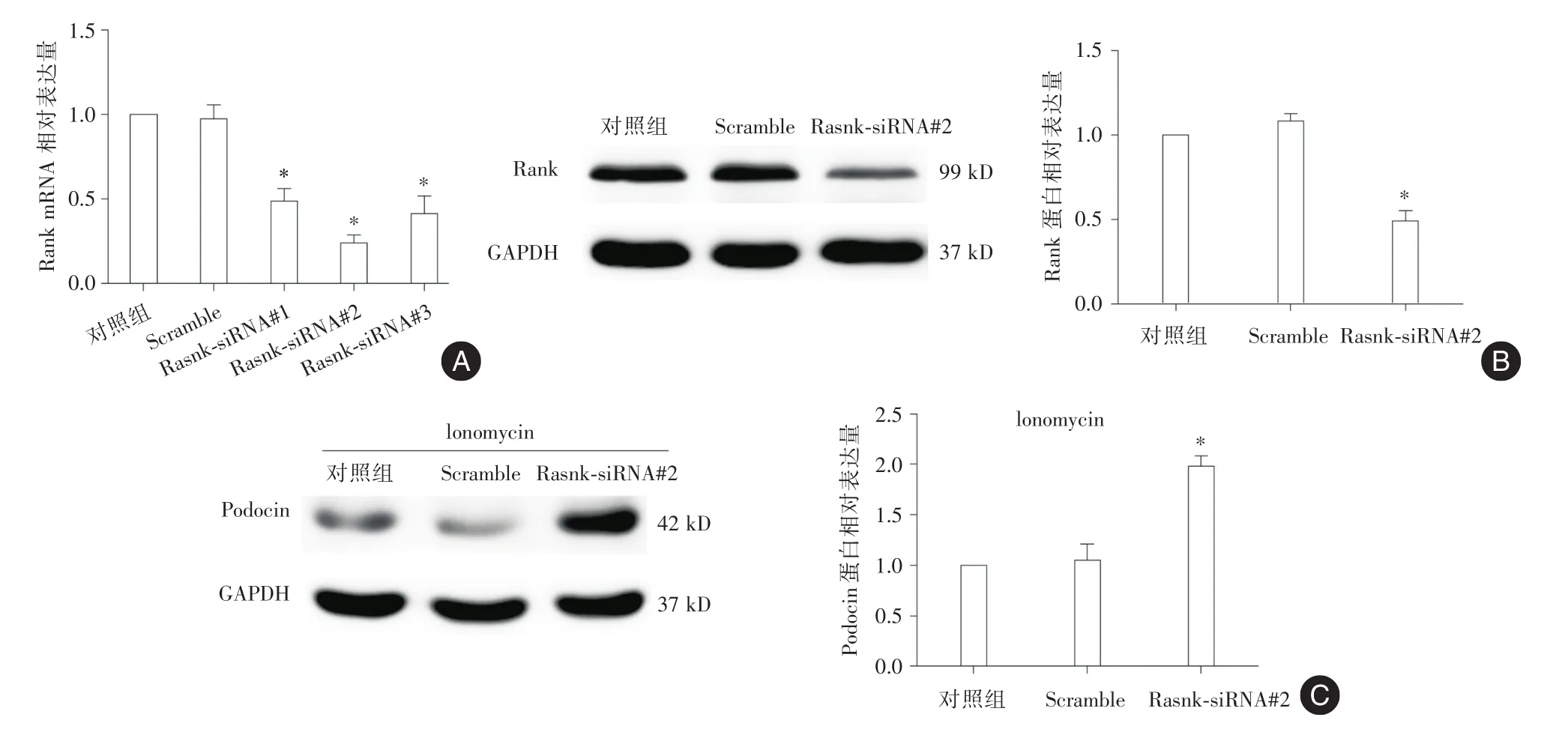
圖2 沉默Rank減少足細胞損傷Fig.2 Loss of RanK ameliorates podocyte injury
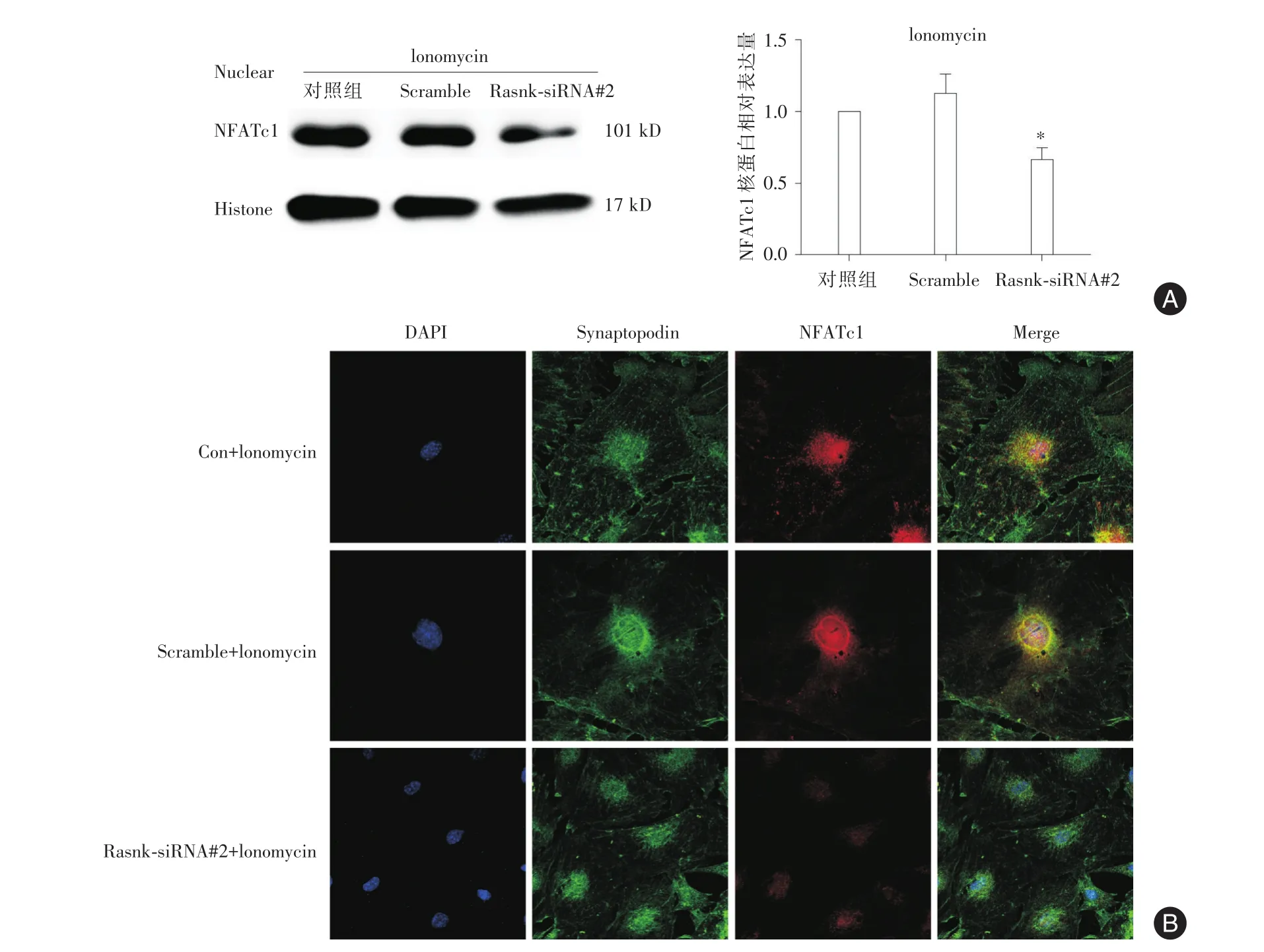
圖3 沉默Rank后足細胞核NFATc1表達減少Fig.3 Loss of RanK decreased nuclear localization of NFATc1 in injured podocytes
2.4 Rank通過結合TRPC6調控其表達沉默TRPC6并干預Ionomycin后,Western印跡顯示TRPC6蛋白表達減少(P<0.05)。見圖4A。通過Co?IP實驗檢測Rank及TRPC6間關聯,結果表明Rank蛋白結合TRPC6蛋白形成復合體,且在Ionomycin刺激下形成更多Rank?TRPC6復合體。見圖4B。
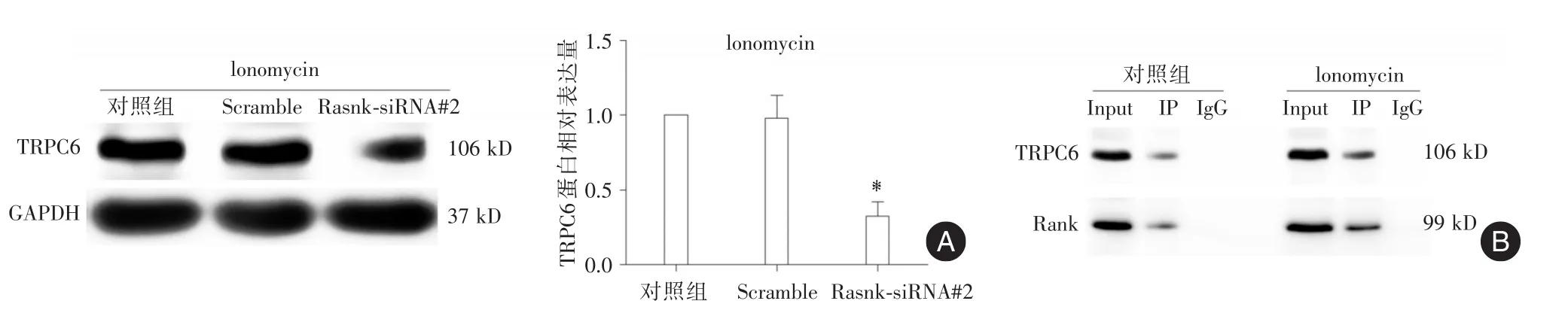
圖4 Rank結合TRPC6并調控其表達Fig.4 RanK binds to TRPC6 and regulates its protein expression
3 討論
足細胞即腎小球臟層上皮細胞,與內皮細胞、基底膜共同構成了腎小球濾過膜屏障,是腎小球濾過膜屏障的關鍵組成部分。足細胞損傷幾乎參與了所有腎小球疾病的病理改變,也是臨床治療的重要靶點[12-13]。因此,闡明足細胞的損傷機制具有重要的科學意義。
Rank是TNF受體超家族成員,RankL是其配體,Rank/RankL/OPG(骨保護素)是調節破骨細胞的分化、發育及成熟的關鍵信號通路[14-15]。同時大量研究表明Rank?RankL在免疫系統[2]、中樞神經系統[16]、乳腺癌發生[17]等都有重要作用。近年來,研究發現Rank在足細胞中也具有重要作用。本課題組前期研究發現在IgA腎病、膜性腎病及局灶節段性腎小球硬化患者足細胞中Rank表達都比正常腎組織足細胞中增多,在嘌磷霉素(PAN)及脂多糖(LPS)造模的蛋白尿模型腎小球足細胞中也誘導Rank表達上調[4]。CHEN等[5]研究發現高糖刺激可誘導足細胞Rank表達上調。Ionomycin是一種鈣離子載體,高度選擇性結合鈣離子以提高細胞內鈣離子水平,而導致足細胞損傷[6]。本研究通過Ionomycin誘導足細胞損傷,也同樣發現Ionomycin刺激下足細胞Rank在mRNA水平、蛋白水平都表達上調。足細胞免疫熒光染色結果同樣顯示Ionomycin刺激下足細胞Rank表達增加。
進一步探究足細胞損傷情況下Rank表達增加的效應,本研究觀察腎小球足細胞特異表達的跨膜蛋白Podocin情況。Podocin具有離子通道和信號轉導功能,在維持足細胞形態和裂孔隔膜的結構與功能中發揮著不可或缺的作用,在足細胞損傷情況下,標記蛋白Podocin表達減少[11]。通過篩選沉默效率高的siRNA沉默足細胞Rank表達后,在Ionomycin誘導足細胞損傷情況下沉默Rank使標記蛋白Podocin表達上調,即可部分逆轉足細胞損傷。可見足細胞中Rank表達增多可加劇足細胞損傷。但Rank是通過何種機制介導足細胞損傷的,目前并不是很清楚。課題組近年來研究發現 NFATc1 是足細胞損傷的關鍵因子[6-7,9,18-19]。轉錄因子NFAT分子家族有五個亞型,即NFAT1?5,除NFAT5外其他成員(NFAT1?4)都受鈣離子—鈣調磷酸酶酶(calcineurin,CaN)信號通路調節[20]。在靜息細胞中,NFAT主要在細胞質中保持高度的磷酸化穩定狀態。當細胞受到刺激時,Ca2+內流增加,活化CaN,Ca2+/CaN使NFAT去磷酸化進入到細胞核內,NFAT與其他轉錄因子結合調控細胞的增殖、分化、生長[20]。在足細胞中,大量研究[7?8,21]表明CaN?NFAT信號通路的活化是導致足細胞損傷、腎小球硬化的主要重要因素。臨床上對絕大多數腎小球疾病具有降尿蛋白、保護足細胞作用的環孢素A正是通過抑制CaN活化而發揮作用[22],這也進一步證實NFAT對足細胞損傷具有重要意義。本研究沉默足細胞Rank表達后,發現Ionomycin刺激下細胞核內的NFATc1蛋白表達減少。細胞免疫熒光也證實:Ionomycin刺激下NFATc1主要在細胞核內表達明顯,當沉默Rank后足細胞核內的NFATc1的表達下調。這進一步證實Rank介導足細胞損傷,其機制可能是通過正向調控NFATc1入核。
Ca2+內流激活CaN去磷酸化NFATc1,促使NFATc1入核而介導足細胞損傷,其中一個關鍵蛋白是足細胞膜上的通道蛋白TRPC6,TRPC6的活化程度決定了Ca2+內流的量,影響CaN?NFAT的活化[10]。TRPC6調節Ca2+內流活化NFAT,同時活化的NFAT也增強TRPC6表達,形成正向反饋調節加劇足細胞損傷[23]。Rank是I型膜蛋白[15],是否與足細胞膜通道蛋白TRPC6存在關聯,從而通過TRPC6?NFAT信號通路調節足細胞損傷。本研究在沉默Rank表達后,發現TRPC6蛋白表達也減少,Rank和TRPC6之間存在正向關聯。進一步通過Co?IP實驗發現Rank能結合TRPC6,且Ionomycin刺激能增強Rank?TRPC6的結合。這些結果證實:Rank通過Rank/TRPC6/NFATc1信號通路介導足細胞損傷。
本研究發現了一條新的足細胞損傷機制:Rank/TRPC6/NFATc1信號通路,闡明了Rank介導足細胞損傷的可能機制,從新的角度豐富了CaN?NFAT信號通路。但Rank是如何影響足細胞標記Podocin的表達改變,Rank介導足細胞損傷除了Rank/TRPC6/NFATc1是否還存在其他信號通路,后續筆者將繼續探究相關問題,并在動物體內進一步證實Rank/TRPC6/NFATc1信號通路對足細胞的損傷效應,為臨床治療腎小球疾病提供新的理論基礎和治療靶點。

