不同質(zhì)量濃度鰱魚(yú)肌球蛋白低溫自組裝動(dòng)力學(xué)及理化性質(zhì)
高 霞,曹立偉,熊善柏,2,胡 楊,2,尤 娟,2,劉 茹,2,*
(1.華中農(nóng)業(yè)大學(xué)食品科學(xué)技術(shù)學(xué)院,湖北 武漢 430070;2.國(guó)家大宗淡水魚(yú)加工技術(shù)研發(fā)分中心(武漢),湖北 武漢 430070)
肌球蛋白是肌纖維蛋白的重要組成部分,也是魚(yú)糜形成凝膠最重要的功能性蛋白[1-2],肌球蛋白在體外很不穩(wěn)定,會(huì)迅速組裝成微絲,呈現(xiàn)出高度有序的組裝特性[3]。組裝體的尺寸和形態(tài)受自組裝條件的影響,比如蛋白濃度、溫度[4-5]、pH值、鹽濃度[6]、鹽的種類[7]和溶劑類型等[8]。因此,可通過(guò)控制自組裝條件來(lái)制備不同的肌球蛋白組裝體,進(jìn)而設(shè)計(jì)成不同性能的產(chǎn)品。肌球蛋白大分子的自組裝需要一定的濃度,濃度較低時(shí),自組裝不能進(jìn)行[9]。隨蛋白濃度增加,蛋白分子的疏水性區(qū)域相互接觸,促使蛋白分子間相互作用[10],大分子自組裝,進(jìn)而絮凝、成膠甚至形成緊密的網(wǎng)絡(luò)結(jié)構(gòu)[11]。且隨蛋白濃度增加,蛋白凝膠的強(qiáng)度會(huì)提高[12-13]。此外,Adam等[14]研究了幾種不同濃度的大分子溶液(極稀溶液、稀溶液、高濃度溶液),證明這些大分子間的交聯(lián)依次呈現(xiàn)遞增的趨勢(shì)。魚(yú)糜加工過(guò)程中,低溫下初加工需較長(zhǎng)的時(shí)間,低溫下肌球蛋白低聚物會(huì)自組裝成簇,影響魚(yú)糜的凝膠特性[15-16],二段式加熱有利于魚(yú)糜形成高彈性和持水性的凝膠體[17]。目前大多數(shù)研究集中于較高溫度下肌球蛋白分子的組裝和成膠[18-19],對(duì)低溫下肌球蛋白自組裝的濃度效應(yīng)鮮見(jiàn)報(bào)道。研究肌球蛋白低溫自組裝動(dòng)力學(xué)及理化性能,不僅能為提高自組裝能力提供新的切入點(diǎn),還可為減少肌球蛋白在熱膠凝前不期望的自組裝,提高其熱凝膠性能提供參考。
本實(shí)驗(yàn)以鰱魚(yú)肉為原料提取肌球蛋白,采用激光共聚焦顯微鏡(confocal laser scanning microscopy,CLSM)觀察肌球蛋白組裝體的微觀結(jié)構(gòu),通過(guò)研究不同質(zhì)量濃度肌球蛋白在低溫自組裝過(guò)程中蛋白質(zhì)構(gòu)象和分子間作用,以及組裝體的濁度和粒徑的變化,來(lái)探討低溫下肌球蛋白在不同質(zhì)量濃度下自組裝的特點(diǎn),獲得不同質(zhì)量濃度肌球蛋白低溫自組裝動(dòng)力學(xué)方程,并對(duì)組裝體的流變學(xué)性能進(jìn)行分析,以期為拓寬魚(yú)蛋白的應(yīng)用領(lǐng)域、提高魚(yú)蛋白的膠凝特性提供理論依據(jù)。
1 材料與方法
1.1 材料與試劑
鰱(Hypophthalmichthyx molitrix),個(gè)體質(zhì)量約為1.5 kg,購(gòu)自華中農(nóng)大菜市場(chǎng),將活鰱魚(yú)迅速運(yùn)回實(shí)驗(yàn)室,宰殺取背脊部肉,暫時(shí)不用的置于4 ℃冰箱里保存,所用實(shí)驗(yàn)原料均是當(dāng)天的新鮮魚(yú)肉。
牛血清白蛋白(分析純) 武漢科瑞生物技術(shù)有限公司;羅丹明B染料(分析純) 美國(guó)Sigma-Aldrich公司;β-巰基乙醇(β-mercaptoethanol,β-ME)(純度≥99.0%)、疊氮鈉(NaN3)(高級(jí)純) 美國(guó)Amresco公司;其他均為分析純,購(gòu)自國(guó)藥集團(tuán)化學(xué)試劑有限公司。
1.2 儀器與設(shè)備
1750型紫外-可見(jiàn)分光光度計(jì) 日本島津公司;722 N型可見(jiàn)分光光度計(jì) 上海儀電分析儀器有限公司;ZEN 3600激光粒度儀 英國(guó)馬爾文儀器有限公司;AR 2000 ex流變儀 英國(guó)TA公司;LSM 510 META CLSM德國(guó)Zeiss公司。
1.3 方法
1.3.1 肌球蛋白的提取
參考Cao Liwei等[20]的方法提取肌球蛋白,尸僵前的鰱魚(yú)背脊肉用食品調(diào)理機(jī)絞碎,向絞碎后的魚(yú)肉中加入10 倍體積含0.1 mol/L KCl、0.2 mg/mL NaN3和20 mmol/L Tris-HCl的緩沖液(pH 7.5),并用高速分散均質(zhì)機(jī)于9 000 r/min下均質(zhì)1~2 min。均質(zhì)液于4 ℃下放置15 min,8 000 r/min離心5 min后去除上清液,將沉淀于5 倍體積0.45 mol/L KCl-20 mmol/L Tris-HCl 緩沖液(pH 6.8,含5 mmol/L β-ME、0.2 mol/L Mg2CO3、1 mmol/L乙二醇雙(2-氨基乙基醚)四乙酸)中懸浮,同時(shí)加入ATP-Na2使肌球蛋白與肌動(dòng)蛋白解離,ATPNa2的終濃度控制為5 mmol/L。于4 ℃下放置60 min后10 000 r/min 離心10 min,上清液用6 倍體積1 mmol/L KHCO3稀釋,于4 ℃下放置60 min,然后12 000 r/min 離心10 min。沉淀重新用2.5 倍體積的20 mmol/L Tris-HCl緩沖液(pH 7.5,含0.5 mol/L KCl、5 mmol/L β-ME)懸浮,于4 ℃下放置15 min,再用2.5 倍體積的1 mmol/L KHCO3稀釋,并加MgCl2固體粉末至終濃度為10 mmol/L,于4 ℃下放置過(guò)夜,然后12 000 r/min離心15 min收集沉淀,得到純化的肌球蛋白。肌球蛋白質(zhì)量濃度測(cè)定參考Lowry法[21],用牛血清白蛋白作標(biāo)曲。純度采用十二烷基硫酸鈉-聚丙烯酰胺凝膠電泳(sodium dodecyl sulfate-polyacrylamide gel electropheresis,SDS-PAGE)來(lái)檢驗(yàn)。
1.3.2 樣品處理與制備
用0.5 mol/L NaCl-20 mmol/L Tris-HCl緩沖液(pH 7.0)將肌球蛋白的質(zhì)量濃度分別調(diào)整至0.1、0.3、0.5、1.0、5.0 mg/mL和8.0 mg/mL,分別于4 ℃下靜置2、12、24、36 h,取樣,測(cè)定相應(yīng)的理化指標(biāo),其中,5.0 mg/mL和8.0 mg/mL樣品僅用于靜態(tài)流變學(xué)測(cè)定和CLSM觀察。
1.3.3 紫外吸收光譜測(cè)定
以0.5 mol/L NaCl-20 mmol/L Tris-HCl緩沖液(pH 7.0)為參比空白,采用紫外-可見(jiàn)分光光度計(jì)在230~350 nm波長(zhǎng)范圍內(nèi)進(jìn)行中速掃描,采樣間隔1 nm。利用Origin 8.0軟件作圖。
1.3.4 濁度測(cè)定
濁度的測(cè)定參考Yongsawatdigul等[22]的方法,以溶液320 nm波長(zhǎng)處的吸光度(A320nm)來(lái)表示蛋白質(zhì)溶液的濁度。
1.3.5 動(dòng)態(tài)光散射表征粒徑大小
參考Zhan Fuchao等[23]的方法,采用激光粒度儀測(cè)定樣品的平均粒徑及粒徑分布。水溶劑黏度0.8873 mPa·s、介質(zhì)折射率1.33、物質(zhì)折射率1.45,相關(guān)測(cè)量時(shí)間函數(shù)通過(guò)自動(dòng)程序分析,平均粒徑由電腦自動(dòng)輸出。吸取2 mL樣液置于“聚苯乙烯”樣品池中,放入儀器中于25 ℃下進(jìn)行測(cè)試(散射角度173°)。每個(gè)樣品測(cè)試3 次,每次測(cè)試激光掃描15 圈。
采用一階模型[24](式(1))對(duì)組裝體的平均粒徑數(shù)據(jù)進(jìn)行擬合。

式中:Z表示t時(shí)刻的平均粒徑/nm;Z0表示初始平均粒徑/nm;k表示組裝速率/h-1;t表示組裝時(shí)間/h。
1.3.6 靜態(tài)流變學(xué)性能測(cè)定
采用動(dòng)態(tài)流變儀在flow模式下掃描,測(cè)試條件為:溫度4 ℃、錐板(2°)直徑40 mm、載物臺(tái)與平板間距54 μm。數(shù)據(jù)獲取模式為Continuous step,以剪切速率(γ)為變量,變量范圍為0.1~1000 s-1,得到剪切應(yīng)力(τ)隨剪切速率變化曲線,采用冪律定律(式(2))擬合τ-γ曲線。

式中:τ表示剪切應(yīng)力/Pa;K表示稠度系數(shù)/(Pa·sn);γ表示剪切速率/s-1;n表示流動(dòng)指數(shù)。
表觀黏度(ηa/(Pa·s))可由式(3)計(jì)算獲得。

采用Cross模型(式(4))擬合其零剪切黏度(η0)。

式中:η∞表示無(wú)窮剪切黏度/(Pa·s);η0表示零剪切黏度/(Pa·s);α表示Cross模型參數(shù)。
1.3.7 CLSM分析
采用CLSM觀察肌球蛋白組裝體(組裝12 h)的立體顯微結(jié)構(gòu)及在溶液中的分布狀況。使用羅丹明B對(duì)蛋白質(zhì)進(jìn)行標(biāo)記,磁力攪拌后得到均勻樣品,待測(cè)。標(biāo)記量為每50 mL樣液加入體積分?jǐn)?shù)0.2%羅丹明B 100 μL。取適量的樣品于顯微鏡長(zhǎng)蓋玻片上,使用10×目鏡和100×物鏡觀測(cè),選用熒光模式。采用He/Ne激光器作為激發(fā)光源,發(fā)射波長(zhǎng)確定為543 nm,使用光電倍增管進(jìn)行熒光檢測(cè)。掃描密度為1 024×1 024,掃描頻率為40 Hz。參數(shù)確定后進(jìn)行掃描,采集液滴圖像。儀器平均多次掃描信號(hào)的波動(dòng),以減少對(duì)激光共聚焦圖片的影響。實(shí)驗(yàn)在25 ℃空調(diào)房間內(nèi)避光測(cè)量。用儀器自帶的LSM Image Examiner軟件對(duì)圖像進(jìn)行分析和數(shù)據(jù)處理。
1.4 數(shù)據(jù)處理
所有數(shù)據(jù)均采用Origin 8.0軟件作圖,SAS 8.0統(tǒng)計(jì)軟件進(jìn)行分析,用ANOVA進(jìn)行方差分析,顯著性檢驗(yàn)方法為最小顯著性差異(least significant difference,LSD)法,P<0.05表示差異顯著。有關(guān)數(shù)據(jù)為3 次以上平均值。
2 結(jié)果與分析
2.1 鰱魚(yú)肌球蛋白純度鑒定
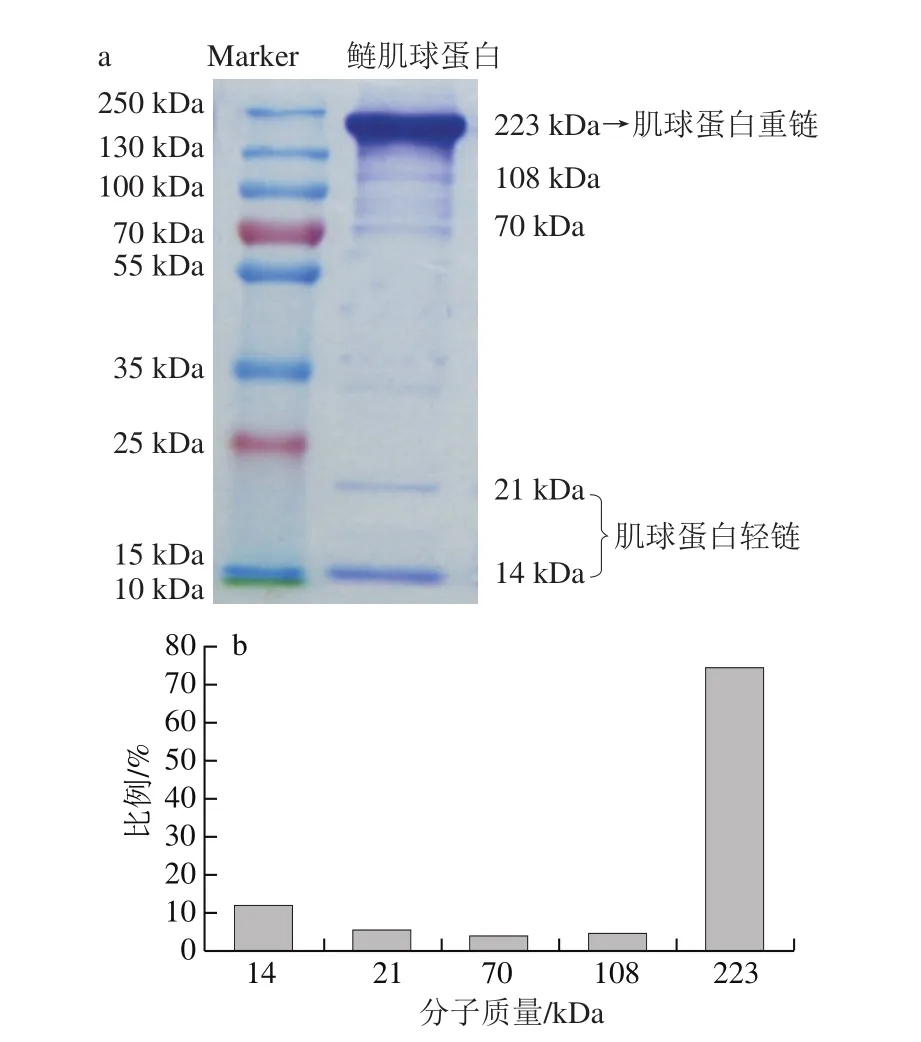
圖1 提取的肌球蛋白的SDS-PAGE譜圖(a)和各條帶所占比例(b)Fig.1 SDS-PAGE patterns of the extracted myosin (a) and the percentage of each band in SDS-PAGE pattern (b)
提取的鰱肌球蛋白的SDS-PAGE圖見(jiàn)圖1a,肌球蛋白重鏈的分子質(zhì)量為223 kDa,肌球蛋白輕鏈的分子質(zhì)量為21、14 kDa,這與之前學(xué)者報(bào)道的肌球蛋白分子由2 條分子質(zhì)量各為220 kDa的重鏈和4 條分子質(zhì)量在17~22 kDa范圍的輕鏈所組成[25]是基本一致的。圖1a中幾乎看不出肌動(dòng)蛋白的條帶(43 kDa),在70 kDa處有含量甚微的原肌球蛋白帶。肌球蛋白具有物種差異性,且不同魚(yú)種之間也有差別,尤其體現(xiàn)在輕鏈上。通過(guò)Gel-pro analyzer 4.0凝膠定量分析軟件計(jì)算得出各條帶的比例分布。由圖1b可知,肌球蛋白重鏈在整個(gè)泳道所有條帶中所占比例達(dá)75%,同時(shí)也計(jì)算得出肌球蛋白的純度達(dá)92%,說(shuō)明所得肌球蛋白的純度高,可作為本實(shí)驗(yàn)原料使用。
2.2 不同質(zhì)量濃度肌球蛋白低溫放置過(guò)程中的紫外吸收光譜
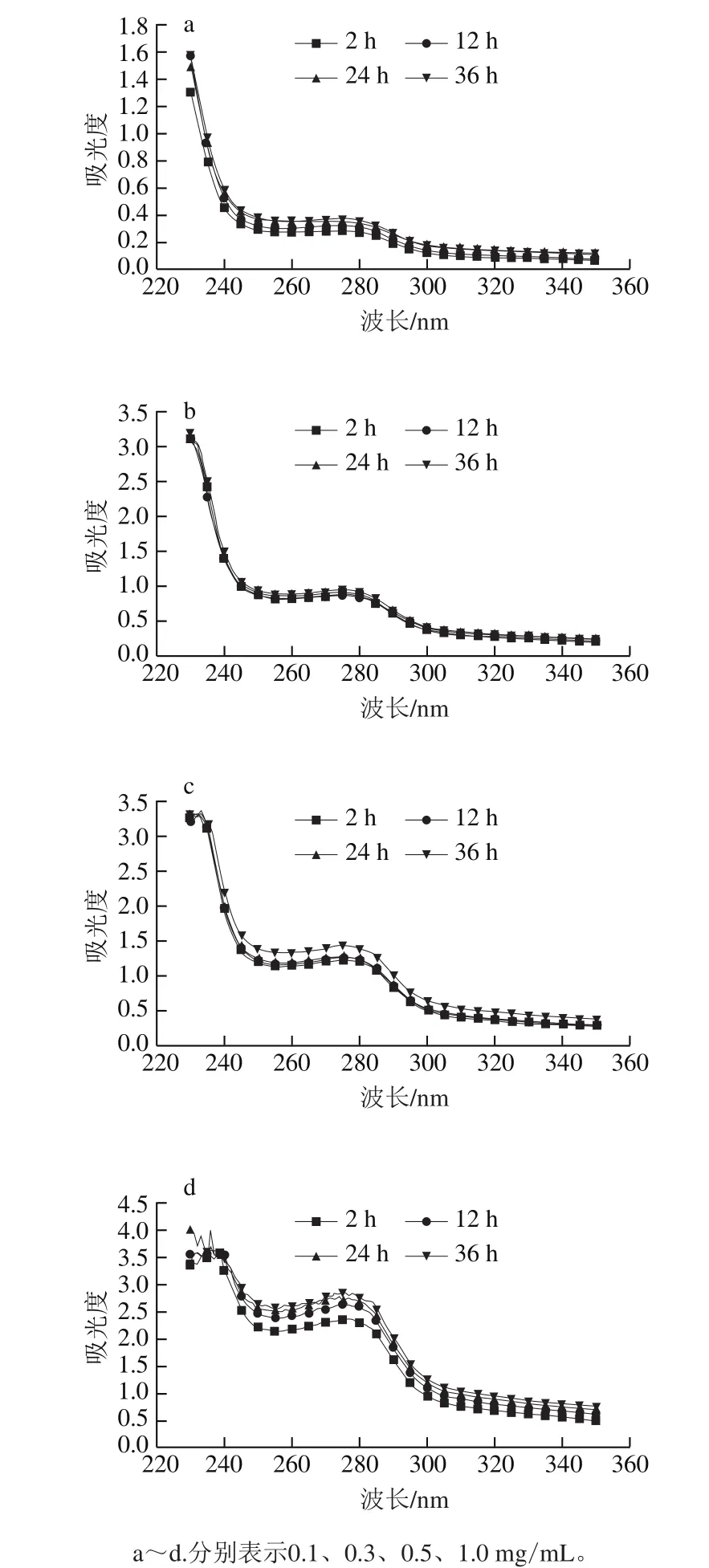
圖2 不同質(zhì)量濃度肌球蛋白溶液低溫放置過(guò)程中的紫外吸收光譜Fig.2 UV absorption spectra of myosin assembly suspension under the condition with different concentrations
紫外吸收光譜是一種研究蛋白構(gòu)象的有效手段[26]。由圖2可以看出,肌球蛋白溶液在276 nm波長(zhǎng)處有明顯的吸收峰,表明有色氨酸、酪氨酸等疏水性氨基酸殘基的存在[27],隨著放置時(shí)間的延長(zhǎng),該吸光度呈增大趨勢(shì),說(shuō)明肌球蛋白分子鏈逐漸伸展,暴露出更多的疏水性殘基。320~350 nm波長(zhǎng)范圍內(nèi)吸光度也隨放置時(shí)間的延長(zhǎng)而增大,結(jié)合276 nm處吸光度的變化,推測(cè)放置過(guò)程中肌球蛋白分子伸展暴露出更多的活性基團(tuán),有利于分子間相互作用,形成了大的組裝體,增加了光散射強(qiáng)度。Brenner等[15]曾報(bào)道了類似的現(xiàn)象,鱈魚(yú)肌球蛋白在低溫條件下也會(huì)自發(fā)組裝形成寡聚體。隨著蛋白質(zhì)量濃度的增加,吸光度呈增加趨勢(shì),且隨著放置時(shí)間的延長(zhǎng),質(zhì)量濃度高的肌球蛋白樣品吸光度增大的幅度更大。
2.3 不同質(zhì)量濃度肌球蛋白低溫放置過(guò)程中的濁度變化

圖3 不同質(zhì)量濃度下肌球蛋白低溫放置過(guò)程中的濁度變化Fig.3 Turbidity of myosin suspension at different concentrations
濁度可用于反映蛋白質(zhì)的組裝情況。由圖3可知,0.1、0.3 mg/mL的肌球蛋白樣品在放置的前24 h,其濁度隨放置時(shí)間的延長(zhǎng)顯著增大,24 h后濁度緩慢增大但無(wú)顯著變化。濁度增大可能是由于肌球蛋白自組裝形成了大的組裝體[2,28],有研究報(bào)道,低溫下肌球蛋白分子間主要依靠氫鍵、靜電相互作用等組裝形成微粗絲[6]。隨后肌球蛋白以微粗絲為“成核中心”,繼續(xù)組裝形成更大尺寸的粗絲,濁度進(jìn)一步增大,24 h以后肌球蛋白的自組裝基本達(dá)到了動(dòng)態(tài)平衡。0.5、1.0 mg/mL肌球蛋白樣品的濁度隨著放置時(shí)間(0~36 h)的延長(zhǎng)而顯著增大(P<0.05),說(shuō)明在放置時(shí)間(36 h)內(nèi)肌球蛋白自組裝持續(xù)進(jìn)行。肌球蛋白的自組裝行為是一個(gè)有序排列的過(guò)程,質(zhì)量濃度越大,混亂度也越大,達(dá)到有序結(jié)構(gòu)的時(shí)間也相對(duì)越長(zhǎng)。
2.4 不同質(zhì)量濃度肌球蛋白低溫放置過(guò)程中的粒徑變化
為進(jìn)一步了解肌球蛋白組裝體的尺寸大小和穩(wěn)定性,采用動(dòng)態(tài)光散射技術(shù)測(cè)定了肌球蛋白在組裝過(guò)程中的粒徑分布及平均粒徑,結(jié)果見(jiàn)圖4。由圖4a可知,隨著放置時(shí)間的延長(zhǎng)(2~36 h)和蛋白質(zhì)量濃度的增加(0.1~1.0 mg/mL),肌球蛋白組裝體的粒徑分布均向大粒徑方向移動(dòng),說(shuō)明自組裝在進(jìn)行,且肌球蛋白質(zhì)量濃度越大,形成的組裝體越大。由圖4b可知,0.1 mg/mL的肌球蛋白組裝體的平均粒徑在2~12 h之間隨放置時(shí)間延長(zhǎng)顯著增大(P<0.05),繼續(xù)延長(zhǎng)自組裝時(shí)間(12~36 h)對(duì)平均粒徑的影響不顯著(P>0.05),說(shuō)明低質(zhì)量濃度肌球蛋白自組裝能較快達(dá)到平衡。0.3 mg/mL的肌球蛋白組裝體的平均粒徑在2~12 h之間顯著增大(P<0.05),但在12~24 h間增長(zhǎng)不顯著(P>0.05),繼續(xù)延長(zhǎng)自組裝時(shí)間(24~36 h),平均粒徑又顯著增大。0.5、1.0 mg/mL的肌球蛋白組裝體的平均粒徑隨著自組裝時(shí)間(2~36 h)的延長(zhǎng)一直呈顯著上升趨勢(shì)(P<0.05),說(shuō)明提高蛋白質(zhì)量濃度后自組裝平衡所需的時(shí)間也隨之延長(zhǎng),各質(zhì)量濃度下肌球蛋白樣品的自組裝可劃分為成核、組裝、平衡3個(gè)階段。該結(jié)果與濁度結(jié)果基本一致。
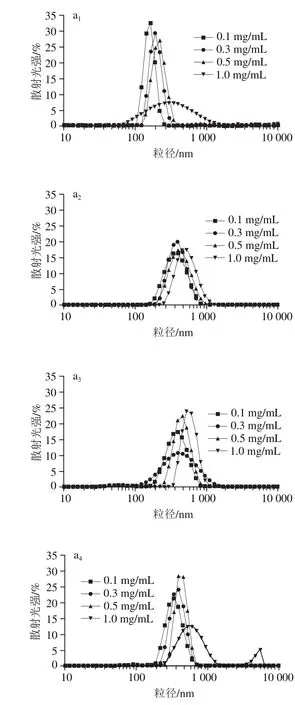
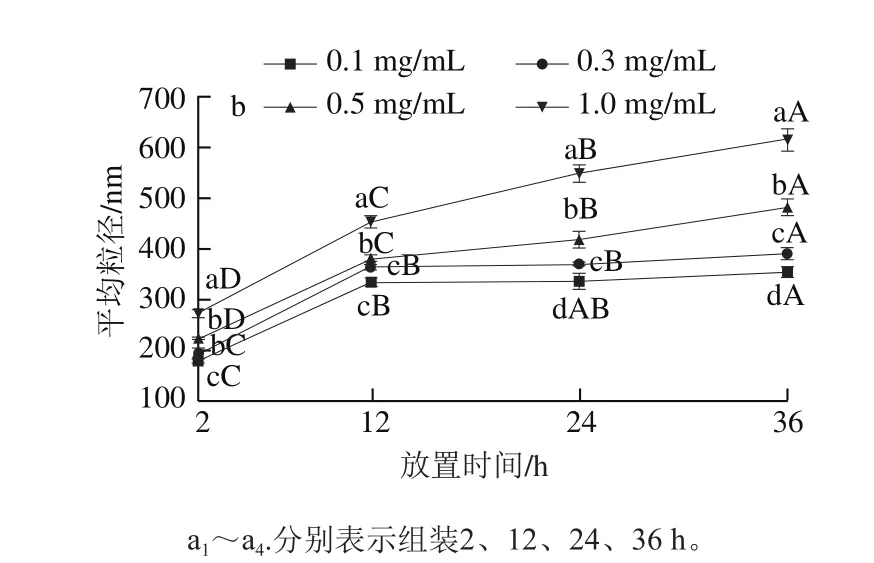
圖1 不同質(zhì)量濃度下肌球蛋白組裝體的粒徑分布(a)及平均粒徑(b)Fig.1 Particle sizes (a) and Z-average particle sizes (b) of myosin assemblies at different concentrations
為進(jìn)一步探究肌球蛋白組裝動(dòng)力學(xué),采用一階模型對(duì)其平均粒徑進(jìn)行擬合,方程P值均小于0.05,說(shuō)明該模型具有較高的擬合精度,所得動(dòng)力學(xué)參數(shù)見(jiàn)表1。隨著蛋白質(zhì)量濃度增大(0.1~1.0 mg/mL),肌球蛋白樣品的初始平均粒徑(Z0)呈上升趨勢(shì),即質(zhì)量濃度越高,初始組裝體越大。肌球蛋白質(zhì)量濃度較低(0.1~0.3 mg/mL)時(shí),組裝速率k值較接近,當(dāng)肌球蛋白質(zhì)量濃度由0.3 mg/mL增至1.0 mg/mL時(shí),組裝速率迅速增大,說(shuō)明肌球蛋白在低質(zhì)量濃度時(shí)組裝速率慢;當(dāng)質(zhì)量濃度提高至0.5 mg/mL以上時(shí),肌球蛋白之間相互接觸的幾率更大,暴露出的活性基團(tuán)更易發(fā)生相互作用,組裝速率加快,分子以微粗絲為成核中心,繼續(xù)組裝成為更大的組裝體。
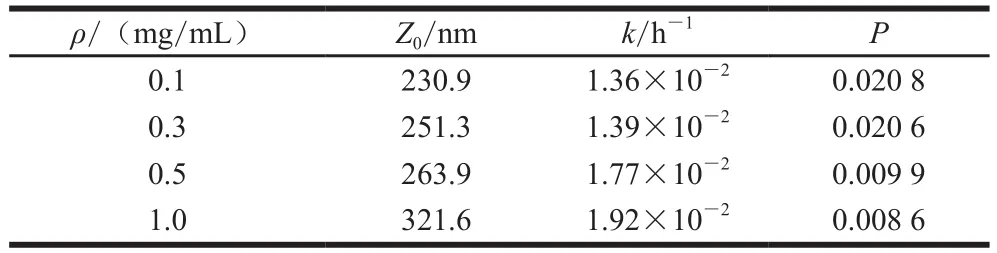
表1 低溫下肌球蛋白自組裝的動(dòng)力學(xué)參數(shù)Table1 Kinetic parameters for myosin self-assembly at low temperature
根據(jù)表1中得到的參數(shù),進(jìn)一步對(duì)組裝速率k與質(zhì)量濃度ρ進(jìn)行擬合,可用線性方程很好地描述兩者之間的關(guān)系。因此,將質(zhì)量濃度作為動(dòng)力學(xué)方程的自變量之一,重新擬合得到的方程為:(P<0.000 1),說(shuō)明該方程可以很好地描述不同質(zhì)量濃度肌球蛋白在低溫自組裝過(guò)程中粒徑隨時(shí)間的變化。且通過(guò)該方程可更直觀地看出,速率常數(shù)隨著蛋白質(zhì)量濃度的增加而增大,表明質(zhì)量濃度較高時(shí)組裝體粒徑增大的速度加快。
2.5 不同質(zhì)量濃度肌球蛋白在低溫放置過(guò)程中流變學(xué)特性
圖5為自組裝12 h肌球蛋白樣品的剪切應(yīng)力τ隨剪切速率γ的變化(其他放置時(shí)間下趨勢(shì)類似,故省略)。溶液的剪切應(yīng)力隨著剪切速率的增加而增大,在低剪切速率下,剪切應(yīng)力隨剪切速率的增長(zhǎng)呈近似直線增長(zhǎng)的趨勢(shì),表現(xiàn)出牛頓流體的性能,此階段流體的黏性表征為零剪切黏度(η0),不受剪切速率的影響。利用Cross模型擬合所得η0見(jiàn)表2,對(duì)于低質(zhì)量濃度(0.1~0.3 mg/mL)的肌球蛋白樣品而言,延長(zhǎng)放置時(shí)間,η0很小且沒(méi)有明顯變化,說(shuō)明低質(zhì)量濃度時(shí)肌球蛋白相對(duì)穩(wěn)定,分子間相互作用較弱,流動(dòng)性強(qiáng)。對(duì)于質(zhì)量濃度為0.5~8.0 mg/mL的肌球蛋白,隨著自組裝時(shí)間從2 h延長(zhǎng)至24 h,η0逐漸增大,表明肌球蛋白分子間相互作用增強(qiáng),形成了具有一定結(jié)構(gòu)的組裝體,流動(dòng)性下降。該實(shí)驗(yàn)結(jié)果表明肌球蛋白自組裝需要一定的質(zhì)量濃度(不低于0.5 mg/mL),達(dá)到該質(zhì)量濃度分子鏈間相互交聯(lián)和纏結(jié)形成組裝體。
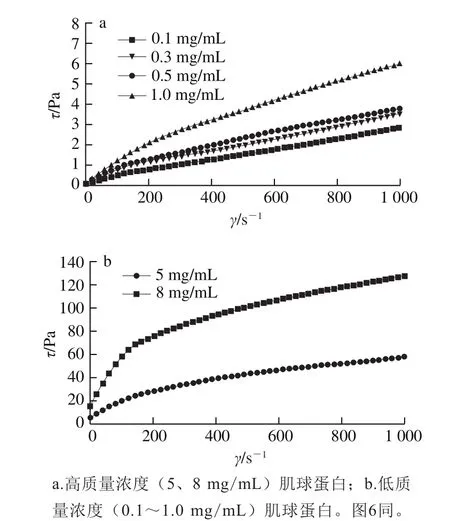
圖5 自組裝12 h下肌球蛋白溶液的τ-γ曲線Fig.5 τ-γ curves of silver carp myosin at the self-assembly time of12 h
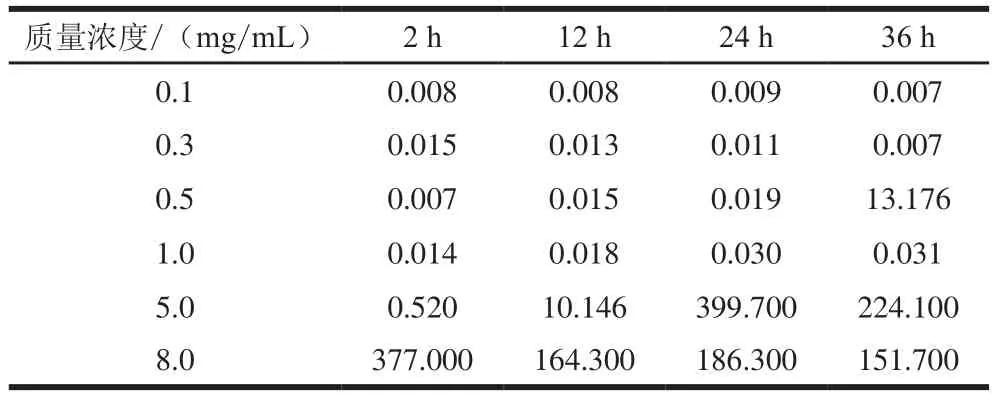
表2 不同自組裝時(shí)間下肌球蛋白溶液的η0Table2 Parameter η0of myosin suspension at different self-assembly time Pa·s
在22~220 s-1剪切速率范圍內(nèi),肌球蛋白組裝體部分解體,分子鏈段隨流動(dòng)方向拉伸、取向,剪切應(yīng)力與剪切速率不能維持正比關(guān)系,偏離直線變成向下彎曲的曲線(圖5),表現(xiàn)出剪切稀化行為,采用冪律定律進(jìn)行擬合,結(jié)果見(jiàn)表3。所得模型P值均小于0.01,說(shuō)明具有較高的擬合精度,所有肌球蛋白溶液的n值均小于1,表現(xiàn)為假塑性流體。隨著自組裝時(shí)間(2~36 h)的延長(zhǎng),質(zhì)量濃度為0.5~8.0 mg/mL的肌球蛋白所形成的組裝體的n值逐漸降低,K值逐漸增大;同樣,隨著蛋白質(zhì)量濃度增加,n值也下降,說(shuō)明溶液的假塑性增強(qiáng),推測(cè)這是由于肌球蛋白分子間發(fā)生了相互作用,導(dǎo)致所形成組裝體的尺寸逐漸增大而流動(dòng)性降低。這與本實(shí)驗(yàn)室前期研究魚(yú)肉與豬肉肌動(dòng)球蛋白靜態(tài)流變學(xué)性能的結(jié)果一致,肌動(dòng)球蛋白質(zhì)量濃度增大也會(huì)使其假塑性增強(qiáng),降低其流動(dòng)性[29]。
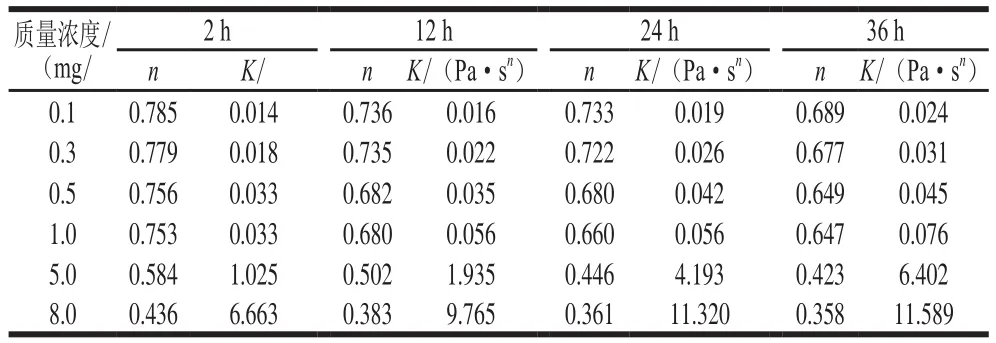
表3 不同自組裝時(shí)間下肌球蛋白溶液的稠度系數(shù)(K)和流動(dòng)指數(shù)(n)Table3 Consistency coef fi cients (K) and fl ow indices (n) for myosin suspension at different self-assembly time

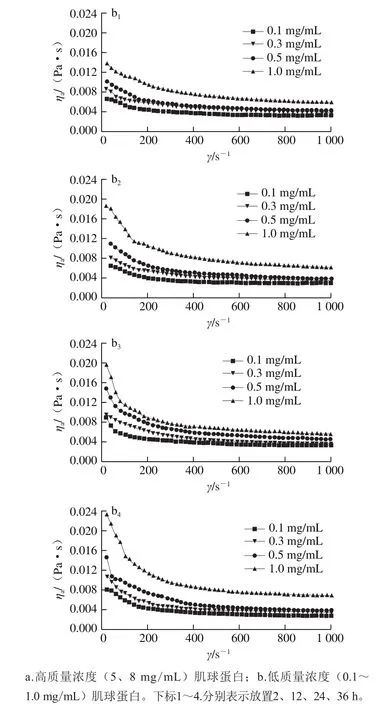
圖6 不同組裝時(shí)間下肌球蛋白表觀黏度(ηa)與剪切速率(γ)的關(guān)系Fig.6 Relationship between apparent viscosity (ηa) of myosin and shear rate (γ) at different self-assembly time
由圖6可知,所有樣品的ηa都隨著γ增大先迅速下降后緩慢下降至趨于穩(wěn)定,這種趨勢(shì)在較高質(zhì)量濃度(1.0~8.0 mg/mL)下更直觀,推測(cè)較高質(zhì)量濃度下形成的肌球蛋白組裝體具有相互纏繞和交聯(lián)的長(zhǎng)分子鏈結(jié)構(gòu),在靜止時(shí)將保持其內(nèi)部結(jié)構(gòu)的有序性,因而具有較高的內(nèi)部阻力阻礙流動(dòng),表現(xiàn)為較高的黏度;低剪切速率下,盡管有輕微的剪切取向效應(yīng),但分子的無(wú)規(guī)則布朗運(yùn)動(dòng)使所有的分子或分子組裝體都處于無(wú)序狀態(tài)。隨著γ的增大,肌球蛋白溶液將沿著剪切驅(qū)動(dòng)力的方向流動(dòng),部分組裝體解體,分子鏈逐漸解纏繞、拉伸和取向,排列后的分子或分子組裝體更容易相互滑移,溶液的ηa急劇下降[30]。當(dāng)γ增大到一定程度,ηa趨于穩(wěn)定,即表現(xiàn)出類似牛頓流體的性能。
2.6 不同質(zhì)量濃度肌球蛋白低溫放置過(guò)程中的微觀結(jié)構(gòu)
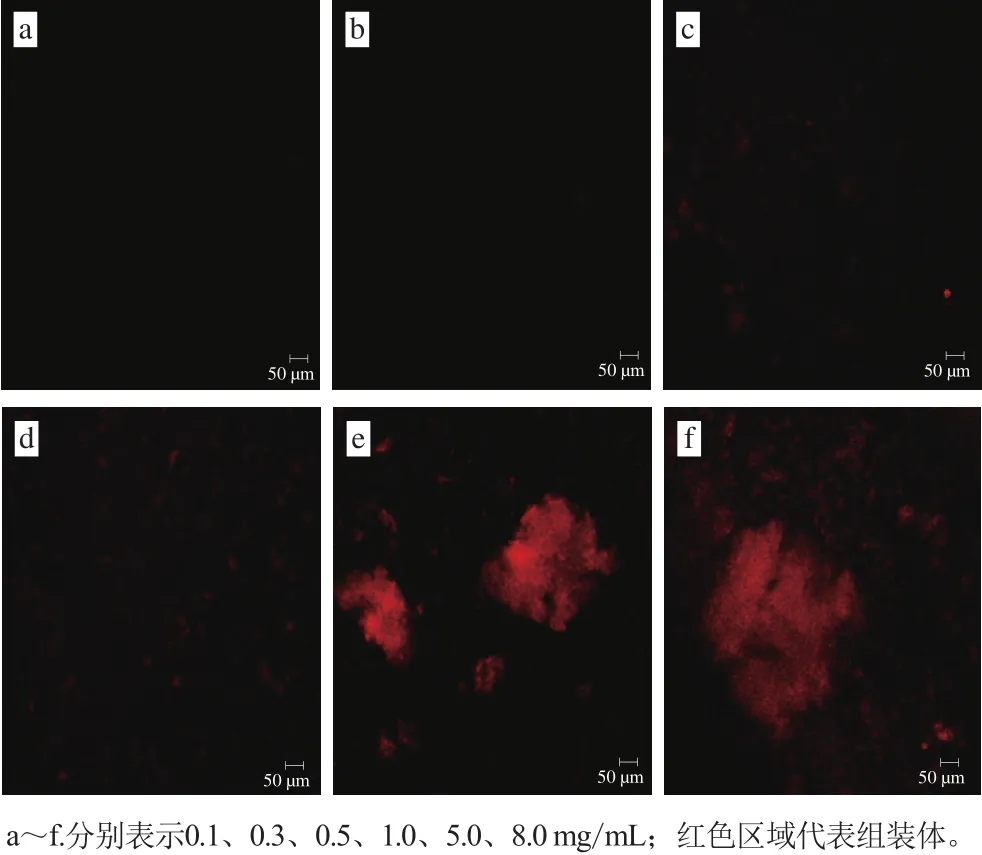
圖7 肌球蛋白組裝體的CLSM圖(×1 000)Fig.7 CLSM images of myosin assemblies ( × 1 000)
圖7 為低溫下肌球蛋白溶液組裝12 h后的CLSM圖。組裝體的尺寸隨蛋白質(zhì)量濃度增加而增大;當(dāng)質(zhì)量濃度為0.1、0.3 mg/mL時(shí),溶液中可以觀察到極少量肌球蛋白的存在;質(zhì)量濃度為0.5 mg/mL的肌球蛋白經(jīng)過(guò)自組裝后形成了均一分散在溶液中的小聚集體(粒徑<20 μm)。這是由于低質(zhì)量濃度下肌球蛋白分子間的距離較大,分子間自組裝行為不易進(jìn)行且組裝速率較低;隨著蛋白質(zhì)量濃度增大(大于等于0.5 mg/mL時(shí)),肌球蛋白自組裝速率提高,甚至組裝成肉眼可見(jiàn)的粗絲(5.0、8.0 mg/mL)。綜上分析可知,肌球蛋白低溫快速自組裝的臨界質(zhì)量濃度為0.5 mg/mL,這與膠原蛋白自組裝的臨界質(zhì)量濃度在0.30~0.45 mg/mL之間相近[31]。
3 結(jié) 論
低溫(4 ℃)放置過(guò)程中肌球蛋白的自組裝行為表現(xiàn)出較強(qiáng)的質(zhì)量濃度依賴性。隨自組裝時(shí)間的延長(zhǎng)和蛋白質(zhì)量濃度增大,分子間相互作用加強(qiáng),初步聚集成微絲并繼續(xù)以其為成核中心組裝成更大的組裝體,使得肌球蛋白溶液在230~350 nm波長(zhǎng)范圍內(nèi)的吸光度和濁度增大;動(dòng)態(tài)光散射所測(cè)組裝體粒徑的變化可由動(dòng)力學(xué)模型
較好地描述,當(dāng)質(zhì)量濃度提高到0.5 mg/mL時(shí),肌球蛋白溶液的組裝速率加快;隨著肌球蛋白質(zhì)量濃度進(jìn)一步增大,組裝平衡時(shí)間也延長(zhǎng)。進(jìn)一步用靜態(tài)流變學(xué)表征樣品的性能變化發(fā)現(xiàn),各質(zhì)量濃度肌球蛋白溶液都呈現(xiàn)出典型的剪切稀化行為,隨蛋白質(zhì)量濃度提高,肌球蛋白組裝體對(duì)溶液流動(dòng)的阻礙作用增強(qiáng),表觀黏度隨剪切速率增大而降低;CLSM觀察發(fā)現(xiàn),0.5 mg/mL時(shí)溶液所形成的組裝體尺寸較小且分布均勻,再提高質(zhì)量濃度便能形成肉眼可見(jiàn)的粗絲。綜上結(jié)果推測(cè)肌球蛋白快速自組裝的臨界質(zhì)量濃度是0.5 mg/mL。

