柑橘類黃酮的生物學活性及提高生物利用度技術(shù)研究進展
黃 睿,沈淑妤,陳虹霖,吳文艷,陳士國,葉興乾*
(浙江大學生物系統(tǒng)工程與食品科學學院,馥莉食品研究院,浙江省農(nóng)產(chǎn)品加工技術(shù)研究重點實驗室,浙江省食品加工技術(shù)與裝備工程實驗室,浙江 杭州 310058)
柑橘是世界第一大類水果,是僅次于玉米和小麥的第三大貿(mào)易農(nóng)產(chǎn)品。世界柑橘年均產(chǎn)量約8 000多萬t,而我國居世界首位,2015年達3 600萬 t[1],主要包括甜橙類、寬皮柑橘類、葡萄柚和柚類、檸檬類、雜柑類和金柑類等。作為世界范圍內(nèi)最受人喜愛的水果之一,除了良好的口感,柑橘還被證實具有顯著的營養(yǎng)和健康促進作用,這與其富含黃酮類物質(zhì)密不可分。柑橘皮渣中此類活性成分含量較高,可對柑橘加工副產(chǎn)物進行充分利用。類黃酮是柑橘中存在的主要次級代謝產(chǎn)物,它們有一個共同的基本骨架,包括兩個芳香環(huán)(A環(huán)和B環(huán))和一個吡喃環(huán)(C環(huán))[2]。目前已在柑橘中鑒定出超過60 種類黃酮單體,根據(jù)結(jié)構(gòu)可分為黃酮、黃烷酮、黃酮醇、黃烷醇和花青素(僅存在于血橙中)等五大類,其中黃烷酮含量最為豐富,存在形式包括糖苷配基和配糖體兩種:糖苷配基以橙皮素、柚皮素和圣草素為主,配糖體的糖基包括新橙皮糖基和蕓香糖基[3]。柑橘中最為常見的21 種類黃酮匯總于表1中。
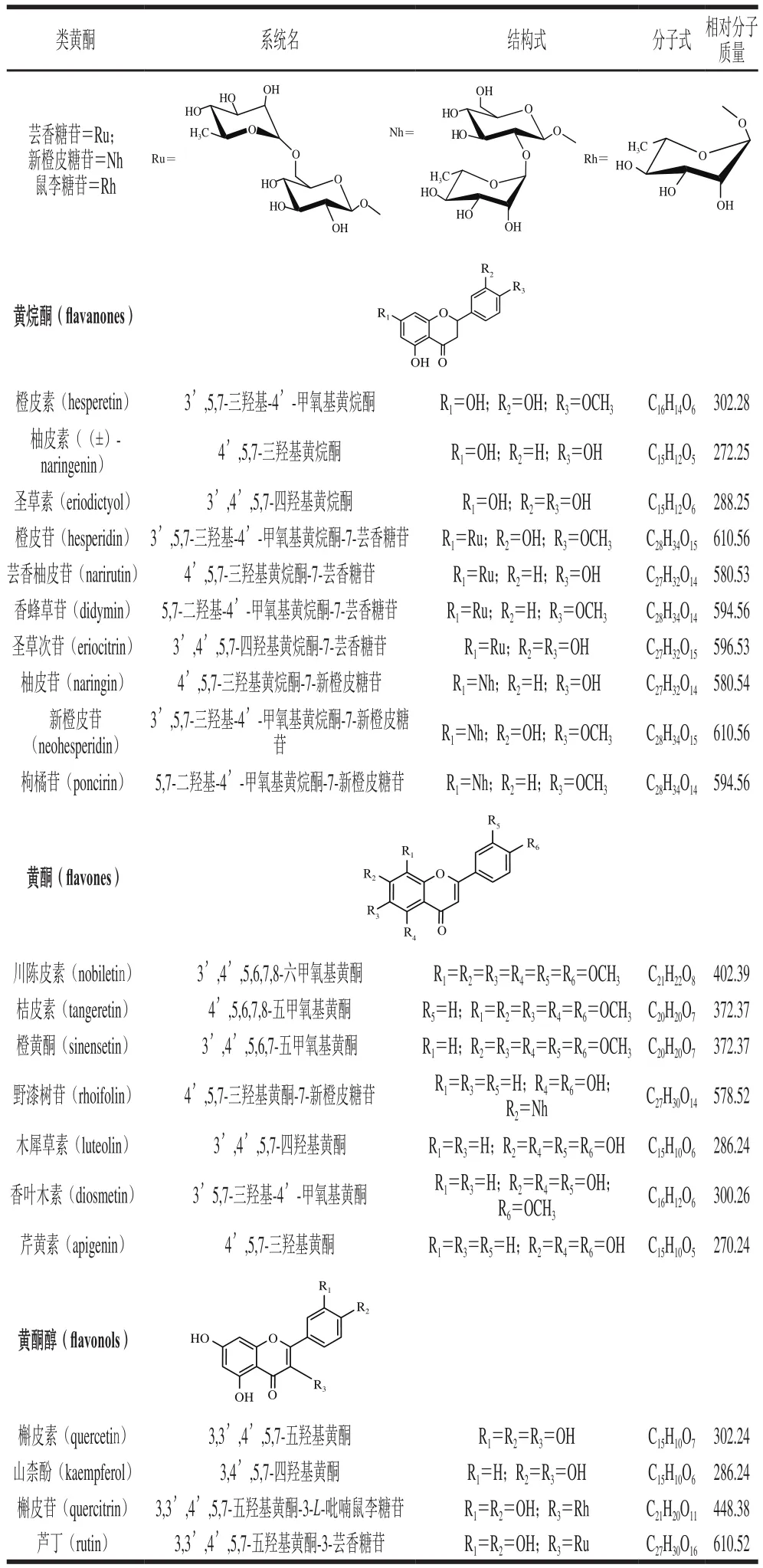
表1 柑橘中21 種常見類黃酮Table1 Chemical properties of twenty-one common fl avonoids in citrus
柑橘類黃酮生物學活性的研究近年來廣受關(guān)注,其生物活性主要包括:抗氧化活性[4-5]、抗炎活性[6-7]、調(diào)節(jié)脂質(zhì)代謝[8]、抗癌活性[9]和神經(jīng)保護活性[10]等,并且柑橘類黃酮天然存在、安全性較高,具有發(fā)展成為治療這些疾病的臨床藥物或輔助藥物的潛在價值,張曉丹等[11]對柑橘類黃酮生物學活性的效果表征進行了綜述,但關(guān)于作用機理方面討論較少,其作用機理研究不斷更新且較為零散,需加以系統(tǒng)總結(jié)。活性物質(zhì)的生物利用度主要取決于3 個因素:生物可及性、吸收率和生物轉(zhuǎn)化率。生物可及性受到活性物質(zhì)從食物基質(zhì)中釋放和在胃液中的溶解性的影響[12],而柑橘中的主要類黃酮如橙皮苷、橙皮素、柚皮素、多甲氧基黃酮等水溶性都非常差,極大地限制了其生物利用度,而當前國內(nèi)關(guān)于提高柑橘類黃酮生物利用度技術(shù)的研究和綜述非常有限,有必要進行系統(tǒng)總結(jié)。
本文立足于上述問題,就近年來關(guān)于柑橘類黃酮生物學活性的研究現(xiàn)狀和提高其生物利用度的技術(shù)方法進行綜述,在此基礎(chǔ)上,對柑橘類黃酮的研究與開發(fā)利用前景進行展望。
1 柑橘類黃酮的生物學活性
柑橘顯著的營養(yǎng)和健康促進作用與其富含類黃酮密不可分,大量體外和體內(nèi)研究表明,柑橘類黃酮具有多種藥理活性且安全性高,是開發(fā)保健品和藥物的優(yōu)良原料。
1.1 抗氧化活性
柑橘類黃酮發(fā)揮抗氧化作用主要通過3 個途徑:清除氧自由基、抑制脂質(zhì)過氧化和螯合金屬離子[6]。在生物體中,生理信號傳遞過程會產(chǎn)生少量活性氧;炎癥反應中,白細胞消滅病菌會產(chǎn)生大量活性氧;多不飽和脂肪酸自動氧化過程中會產(chǎn)生脂質(zhì)氧(RO·)和脂質(zhì)過氧(ROO·)自由基;紫外照射等外界刺激過程也都會使機體產(chǎn)生氧化應激,而長期暴露于氧化應激環(huán)境被認為是退行性疾病發(fā)展的開端。柑橘類黃酮通過清除活性氧簇(reactive oxygen species,ROS)可減輕機體受到的氧化損傷[2]。
類黃酮的抗氧化活性很大程度上與其結(jié)構(gòu)相關(guān),主要包括3 種結(jié)構(gòu)基團:1)B環(huán)上的3’,4’-鄰二酚羥基,可通過氫鍵參與電子易位和穩(wěn)定芳酰自由基;2)C環(huán)上的2,3位碳碳雙鍵,可以易位B環(huán)上的電子(如芹菜素有一定的抗氧化性,而柚皮素對超氧陰離子無清除作用);3)3,5位上的羥基基團[3,6]。
Park等[13]建立了乙醇誘導小鼠肝損傷模型,模型肝組織中的超氧化物歧化酶(superoxide dismutase,SOD)活性和還原型谷胱甘肽(glutathione,GSH)水平降低,表明肝細胞內(nèi)的抗氧化能力減弱,同時脂質(zhì)過氧化產(chǎn)物如丙二醛(malondialdehyde,MDA)水平升高,這些變化都是由慢性乙醇消耗引起。將蕓香柚皮苷與乙醇一同喂養(yǎng)小鼠,可使肝臟中SOD活力和GSH、MDA含量維持在與正常飲食組相當?shù)乃剑瑥亩謴蜋C體的氧化防御能力。Rapavi等[14]用含450 mg香葉木苷和50 mg橙皮苷的藥物喂養(yǎng)高脂膳食大鼠(60 mg/(kg·d))9 d作為實驗組,高脂膳食模型組相較于正常飲食組,肝臟中自由巰基濃度、供氫能力和自由基清除能力明顯降低,MDA和共軛二烯(二者同屬脂質(zhì)過氧化產(chǎn)物)含量顯著升高。實驗組中,這些參數(shù)(除共軛二烯)都有顯著性改善,表明香葉木苷和橙皮苷可保護和修復脂肪肝的氧化防御體系。
1.2 抗炎活性
炎癥是機體應對組織損傷、微生物病菌感染和化學性刺激的一種正常生理反應。在受傷位點,炎癥由血管中免疫細胞的遷移和介質(zhì)的釋放引發(fā),緊接著召集更多免疫細胞并釋放出ROS、活性氮(reactive nitrogen species,RNS)以及促炎因子來消滅外來病菌和修復受傷組織[15]。這些炎癥性化學物質(zhì)也會攻擊周邊正常組織,導致DNA氧化損傷、基因突變和細胞增殖,造成大面積組織炎癥。控制ROS、RNS和促炎因子的釋放,成為抗炎藥物發(fā)揮功效的關(guān)鍵。Liu Xin等[16]發(fā)現(xiàn),在脂多糖誘導的鼠源RAW 264.7巨噬細胞或BMDMs模型中,柚皮素可抑制腫瘤壞死因子-α(tumor necrosis factor-α,TNF-α)、白細胞介素-6(interleukin,IL-6)的釋放和mRNA的表達,呈量效關(guān)系,還能顯著減輕由脂多糖引起的Toll樣受體4(toll-like receptors 4,TLR4)、誘導型一氧化氮合酶(inducible NO synthase,iNOS)、環(huán)氧合酶-2(cyclo-oxygenase-2,COX-2)和NADPH氧化酶-2(NADPH oxidase-2,NOX2)等促炎因子表達水平的升高,主要通過抑制核因子κB(nuclear factorκB,NF-κB)和絲裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)等信號通路的激活發(fā)揮作用。Park等[13]證實蕓香柚皮苷可有效抑制由乙醇誘導的小鼠肝臟中NF-κB、TNF-α和IL-1β等促炎因子的增加,且呈量效關(guān)系。因此,柑橘類黃酮具有治療過度炎癥反應的潛力。
柑橘類黃酮的抗炎活性與其結(jié)構(gòu)緊密相關(guān),例如:在B環(huán)上有4’-OH或3’,4’-OH取代基的黃酮可作為選擇性脂氧合酶抑制劑,而含有5 個或更多甲氧基取代基的黃酮具有更高的磷酸二酯酶抑制活性[6,17]。多甲氧基黃酮,如川陳皮素可有效抑制脂多糖誘導人單核細胞產(chǎn)生TNF-α[18],也在由脂多糖誘導的BV2小神經(jīng)膠質(zhì)細胞中顯現(xiàn)出比其他黃烷酮糖苷和多甲氧基黃酮更強的抗炎功效[19]。Chen Xiumin等[6]發(fā)現(xiàn)在脂多糖和干擾素-γ誘導的RAW 264.7細胞中,川陳皮素和橘皮素含量較高的橙皮提取物可抑制促炎介質(zhì)iNOS和COX-2的蛋白和mRNA表達,并將此作用效果歸因于大量存在的甲氧基團。由于川陳皮素和橘皮素等多甲氧基黃酮中的多數(shù)羥基被甲氧基取代而抗氧化活性較弱,故研究認為其抗炎活性與抗氧化活性的相關(guān)性并不大[18]。
1.3 調(diào)節(jié)脂質(zhì)代謝活性
常用的降脂藥物主要包括以抑制膽固醇合成為主的他汀類和促進脂肪酸氧化、抑制甘油三酯合成的貝特類等,但這些藥物在發(fā)揮功效的同時,還伴隨有肌肉損傷、肝功能破壞等副作用[20]。柑橘類黃酮作為一類天然的活性物質(zhì),具有較高安全性,且諸多實驗結(jié)果表明,其能有效緩解由高脂膳食誘導的代謝紊亂,可改善血脂水平和肝臟脂肪變性程度,主要通過對核受體活性調(diào)控、極低密度脂蛋白(very low-density lipoprotein,VLDL)形成和分泌的調(diào)節(jié)以及對AMPK信號通路調(diào)控這3 個途徑發(fā)揮功效。
與脂質(zhì)代謝相關(guān)的核受體主要有3 類:過氧化物酶體增殖物激活受體類(peroxisome proliferator activated receptors,PPARs)、肝X受體(liver X receptor,LXR)和類法尼醇X受體(farnesoid X receptor,F(xiàn)XR)[21]。PPARα可引起脂肪酸β-氧化程度增加,LXRα能誘導脂肪酸合成和膽固醇轉(zhuǎn)運[22],F(xiàn)XR通過抑制膽汁酸合成、促進膽汁酸分泌的同時抑制肝臟對膽汁酸的吸收來促進膽固醇代謝[23]。Goldwasser等[24]證實,柚皮素是PPARα和PPARγ的雙重激動劑、LXRα的部分激動抑制劑,它能直接阻止LXRα配體結(jié)合區(qū)與Trap220輔激活物的結(jié)合,同時誘導PPAR主要配體PGC1α的表達量增加。這些效果通過激活與PPARα相關(guān)的下游基因的表達(包括CYP4A11、CPT-1和ACOX1等脂肪酸氧化基因)促進脂肪酸β-氧化,通過抑制受LXRα調(diào)控的脂質(zhì)生成基因(如FAS)抑制脂質(zhì)生成。柚皮素能同時作為PPARα和PPARγ的激動劑,表明它同時具有抑制脂質(zhì)生成和胰島素增敏屬性(臨床證明PPARα激動劑貝特類和PPARγ激動劑噻唑烷二酮類分別具有這些藥效[25]),并且作為膳食補充劑具有清晰的安全記錄,可為糖脂代謝異常提供有價值的新型治療和干預方案。Cho等[26]以雄性大鼠為模型,在膳食中添加不同劑量柚皮素喂養(yǎng)6 周,發(fā)現(xiàn)其能顯著降低大鼠血漿和肝臟中的甘油三酯(triglyceride,TG)和膽固醇含量,顯著增加肝臟中PPARα蛋白的表達。此外,受PPARα調(diào)控的肉毒堿棕櫚酰轉(zhuǎn)移酶-1(carnitine palmitoyl transterase-1,CPT-1)和解偶聯(lián)蛋白-2(unconjugated protein-2,UCP-2)蛋白的表達在柚皮素作用下也有顯著提升。由此,可認為柚皮素激活PPARα轉(zhuǎn)錄因子和上調(diào)脂肪酸氧化目標基因是其在生物體中發(fā)揮降脂作用的途徑之一。
VLDL的形成和分泌主要發(fā)生于肝臟中。TG在微粒體三酰甘油轉(zhuǎn)移蛋白(microsomal triglyceride transfer protein,MTP)的作用下運輸至內(nèi)質(zhì)網(wǎng)中并與載脂蛋白B(apolipoprotein B,Apo B)結(jié)合,膽固醇通過酰化輔酶A膽固醇酰基轉(zhuǎn)移酶(acylated coenzyme A cholesterol acyltransferase,ACAT)酯化為膽固醇酯并轉(zhuǎn)移至Apo B上,由Apo B、TG和膽固醇酯結(jié)合后形成VLDL前體粒子,通過外被體蛋白Ⅱ(coatmer protein,COPⅡ)輸出內(nèi)質(zhì)網(wǎng)并轉(zhuǎn)移至高爾基體中,與以脂滴形式存在的大量TG結(jié)合形成成熟的VLDL顆粒,并通過胞吐作用運輸?shù)郊毎鈁27]。因此,與甘油三酯和膽固醇酯的轉(zhuǎn)移緊密相關(guān)的MTP和ACAT,是減少VLDL形成的兩個重要靶標蛋白。另外,通過PI3K基因介導的LDL-受體表達與Apo B的含量也緊密相關(guān),因為血漿中Apo B的濃度除了與脂質(zhì)輸出相關(guān)外,還與LDL通過LDL-受體從血漿轉(zhuǎn)運到肝細胞中分解相關(guān)[28]。Borradaile[29]和Bawazeer[30]等發(fā)現(xiàn),柚皮素和橙皮素在HepG2細胞中能通過提高PI3K磷酸化水平來增加LDL受體mRNA的表達,從而促進LDL的分解,減少其在血漿中的濃度。根據(jù)Borradaile等[31]的發(fā)現(xiàn),柚皮素和橙皮素在HepG2細胞中可減少Apo B的積累,并呈量效關(guān)系,這與減少膽固醇酯的合成相關(guān),同時在喂養(yǎng)橙皮苷和柚皮苷的模型小鼠肝臟中觀察到羥甲基戊二酸單酰輔酶A還原酶(3-hydroxy-3-methylglutary CoA reductase,HMG-CoA)和ACAT活力的降低。Wilcox等[32]還在HepG2細胞研究體系中探究了柑橘類黃酮對ACAT1、ACAT2、HMG-CoA還原酶、MTP和LDL-受體的活性和表達水平的影響,發(fā)現(xiàn)橙皮素和柚皮素主要通過兩種機制抑制ApoB的分泌:1)降低ACAT1和ACAT2的活力,并選擇性減少ACAT2的表達;2)降低MTP活性,同時提高LDL-受體的活性。
AMPK即AMP依賴的蛋白激酶,包括3 個亞基:α-催化亞基、β-和γ-調(diào)節(jié)亞基。α-亞基的磷酸化能夠激活AMPK,AMPK磷酸化激活后可通過磷酸化乙酰輔酶A羧化酶(acetyl CoA carboxylase,ACC)、抑制核轉(zhuǎn)錄因子固醇調(diào)控元件結(jié)合蛋白(sterol regulatory element binding protein,SREBP)而降低脂肪酸合成酶(fatty acid synthase,F(xiàn)AS)的活性,減少脂肪酸的合成;通過激活CPT-1來增強線粒體對脂肪酸的利用和氧化,從而促進分解代謝反應[33]。同時,AMPK的磷酸化激活可靶向HMG-CoA還原酶來抑制膽固醇合成(AMPK是HMG-CoA還原酶的上游調(diào)節(jié)器)[34-35]。Shin等[35]利用椪柑皮醇提物處理油酸誘導的HepG2細胞,發(fā)現(xiàn)其能抑制肝細胞中的脂質(zhì)聚集,激活AMPK及其下游目標蛋白ACC的磷酸化,并通過測定與脂質(zhì)代謝相關(guān)蛋白的表達情況總結(jié)出4 條通過激活AMPK調(diào)節(jié)脂質(zhì)代謝的途徑:1)激活下游蛋白CPT-1的表達來促進脂肪酸氧化;2)抑制ACC的表達和活性來減少脂質(zhì)生成;3)抑制HMG-CoA還原酶來減少膽固醇合成;4)通過抑制SREBP-1c來降低FAS的表達從而減少脂肪生成。Pu Peng等[36]建立了高脂膳食小鼠模型,柚皮苷喂養(yǎng)20 周后,發(fā)現(xiàn)柚皮苷能抑制脂肪酸的生物合成和增加脂肪酸氧化,并上調(diào)AMPK及其信號通路,這也是其有效防止代謝綜合征發(fā)展的主要作用機制。
1.4 抗癌活性
研究證實,柑橘類黃酮是一類可降低患癌風險的天然活性物質(zhì),其發(fā)揮抗癌活性的機制主要包括:減少并修復DNA氧化損傷、抑制腫瘤細胞增殖和轉(zhuǎn)移、誘導腫瘤細胞凋亡和阻滯細胞周期、抑制血管生成、參與凋亡蛋白(Caspase)依賴途徑和線粒體通路等[37]。Li Jinjiang等[38]發(fā)現(xiàn),用柚皮苷處理腦膠質(zhì)瘤細胞U87 MG,可通過抑制黏著斑激酶(focal adhesion kinase,F(xiàn)AK)周期蛋白D1通路來抑制細胞增殖,通過影響FAK/bads通路來促進細胞凋亡,通過抑制FAK/mmps通路來阻止腫瘤細胞侵襲和轉(zhuǎn)移;因此,抑制黏著斑激酶活性是柚皮苷發(fā)揮抗腦膠質(zhì)瘤功效的一條有效途徑。Nagappan等[39]從瓶橘(Citrus platymamma)中分離出類黃酮混合物并用其處理人肺癌細胞A549,發(fā)現(xiàn)其能抑制A549細胞的增殖且呈量效關(guān)系,還可顯著增加sub-G1期、G2/M期和凋亡的細胞數(shù)量,使部分細胞核凝結(jié)和碎片化,并能下調(diào)一系列與癌細胞增殖相關(guān)的周期蛋白的表達。因此,瓶橘類黃酮通過阻滯A549細胞G2/M期抑制細胞增殖和激活凋亡蛋白Caspase-3促使細胞凋亡來發(fā)揮抗肺癌功效。生長抑制與DNA損傷誘導蛋白α(growth arrest and DNA-damage-inducible protein α,GADD45α)作為DNA損傷的標志性蛋白,可通過JNK和p38途徑誘導腫瘤細胞凋亡,Lee等[40]認為川陳皮素、橘皮素等多甲氧基黃酮能以獨立于p53途徑(報道稱該途徑可上調(diào)GADD45α以應對DNA損傷)之外的方式上調(diào)GADD45α轉(zhuǎn)錄和表達水平來發(fā)揮抗增殖作用。血管生成是腫瘤增殖和擴散的基礎(chǔ),基質(zhì)金屬蛋白酶(matrix metalloproteinases,MMPs)和血管內(nèi)皮生長因子(vascular endothelial growth factor,VEGF)與新血管生成緊密相關(guān),靶向這兩種蛋白的治療方案將有希望控制癌癥進一步發(fā)展[9],Lien等[41]研究表明,川陳皮素可在神經(jīng)膠質(zhì)瘤細胞中通過抑制胞外信號調(diào)節(jié)激酶(extracellular signal-regulated kinase,ERK)和蛋白激酶B(protein kinase B,Akt)的激活及下調(diào)MMP-2和MMP-9的表達發(fā)揮抗腫瘤轉(zhuǎn)移活性,另有研究表明,川陳皮素在前列腺癌細胞PC-3中通過下調(diào)AKT/HIF-1α信號通路減少VEGF和NF-κB的蛋白表達,可有效抑制細胞活性,降低患癌風險[42]。
1.5 神經(jīng)保護活性
研究證實,川陳皮素和橘皮素等多甲氧基黃酮可通過改善腦內(nèi)類膽堿不足、β淀粉樣蛋白非正常聚集、天冬氨酸受體功能衰退和缺血性損傷,阻止tau蛋白的過度磷酸化,提高腦啡肽酶水平等方式防治阿爾茨海默病、帕金森綜合征等神經(jīng)退行性疾病[43]。在中樞神經(jīng)系統(tǒng)中,小膠質(zhì)細胞的激活會釋放促炎因子,造成神經(jīng)炎和神經(jīng)細胞的死亡。Wu等[44]用柚皮素處理小鼠小膠質(zhì)細胞BV-2和N2a,發(fā)現(xiàn)其能通過AMPKα和PKCδ信號通路抑制NO和促炎因子的釋放,減弱iNOS、COX-2等與炎癥發(fā)生相關(guān)蛋白的表達,同時誘導細胞因子信號抑制基因(suppressor of cytokine signaling,SOCS)-3的表達,以此抑制神經(jīng)炎癥反應,保護中樞神經(jīng)系統(tǒng)。Mohd等[45]利用大腦中動脈閉塞(middle cerebral artery occlusion,MCAO)大鼠模型發(fā)現(xiàn),在誘發(fā)MCAO之前口服橙皮苷(50 mg/kg mb)預處理15 d,可顯著改善中風后腦梗塞和神經(jīng)損傷程度,并證明橙皮苷的神經(jīng)保護作用與其清除自由基和減少炎癥反應的活性相關(guān)。另有諸多報道稱,柑橘類黃酮是通過抗氧化活性以外的作用保護神經(jīng)細胞免受氧化應激[46],如Vauzour等[47]認為,橙皮素能有效抑制氧化應激誘導的神經(jīng)細胞凋亡并非因其抗氧化性,而是通過對神經(jīng)細胞凋亡機制的調(diào)節(jié)發(fā)揮神經(jīng)保護作用,主要包括激活/Akt和胞外信號調(diào)節(jié)激酶1/2這兩條信號通路抑制細胞凋亡相關(guān)蛋白的活化。綜上所述,柑橘類黃酮的神經(jīng)保護作用與其抗氧化、抗炎和能觸發(fā)多條細胞內(nèi)促生存的信號通路緊密相關(guān)。
2 提高柑橘類黃酮生物利用度的技術(shù)方法
無論是食品還是藥品,口服是最容易、方便也是采用最多的一種攝入方式。通常,限制活性成分口服生物利用度的因素可分為三大類:生物可及性、吸收率和代謝轉(zhuǎn)化率。生物可及性取決于活性成分從食品基質(zhì)中的釋放和在胃液中的溶解情況,吸收率是指穿過黏液層進入上皮細胞經(jīng)轉(zhuǎn)化后流出的活性成分的比例,代謝轉(zhuǎn)化則是活性成分穿過胃腸道上皮細胞進入血液并分散到各個組織器官后發(fā)生的一系列結(jié)構(gòu)變化[12]。多數(shù)柑橘類黃酮在體外實驗中表現(xiàn)出非常好的生物活性,但因其較差的溶解性和吸收性,直接影響這些活性成分在生物體中的生物利用度,無法發(fā)揮應有功效,故而需采用一定的技術(shù)手段提高其生物利用度。
2.1 環(huán)糊精包埋法
環(huán)糊精(cyclodextrin,CD)是一類具有三維中空環(huán)狀結(jié)構(gòu)的低聚糖,可將物質(zhì)疏水性部分包裹在非極性的空腔中,親水性部分暴露在外端與環(huán)糊精的羥基一同增加整體的水溶性,并且無毒害,對光、熱、堿穩(wěn)定,常被用作活性物質(zhì)的包埋材料[48]。因β-CD在水中的溶解度較低(室溫下僅為1.85%),且可能有溶血作用,故常使用其衍生物來替代,主要包括甲基-β-CD(M-β-CD)、二甲基-β-CD(DM-β-CD)、三甲基-β-CD(TM-β-CD)、磺丁醚-β-CD(SBE-β-CD)和羥丙基-β-CD(HP-β-CD)等。
Shulman等[49]使用HP-β-CD包埋柚皮素,使其溶解度從(36±1)μmol/L增加到(15.8±1.4)mmol/L,提高了437 倍;采用Caco-2單層細胞模型評價包埋前后柚皮素的穿透性,從基底層中檢測出柚皮素濃度由(0.04±0.02)μmol/L增加到(0.51±0.07)μmol/L,HP-β-CD使其細胞穿透率提高11 倍;通過建立大鼠模型,分別灌胃柚皮素和HP-β-CD包埋的柚皮素,取血液分析,發(fā)現(xiàn)包埋前后其藥物代謝速率增加7.4 倍,血液中柚皮素最大濃度增加14.6 倍,證明HP-β-CD能顯著提高柚皮素的生物利用度。Yang Lijuan等[50]利用β-CD及其衍生物DM-β-CD、TM-β-CD和HP-β-CD等包埋橙皮素,通過X射線衍射、差示掃描量熱法、掃描電子顯微鏡、1H和2D核磁共振以及紫外-可見光譜等技術(shù)手段,全方位評價了包合物的結(jié)構(gòu)特性、包埋方式以及溶解性、穩(wěn)定性等。結(jié)果顯示,這些包埋方式均能顯著提高橙皮素的水溶性和穩(wěn)定性。
2.2 酶處理法
柑橘類黃酮通常是以糖苷形式天然存在,主要包括新橙皮糖苷、蕓香糖苷和葡萄糖苷等類型。單糖形式的葡萄糖苷可在小腸中被β-葡萄糖苷酶水解;二糖形式存在的新橙皮糖苷和蕓香糖苷(如橙皮苷、柚皮苷等)需要到結(jié)腸中,在腸道微生物的作用下水解糖苷鍵,釋放相應苷元[51]。柑橘類黃酮只有以苷元或葡萄糖苷的形式存在時,才能在腸腔內(nèi)被機體吸收,而橙皮素、柚皮素等大多數(shù)苷元因水溶性較差導致生物利用度不高。因此,可利用糖苷酶將二糖苷水解為溶解度較高且能在小腸部位被水解或在葡萄糖轉(zhuǎn)運蛋白的作用下直接被吸收的葡萄糖苷,以提高其生物利用度。
Nielsen等[52]選擇16 名健康的志愿者,令其隨機食用控制橙皮素量的天然橙汁(低劑量)、經(jīng)橙皮苷酶處理(生成橙皮素-7-O-葡萄糖苷)的橙汁(酶處理組)以及經(jīng)強化比第一組橙皮苷劑量高3 倍的橙汁(高劑量組),結(jié)果顯示酶處理組的志愿者血液中橙皮素的藥時曲線面積比低劑量組高2 倍多,接近高劑量組水平;最大血漿濃度比低劑量組高4 倍多,比高劑量組高1.5 倍,且達到最大血漿濃度速率顯著快于另外兩組。這表明橙皮苷經(jīng)酶處理轉(zhuǎn)化為橙皮素-7-O-葡萄糖苷能顯著提高其生物利用度。Lee等[53]使用醬油曲霉(Aspergillus sojae)的柚皮苷酶重復不間斷地處理橙皮苷,主要獲得橙皮素-7-O-葡萄糖苷,其在水中的溶解度相較于橙皮苷和橙皮素分別提高36、77 倍,故而生物利用度更高。同時,橙皮素-7-O-葡萄糖苷在抑制腸道中的麥芽糖酶和膽固醇合成中的關(guān)鍵酶——HMG-CoA還原酶的功效相較于其苷元和蕓香糖苷均有顯著提升。因此,經(jīng)柚皮苷酶處理的橙皮苷具有更高的生物利用度和更強的生物活性。
2.3 脂質(zhì)體運載體系
脂質(zhì)體通常包括由磷脂構(gòu)成的單個或多重層狀球形結(jié)構(gòu)。根據(jù)磷脂分子的雙親性,在水溶液中其疏水尾部聚集在一起,親水頭部暴露在水相中,形成單層微膠束或具有雙分子層結(jié)構(gòu)的封閉囊泡,雙分子層中的疏水區(qū)域可用來裝載非極性物質(zhì)[12]。同時,脂質(zhì)體的磷脂雙分子層與生物膜的結(jié)構(gòu)相似,易被組織吸收且無毒性,故可用于提高營養(yǎng)物質(zhì)的生物可及性和吸收率。
Wolfram等[54]使用薄層蒸發(fā)技術(shù)制備脂質(zhì)體并用來裝載橙皮素,避免了有毒增溶試劑的使用,同時能使橙皮素在血漿中長時間保持穩(wěn)定、免遭降解,且有較好的藥物釋放特性。橙皮素-脂質(zhì)體復合物在H441肺癌細胞和MDA-MB-231乳腺癌細胞中顯示出的抗增殖活性均顯著高于單獨使用橙皮素或脂質(zhì)體,這可能由于脂質(zhì)體能更好地與細胞膜融合,使包合物更易被細胞吸收而發(fā)揮更強功效。Wang Yuanwen等[55]使用薄膜水化分散法制備脂質(zhì)體并裝載柚皮素,裝載率達72.2%。體外釋放實驗表明,柚皮素-脂質(zhì)體復合物相較于柚皮素在鹽酸溶液、醋酸鹽緩沖液和磷酸鹽緩沖液中的釋放率均有顯著提高;體內(nèi)動物實驗表明,依據(jù)藥時曲線面積,脂質(zhì)體運載體系能提高柚皮素的口服生物利用率約13.44 倍,且能顯著提高柚皮素在以肝臟為主的各類器官中的分布濃度。因此,脂質(zhì)體運載體系是改善柚皮素溶解性和提高其生物利用度的一種優(yōu)良方法。
2.4 乳液運載體系
乳液運載體系是由2 種及以上互不相溶的液體相互混合而成,主要包括水/油和油/水兩種類型,可用來保護活性成分以防其降解、提高溶解性以及促進其更好地被生物體吸收,從而提高營養(yǎng)物質(zhì)的口服生物利用度[56]。Ting Yuwen等[57]利用乳液運載體系制備橘皮素乳濁液,發(fā)現(xiàn)其在結(jié)腸癌細胞系HCT116和HT29中的抗增殖活性有顯著提升;通過構(gòu)建結(jié)腸炎相關(guān)結(jié)腸腫瘤生成小鼠模型,證明乳液運載體系能有效增強橘皮素在體內(nèi)的抗結(jié)腸癌發(fā)展和調(diào)節(jié)腫瘤相關(guān)蛋白表達的活性。體外和體內(nèi)實驗均證實乳液運載體系是提高橘皮素口服生物利用度的一種有效途徑。
3 結(jié) 語
本文詳述了柑橘類黃酮的主要生物學活性和提高其生物利用度的技術(shù)方法。柑橘類黃酮具有抗氧化、抗炎、調(diào)節(jié)脂質(zhì)代謝、抗癌和神經(jīng)保護等生物學活性,無論是體外細胞實驗還是體內(nèi)動物實驗都將單體類黃酮在分子層面對多個靶標蛋白的表達和信號通路的影響研究得較為充分,但將不同類黃酮活性的差異與其分子結(jié)構(gòu)的不同聯(lián)系起來的系統(tǒng)研究,以及將多種具有同種活性的類黃酮共同使用來探究其協(xié)同或拮抗效應的研究較少。柑橘類黃酮較低的生物利用度極大地限制了其在體內(nèi)發(fā)揮應有的生物學活性,但目前國內(nèi)對提高其生物利用率的技術(shù)方法研究得非常少,并且現(xiàn)存方法都存在包埋或裝載率較低的問題。未來除了從提高生物可及性、吸收率和生物轉(zhuǎn)化率這三個層面研究新型技術(shù)方法外,還需不斷優(yōu)化制備工藝以提高裝載率,并實現(xiàn)產(chǎn)業(yè)轉(zhuǎn)化。

