(-)-β-蒎烯對沙門氏菌的抑菌機(jī)制
何靜如,劉 雪,陳文學(xué)*,陳衛(wèi)軍,陳海明
(海南大學(xué)食品學(xué)院,海南 海口 570228)
近年來,食源性疾病在人們的日常生活中受到越來越多的關(guān)注[1]。致病性細(xì)菌存在于各種食品中,例如,沙門氏菌、金黃色葡萄球菌和大腸桿菌等存在于雞蛋、牛肉、雞肉、豬肉、蔬菜、水果甚至飲用水中,嚴(yán)重威脅人體的健康狀況[2-3]。為了抑制食品中的致病性細(xì)菌對人體的危害,食品防腐劑在食品工業(yè)中尤為重要,而常見的食品防腐劑多為一些可能對人體有副作用的化學(xué)物質(zhì);故尋找真正對人體安全、天然的抑菌物質(zhì)至關(guān)重要[3]。精油是從不同植物的不同部位分離出來的一種混合物[4],它是由多種化學(xué)成分組成,其中較為重要的成分有萜烯類化合物、萜類化合物、芳香族和脂環(huán)族化合物,例如α-蒎烯、(-)-β-蒎烯、檸檬烯、C16和C29類的烷烴等[5-7]。據(jù)相關(guān)文獻(xiàn)報道,精油不僅具有良好的抗氧化性、抗癌性以及抗過敏性,其對單核細(xì)胞增生李斯特菌、金黃色葡萄球菌、沙門氏菌都有很好的抑菌效果;且精油作為一種可預(yù)防食源性疾病的天然食品添加劑對人體健康幾乎沒有危害[3,8-9]。盡管已經(jīng)有很多關(guān)于精油成分以及精油抑菌活性和機(jī)制的研究,如Cui Haiying等[10-11]的研究發(fā)現(xiàn)精油可以破壞細(xì)胞膜的完整性,使胞內(nèi)物質(zhì)如DNA、腺苷三磷酸(adenosine triphosphate,ATP)溢出等。但關(guān)于精油中究竟是哪種成分起主要作用仍不是十分明晰,也鮮有報道[8],因此后續(xù)對精油的深入研究空間較廣。
Zou Lan等[12]研究了胡椒提取物對大腸桿菌和金黃色葡萄球菌的抑菌機(jī)制,結(jié)果表明胡椒提取物對細(xì)菌的細(xì)胞結(jié)構(gòu)、ATP含量和三羧酸(tricarboxylic acid,TCA)循環(huán)中有機(jī)酸含量等有影響。而(-)-β-蒎烯存在于各種植物精油中,它也是胡椒提取物中的一種重要成分,更重要的是,有研究表明其具有抑菌、抗抑郁、抗病毒等功效[13]。因此,深入研究(-)-β-蒎烯的抑菌機(jī)制,可為其作為一種天然食品防腐劑提供理論依據(jù)。
沙門氏菌屬于革蘭氏陰性菌,除雞白痢沙門氏菌和雞傷寒沙門氏菌外,大多數(shù)沙門氏菌可以依靠周身鞭毛運(yùn)動[14]。沙門氏菌感染可經(jīng)雞蛋、飲水、加工食品、環(huán)境等途徑傳播,不僅對家禽的生存造成威脅,而且被其感染的食品經(jīng)消化道進(jìn)入人體內(nèi),會對人體健康造成嚴(yán)重?fù)p害,已引起國際上越來越多的關(guān)注和重視[15-16]。因此,找到有效抑制沙門氏菌的天然食品添加劑對人類健康至關(guān)重要。
綜上所述,本研究主要探究(-)-β-蒎烯對沙門氏菌的抑菌機(jī)制,通過測定最小抑菌濃度(minimum inhibition concentration,MIC)確定其抑菌活性,再通過掃描電子顯微鏡觀察,并分析其對沙門氏菌的電導(dǎo)率、TCA循環(huán)中關(guān)鍵酶活力和ATP含量的變化趨勢研究其抑菌機(jī)理。本研究為預(yù)防食源性致病菌對人體的危害提供了新思路和理論依據(jù)。
1 材料與方法
1.1 菌株、材料與試劑
實驗菌種為沙門氏菌,由廣東微生物菌種保藏中心提供。
(-)-β-蒎烯 阿拉丁試劑(上海)有限公司;營養(yǎng)肉湯、瓊脂(均為生物試劑)、琥珀酸脫氫酶活力測定試劑盒、α-酮戊二酸脫氫酶活力測定試劑盒、ATP含量測定試劑盒 北京索萊寶科技有限公司;無水乙醇(分析純) 廣州化學(xué)試劑廠。
1.2 儀器與設(shè)備
TU1810紫外-可見分光光度計 北京普析通用儀器有限責(zé)任公司;ST16R高速冷凍離心機(jī) 美國Thermo公司;S-3000掃描式電子顯微鏡 日本日立公司;SPX-288生化培養(yǎng)箱 寧波江南儀器廠,SHA-2恒溫振蕩器 常州奧華儀器有限公司;JYD-650L超聲波細(xì)胞粉碎機(jī) 上海之信儀器有限公司;DDS-307電導(dǎo)率儀 上海雷磁有限公司;TDZ5-WS多管架離心機(jī)上海盧湘儀離心機(jī)儀器有限公司;ALPHA 1-2型冷凍干燥機(jī) 北京五洲東方科技發(fā)展有限公司。
1.3 方法
1.3.1 MIC測定
采用肉湯稀釋法進(jìn)行MIC的測定[17]。用無菌生理鹽水(NaCl質(zhì)量分?jǐn)?shù)0.9%)將培養(yǎng)24 h的沙門氏菌稀釋至106~107CFU/mL。在無菌平板中添加2 mL(-)-β-蒎烯溶液(體積分?jǐn)?shù)70%的乙醇溶液溶解),同時加入18 mL溫度為40~60 ℃的固體培養(yǎng)基并迅速往復(fù)搖動,使(-)-β-蒎烯含量別為40、20、10、5、2.5、1.25、0.625 mL/L。以添加相同體積的無菌生理鹽水和體積分?jǐn)?shù)70%乙醇溶液分別作為空白對照組和陰性對照組。取200 μL上述菌懸液在各平板上涂布均勻,于37 ℃恒溫培養(yǎng)箱中倒置培養(yǎng)24 h,以肉眼不見菌生長的(-)-β-蒎烯含量為MIC。
1.3.2 細(xì)胞形態(tài)的觀察
采用掃描電子顯微鏡觀察沙門氏菌細(xì)胞形態(tài)的變化[18-19]。向培養(yǎng)至對數(shù)期的目標(biāo)菌懸液中加入(-)-β-蒎烯,使其含量分別為2 MIC、1 MIC、1/2 MIC,以不加(-)-β-蒎烯的作為空白對照組,以加入體積分?jǐn)?shù)70%乙醇溶液的作為陰性對照組。將各組菌懸液置于37 ℃恒溫?fù)u床培養(yǎng),取培養(yǎng)至8、16 h的菌懸液各50 mL,6 000 r/min低溫離心10 min收集菌體。使用無菌磷酸鹽緩沖液(pH 7.2)清洗菌體3 次,再用體積分?jǐn)?shù)依次為20%、40%、60%、80%的乙醇溶液進(jìn)行梯度脫水,每個含量均洗脫2 次,最后用無水乙醇洗脫3 次。將脫水后的樣品在-20 ℃條件下預(yù)凍2 h后使用真空冷凍干燥機(jī)冷凍干燥12 h。取出完全干燥的樣品,上樣、鍍金、掃描電子顯微鏡觀察。
1.3.3 電導(dǎo)率測定
采用電導(dǎo)率儀進(jìn)行測定[20]。將2%沙門氏菌菌懸液(106~107CFU/ mL)接種于150 mL營養(yǎng)肉湯培養(yǎng)基中,搖床振蕩(130 r/min、37 ℃)培養(yǎng)至對數(shù)期,再向其中分別加入2 MIC、1 MIC和1/2 MIC的(-)-β-蒎烯溶液;以不加抑制物的為對照組,置于37 ℃搖床中繼續(xù)振蕩培養(yǎng),并分別于0、2、4、6、8、10、12、14 h取出5 mL,4 000 r/min離心15 min,取上清液測其電導(dǎo)率。平行測定3 次。
1.3.4 樣品制備
使用無菌生理鹽水溶液對斜面?zhèn)鹘又? 代的沙門氏菌進(jìn)行洗脫,采用麥?zhǔn)媳葷峁芊ㄅ渲茲舛葹?06~107CFU/mL的菌懸液。分別取體積分?jǐn)?shù)2%的菌懸液加入5 個裝有250 mL營養(yǎng)肉湯培養(yǎng)基的錐形瓶中,置于37 ℃、130 r/min條件下?lián)u床培養(yǎng)至對數(shù)期。再向其中添加(-)-β-蒎烯溶液,使其含量分別為2 MIC、1 MIC、1/2 MIC,以添加相應(yīng)量的體積分?jǐn)?shù)70%乙醇溶液作為陰性對照組,以不添加任何物質(zhì)的作為空白對照組,繼續(xù)搖床培養(yǎng)。培養(yǎng)過程中分別于0、3、6、9、12、24 h取10 mL菌液在4 ℃下11 000 r/min離心10 min,棄上清液,收集菌體,用無菌磷酸鹽緩沖液清洗3 次并重新懸于緩沖液中。在冰浴條件下,使用超聲細(xì)胞破碎儀對細(xì)菌懸浮液破碎6 min(550 W,間隔10 s),將破碎的懸浮液于4 ℃下11 000 r/min離心10 min,棄下層細(xì)胞殘渣,將上清液保存于4 ℃冰箱中以備測定琥珀酸脫氫酶(succinic acid dehydrogenase,SDH)、α-酮戊二酸脫氫酶(α-ketoglutarate dehydrogenase,α-KGDH)活力和ATP含量。
1.3.5 SDH活力測定
SDH活力采用試劑盒進(jìn)行測定[21]。向相應(yīng)編號的試管中加入100 μL樣品液,迅速加入2.6 mL工作液,立即混勻并計時,迅速倒入比色皿中,在可見分光光度計600 nm波長處比色,5 s時讀取吸光度A1,在1 min5 s時再次測定吸光度A2,求出2 次吸光度差值ΔA(A1-A2)。樣品蛋白質(zhì)量濃度測定采用考馬斯亮藍(lán)法。并采用公式(1)進(jìn)行SDH活力計算。
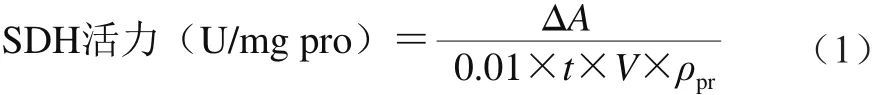
式中:t為反應(yīng)時間(1 m i n);V為取樣量(0.1 mL);ρpr為樣本蛋白質(zhì)量濃度/(mg/mL)。
1.3.6 α-KGDH活力測定
α-KGDH活力采用試劑盒進(jìn)行測定。取1.3.4節(jié)中的樣品液按照試劑盒說明書進(jìn)行操作,立即記錄340 nm波長處20 s時的吸光度A1和2 min 20 s時的吸光度A2,以上比色均采用蒸餾水調(diào)零;計算ΔA(A2-A1)。并采用公式(2)進(jìn)行α-KGDH活力計算。
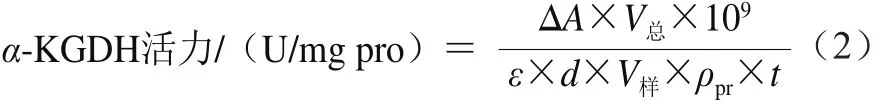
式中:V總為反應(yīng)體系總體積/L;ε為NADH摩爾消光系數(shù)(6.22×103L/(mol·cm));d為比色皿光徑/cm;V樣為樣本體積/mL;ρpr為樣本蛋白質(zhì)量濃度/(mg/mL);t為反應(yīng)時間/min。
1.3.7 ATP含量的測定
細(xì)菌培養(yǎng)過程中ATP含量采用ATP含量測定試劑盒進(jìn)行測定[22]。取1.3.4節(jié)中的樣品液按照試劑盒說明書進(jìn)行操作,最后在636 nm波長處,用光徑0.5 cm比色皿,以雙蒸水調(diào)零,測定各管吸光度。
1.4 數(shù)據(jù)處理
所有結(jié)果均使用DPS 6.5數(shù)據(jù)分析軟件進(jìn)行方差分析,結(jié)果以平均值±標(biāo)準(zhǔn)差表示。Origin 9.0軟件制圖。
2 結(jié)果與分析
2.1 (-)-β-蒎烯對沙門氏菌的MIC
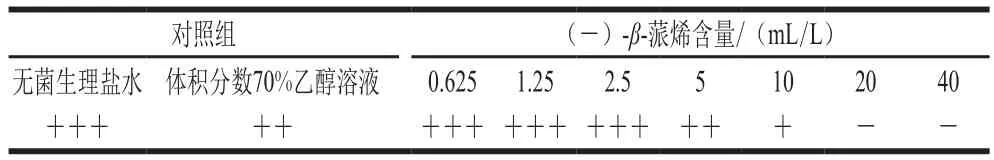
表1 沙門氏菌生長情況Table1 Growth status of Salmonella
從表1中可以看出,體積分?jǐn)?shù)70%的乙醇溶液對沙門氏菌的生長并無明顯影響,隨著(-)-β-蒎烯溶液含量的逐漸增大,其對沙門氏菌生長的抑制作用也隨之增大,當(dāng)抑菌物質(zhì)的含量達(dá)到20 mL/L時,沒有菌體生長,即(-)-β-蒎烯對沙門氏菌的MIC為20 mL/L。
2.2 (-)-β-蒎烯對沙門氏菌細(xì)胞形態(tài)的影響

圖1 (-)-β-蒎烯處理后沙門氏菌的細(xì)胞形態(tài)Fig.1 Effect of (-)-β-pinene on the morphology of Salmonella
如圖1所示,空白對照組的沙門氏菌細(xì)胞呈現(xiàn)正常的桿狀(圖1a),陰性對照組的沙門氏菌細(xì)胞形態(tài)受到微小破壞,大部分仍呈現(xiàn)正常的短桿狀(圖1b),而(-)-β-蒎烯處理組的沙門氏菌的細(xì)胞形態(tài)則受到嚴(yán)重破壞(圖1c~e)。(-)-β-蒎烯處理16 h后,細(xì)胞破裂、黏結(jié)在一起,界限模糊,細(xì)胞壁和細(xì)胞膜被破壞,細(xì)胞形態(tài)受到嚴(yán)重影響,且破壞程度依次為2 MIC>1 MIC>1/2 MIC(圖1c~e)。因此,實驗結(jié)果表明(-)-β-蒎烯可以破壞沙門氏菌的細(xì)胞壁和細(xì)胞膜,且含量越大,破壞作用越大。(-)-β-蒎烯造成沙門氏菌的細(xì)胞形態(tài)及結(jié)構(gòu)的破壞可能會導(dǎo)致胞外的大分子物質(zhì)可以進(jìn)入細(xì)胞內(nèi),細(xì)胞內(nèi)的一些物質(zhì)也會溢出細(xì)胞外,同時細(xì)胞的正常代謝途徑也會受到一定程度的影響[18],最終導(dǎo)致細(xì)菌死亡。
2.3 (-)-β-蒎烯對沙門氏菌細(xì)胞膜完整性和通透性的影響
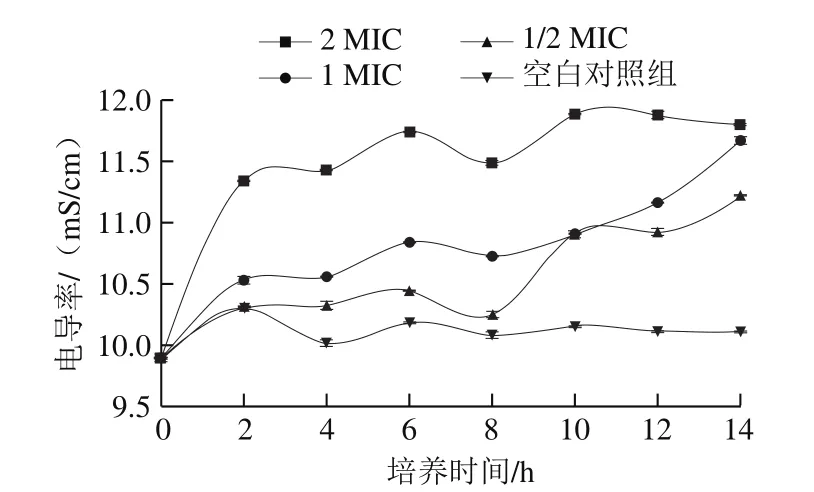
圖2 (-)-β-蒎烯對沙門氏菌電導(dǎo)率的影響Fig.2 Effect of (-)-β-pinene on the conductivity of Salmonella
電導(dǎo)率的變化是衡量細(xì)菌細(xì)胞結(jié)構(gòu)變化的一個重要指標(biāo)。從圖2中可以看出,不加抑菌物質(zhì)的沙門氏菌菌液電導(dǎo)率呈現(xiàn)微小上升的趨勢,由0 h的9.88 mS/cm上升到14 h的10.11 mS/cm;而添加(-)-β-蒎烯的菌懸液電導(dǎo)率明顯增大,如2 MIC的菌液電導(dǎo)率由0 h的9.90 mS/cm增加至14 h的11.80 mS/cm;1 MIC的菌液電導(dǎo)率由0 h的9.87 mS/cm增加到14 h的11.67 mS/cm;1/2 MIC的菌液電導(dǎo)率由0 h的9.91 mS/cm增加至14 h的11.21 mS/cm。整個實驗過程中電導(dǎo)率基本為2 MIC>1 MIC>1/2 MIC>空白對照組,這表明(-)-β-蒎烯使沙門氏菌的細(xì)胞膜結(jié)構(gòu)遭到一定程度的破壞,膜滲透性發(fā)生改變,胞內(nèi)離子如K+、Ca2+、Mg2+外泄增加,從而導(dǎo)致菌液的電導(dǎo)率增大,且(-)-β-蒎烯的含量越大,對膜結(jié)構(gòu)的破壞作用也就越大,離子泄漏也更加多,這與張赟彬等[23]研究的荷葉精油對沙門氏菌的菌液電導(dǎo)率影響結(jié)果相一致。另一方面,在8 h之后,添加抑菌物質(zhì)的菌液電導(dǎo)率都有一定幅度的下降,這可能是因為此時(-)-β-蒎烯與外泄的離子產(chǎn)生了靜電結(jié)合[24],從而導(dǎo)致離子濃度下降,使電導(dǎo)率降低。
綜合2.2、2.3節(jié)中對沙門氏菌細(xì)胞形態(tài)的觀察以及對菌液電導(dǎo)率變化的研究結(jié)果,表明(-)-β-蒎烯對沙門氏菌的細(xì)胞形態(tài)和結(jié)構(gòu)都會產(chǎn)生一定的破壞作用,會導(dǎo)致細(xì)胞變短變粗、破裂、黏結(jié)、細(xì)胞膜的完整性和通透性發(fā)生改變,胞內(nèi)物質(zhì)外溢,從而使電導(dǎo)率增大,影響菌體的正常生長和代謝,最終導(dǎo)致死亡,且(-)-β-蒎烯的含量越大,破壞作用越大。
2.4 (-)-β-蒎烯對沙門氏菌TCA中關(guān)鍵酶活力的影響
2.4.1 對SDH活力的影響
SDH在TCA循環(huán)中主要起到了氧化脫氫的作用,其催化琥珀酸進(jìn)行脫氫反應(yīng),黃素腺嘌呤二核苷酸是該反應(yīng)的輔基,生成黃素腺嘌呤二核苷酸遞氫體,為細(xì)菌細(xì)胞的代謝途徑提供能量,從而使整個TCA循環(huán)具有可持續(xù)性[25-26]。
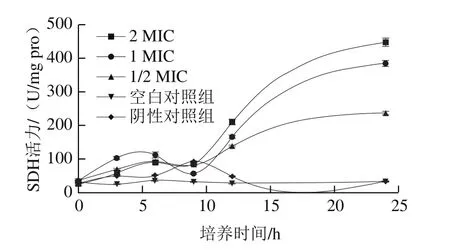
圖3 (-)-β-蒎烯對沙門氏菌SDH活力的影響Fig.3 Effect of (-)-β-pinene on SDH activity in Salmonella
如圖3所示,空白對照組和陰性對照組的SDH活力變化不明顯;而在(-)-β-蒎烯作用下,實驗組的SDH活力呈現(xiàn)先上升后下降再上升的趨勢。在0~9 h,添加不同含量的(-)-β-蒎烯溶液的實驗組波動不明顯,SDH活力差異也較小;9 h之后,實驗組的SDH活力均呈大幅度增加,且明顯有2 MIC>1 MIC>1/2 MIC>對照組,結(jié)果說明隨著培養(yǎng)時間的延長,(-)-β-蒎烯可使沙門氏菌的SDH活力增強(qiáng),這可能是由于(-)-β-蒎烯作用于SDH活力部位,導(dǎo)致沙門氏菌對(-)-β-蒎烯產(chǎn)生了抵抗作用,從而使SDH活力增大,且(-)-β-蒎烯的含量越高,抵抗作用就越強(qiáng),SDH活力就增大得越多。
2.4.2 對α-KGDH活力的影響
在TCA循環(huán)中α-KGDH酶系催化α-酮戊二酸生成琥珀酰CoA,并產(chǎn)生NADH,將電子提供給呼吸鏈[27]進(jìn)而產(chǎn)生細(xì)菌生長繁殖所需要的能量。α-KGDH酶系包括α-KGDH、二氧硫辛酸琥珀酰轉(zhuǎn)移酶和二氫硫辛酸脫氫酶3 種酶。
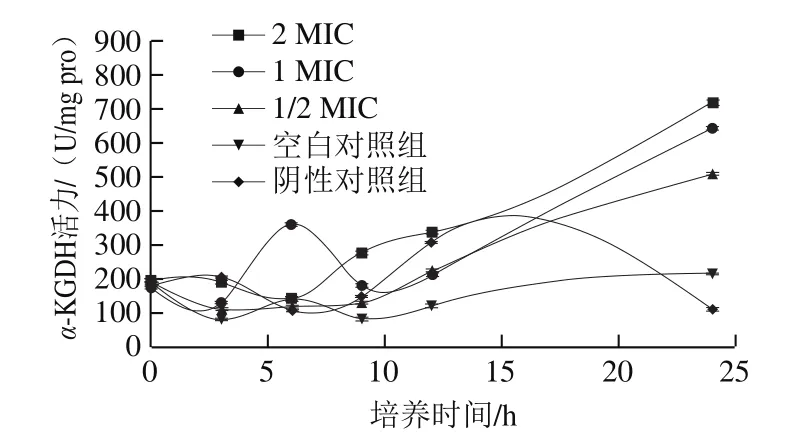
圖1 (-)-β-蒎烯對沙門氏菌α-KGDH活力的影響Fig.1 Effect of (-)-β-pinene on α-KGDH activity in Salmonella
從圖4中可以看出,空白對照組的α-KGDH活力呈波動趨勢,但變化不大,陰性對照組的α-KGDH活力波動變化并最終下降至最低點(diǎn),而添加(-)-β-蒎烯的實驗組的α-KGDH活力在0~9 h內(nèi)呈現(xiàn)波動趨勢,在9 h后,則迅速增大,至24 h時增大至最高點(diǎn),且2 MIC>1 MIC>1/2 MIC>空白對照組>陰性對照組,說明在(-)-β-蒎烯的作用下,隨培養(yǎng)時間的延長,α-KGDH活力增大,這可能是由于(-)-β-蒎烯對沙門氏菌α-KGDH的基因表達(dá)產(chǎn)生影響,使其對抑制物的敏感性增強(qiáng),從而使α-KGDH活力增大。同時,ATP為該酶的別構(gòu)抑制劑,當(dāng)ATP含量充足時,酶活力降低,而當(dāng)ATP含量下降時,酶活力升高。通常,當(dāng)細(xì)胞凋亡、壞死或在毒性物質(zhì)作用下時,細(xì)胞的膜電位會下降,為了保持細(xì)胞的質(zhì)子動勢平衡,ATP的含量也會急劇下降[28]。因此,在(-)-β-蒎烯的作用下可能導(dǎo)致了α-KGDH活力的增強(qiáng)。
2.5 (-)-β-蒎烯對沙門氏菌細(xì)胞內(nèi)ATP含量的影響
ATP是由一分子腺嘌呤、一分子核糖和三分子磷酸組成的不穩(wěn)定化合物,其在細(xì)胞的各種生理、病理過程中起著十分重要的作用,并且直接為生物體生命活動提供能量。
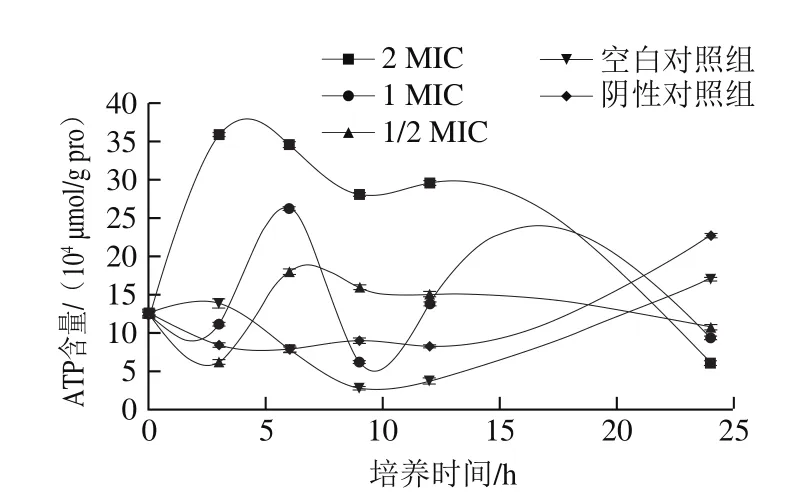
圖5 (-)-β-蒎烯對沙門氏菌ATP含量的影響Fig.5 Effect of (-)-β-pinene on ATP level in Salmonella
從圖5可以看出,空白對照組和陰性對照組的ATP含量在培養(yǎng)前期處于波動狀態(tài),在培養(yǎng)后期均呈現(xiàn)增大趨勢;而添加(-)-β-蒎烯的實驗組,在0~9 h均呈現(xiàn)先上升后下降的趨勢,2 MIC組在3 h時ATP含量增大到最大值,為359 348.849 μmol/g pro;而1 MIC組和1/2 MIC組則在6 h時增大到最大值,分別為262 332.292 μmol/g pro和179 776.059 μmol/g pro;而在培養(yǎng)后期ATP含量急劇下降,在24 h時ATP含量降至最低,分別為60 975.982(2 MIC)、93 195.885(1 MIC)、107 400.849(1/2 MIC)μmol/g pro。結(jié)果表明(-)-β-蒎烯對沙門氏菌生長過程中ATP的形成存在一定程度的影響,會造成ATP含量的下降,這可能是因為在(-)-β-蒎烯的作用下,導(dǎo)致細(xì)胞質(zhì)子動力的降低[29]或者膜電位的降低,阻礙了氫的傳遞與接收[30],從而使ATP的合成受到了抑制。同時,ATP水平的降低也可能是由于細(xì)胞過度凋亡和過度的ATP消耗造成的,因為細(xì)胞凋亡是一種依賴于ATP的過程[30]。總之,(-)-β-蒎烯會削弱沙門氏菌的產(chǎn)能能力。
3 結(jié) 論
綜合以上(-)-β-蒎烯對沙門氏菌的抑菌機(jī)制研究結(jié)果,表明(-)-β-蒎烯主要是通過破壞其細(xì)胞形態(tài)和結(jié)構(gòu),導(dǎo)致離子的泄漏,增強(qiáng)TCA循環(huán)中SDH和α-KGDH的活力以及降低ATP含量來抑制沙門氏菌的正常生長。本研究為之后進(jìn)一步探究(-)-β-蒎烯和精油中其他成分對食源性致病菌的抑菌機(jī)制提供理論支撐和新的思路。

