中西藥物聯用安全性評價—“征靶關聯法”的探索建立*
鄭 蕊,陳詩琪,商洪才
(北京中醫藥大學東直門醫院 北京 100700)
世界衛生組織在“國際疾病和相關健康問題統計分類(ICD)”中承認傳統醫學,這將改變世界各地的醫藥保健模式,更快的推動中醫藥與世界主流醫學的融合[1]。人類疾病譜已經轉向需要長期用藥的復雜疾病,致使聯合用藥情況越來越普遍。許多草藥(如槲寄生、靈芝和黃芪)被證實可減少癌癥化療藥物的毒性[2]。據估計,在世界范圍內約有5.3-88.3%的患者聯用了中草藥[3]。但是臨床使用頻率高,安全風險未知的藥物聯用,尚缺乏精確、循證的證據指導應用。探索建立中西藥聯用安全性評價分析的方法,有助于指導臨床規范用藥,從而規避臨床用藥風險。
1 中西藥聯合應用情況分析
1.1 聯合應用安全性整體情況
在歐洲接受調查者中有18.8%的人至少使用了一種植物補充劑[4]。不合理的聯合應用增加了出現不良反應的風險,導致的住院時間延長,醫療負擔加大。梔子,車前子等中藥與氯氮平聯用,增加了近60%的相關不良風險[5]。在美國的一項調查中,有7%的聯合應用患者曾出現過不良事件[6]。我國2015年藥品不良反應監測年度報告稱,聯合用藥占所有注射劑不良反應發生率的43.4%,占嚴重不良反應發生率的56.5%(http://www.sda.gov.cn/WS01/CL0844/158940.html)。
1.2 中西藥聯合應用特點分析
本文以檢索式=‘herbal medicine’AND‘prescription drugs’(MeSH and text words)檢索Pubmed數據庫近十年數據(檢索時間:2018年10月19日)。納入標準:①涉及中西藥聯用情況,不限制研究類型,研究對象;②與安全性相關。排除標準:①數據不真實;②不能查到全文。檢索結果:初檢文獻862條題錄,經閱讀文題、摘要及進一步閱讀全文后,排除不相關的853篇。最終納入文獻9篇[7-15]。
1.2.1 真實世界中暴露安全性問題
由表1所示,有4篇研究采用橫斷面調查法,3篇為綜述,1篇為病例對照試驗,1篇為構建中西藥相互作用數據庫。分析原因認為,在上市前臨床試驗中,由于試驗目的不同,僅能評價單一用藥的安全性。對于復雜疾病,大多數上市前臨床試驗排除了老年人、兒童等特殊群體、可能有相互作用干擾的藥物。而實際臨床藥物聯用情況復雜,嚴重的聯合用藥副作用在上市前研究中沒有充分暴露。所以中西藥物聯合應用安全性評價重點放在上市后的真實世界中評估。
1.2.2 聯用情況復雜,評價難度高
從近十年文獻情況來看,研究的重點集中在分析聯合用藥使用率,對藥物代謝酶的影響[9-15]。代謝酶的改變會提高不良反應出現的風險。目前的研究方法缺乏從具體臨床現象的分析到對不良反應機制的整體把握。
中藥有自己獨立的理論體系。從現代醫學角度認為,中藥具有多組分的特點,且作用機制尚不完全清楚。聯合應用安全性評價既要重視中醫理論總結,更要了解中西藥各自的藥性特點,其評價的復雜度和難度明顯高于任意單成分的組合。
聯合應用存在交互作用。交互作用是指一個因素各個水平之間反應量的差異隨其他因素的不同水平而發生變化的現象。它的存在說明若干因素的效應非獨立是客觀存在的普遍現象[16]。現已證實交互作用在中西藥聯合中起到重要作用。但交互作用數量眾多,其中還涉及病情、藥物、給藥方式等諸多因素。探索基于臨床特征的中西藥聯用交互作用機制的方法是聯合應用安全性評價的難點、也是關鍵點[17]。
2 現有的中西藥聯合應用安全性評價方法
2.1 文獻歸納分析
文獻歸納分析僅是對聯合應用的經驗分析。中藥講“十八反、十九畏”是早期聯合應用的經驗總結。一方面,文獻記載僅僅是經驗的總結,要探尋聯合應用不良反應的具體機理,得到令人信服的解釋,就往往由于相互作用過程過于復雜,而難以需求。另一方面,可能文獻主要研究指標并非安全性,所以對不良反應的記載的不詳盡,難免遺漏聯合應用中的不良反應細節、使用細節。
2.2 前瞻性研究
一些評價不良事件的量表,可以應用在隨機對照試驗中,從而對兩種治療手段的不良事件發生情況進行定性和定量的比較[18]。但是隨機對照試驗應用于安全性評價有一定的局限性,主要體現在觀察對象選擇、樣本量不足等。臨床安全性集中監測屬于前瞻性研究,在一定時間和一定范圍內,以患者或藥品為線索,詳細記錄住院和/或門診患者不良事件/不良反應的發生以及藥物使用情況。該方法判定不良事件/不良反應與藥品及使用等因素的關系具有一定優勢,彌補被動報告的不足[19]。但是,尚缺乏針對聯合用藥設計的臨床安全性集中監測,對聯合應用出現的不良反應,缺乏進一步的機制研究。
2.3 問卷調查
據Pubmed數據庫近十年文獻的分析,多數使用問卷調查形式。調查對象為患者或臨床醫師,可以獲得聯合應用不良事件的信息。早期聯合應用的報告多為病例報告。人群研究顯示,65歲以上服用銀杏聯合抗血小板/抗凝藥物的患者出血風險增加[20]。但是問卷調查存在回憶性偏倚,如用藥間隔時間回憶不清等,不利于判斷不良反應原因。
3 征靶關聯法評價中西藥聯合應用安全性
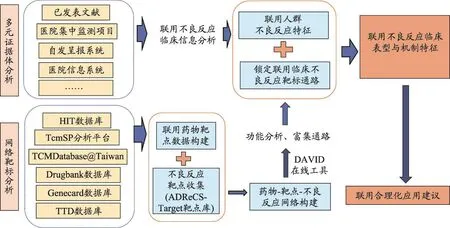
圖1 征靶關聯法—臨床表征與靶點機制結合的中西藥聯合應用安全性評價方法
中藥成分多樣,可在藥物吸收、分布、代謝、排泄、酶抑制等諸多環節,產生增效或者增毒[21]。現有的研究方法僅從單一方面分析,存在一定的局限性。如銀杏與尼卡地平在動物實驗增強CYP3A作用,增強了降血壓作用,但缺乏有力的試驗病例驗證[15]。聯合應用安全性評價目的是考察臨床上發生的潛在毒性作用并做機制分析,提供臨床合理化建議。所以本團隊嘗試探索建立征靶關聯法評價中西藥聯合應用的安全性,以期對研究進展有所推動。
3.1 構建臨床多元證據體
構建多元臨床證據體的目的是全面搜集詳細聯合應用不良反應的信息,如給藥時間、給藥方式等,并不局限于文中所提到的幾種來源。現有不良反應信息的來源有:①文獻作為信息交流的主要方式,需要使用循證、系統的方法整理不良反應詳細信息,避免信息的遺漏。②多中心、大樣本、登記注冊式醫院集中監測的方式屬前瞻性研究,詳細觀測了涉及藥品的不良反應情況,可作為證據來源之一。③自發呈報系統是目前世界上進行不良反應監測最基本的方法。運用該方法對藥品上市后早期警戒信號進行藥物警戒數據挖掘,及時發現聯用不良反應信號[22]。
3.2 引入網絡靶標分析
網絡靶標分析基于藥物分子預測作用通路的理念,可為中西藥聯合應用的安全性評價提供借鑒。網絡靶標分析是研究多藥物、多靶點和疾病之間的相互關系的重要方法[23]。首先,在相關數據庫分別收集中藥、西藥所含所有化學成分,建立涉及反應的中藥、西藥化合物群。其次,通過相關數據庫檢索中藥、西藥化合物作用的毒性靶蛋白,分別與文獻檢索的已知臟器毒性靶蛋白網絡體系進行匹配,構建成份-靶標蛋白網絡,提取網絡中的關鍵靶蛋白。對中藥、西藥兩個網絡都覆蓋的靶蛋白進行高度關注。再次,利用軟件進行基因通路分析,同時結合毒性預測軟件,尋找并預測中藥-西藥聯合作用的毒性靶器官[24]。
3.3 關聯分析及合理化建議
本研究通過對多元證據體獲得不良反應全面詳細資料,分析中-西藥聯合應用出現不良反應臨床癥狀特征。構建生物通路關聯網絡,獲得“成分-靶標”網絡。臨床特征與靶標關聯分析,發掘聯用出現不良反應規律。如是由臨床操作不規范引起,加強臨床規范操作;如臨床不良反應嚴重且與毒性靶蛋白對應關系良好,就應提高足夠警惕,禁止聯用。
4 征靶關聯法實施基礎
4.1 數據來源
自2003年開始,國家藥品不良反應監測中心啟動自發呈報系統收集藥品不良反應/不良事件[25],積累了大量的數據,可作為安全性評價的證據來源之一。為評價安全性,國家開展“重大新藥創制”國家科技重大專項“中藥上市后再評價關鍵技術研究”,采用多中心、大樣本、登記注冊式醫院集中監測的方式,從多家監測醫院收集病例,就發生的不良反應因果關系判定展開討論,不良反應的數據信息可作為安全性評價的證據來源之一。對文獻總結分析是風險信號的重要來源,也是安全性評價的可獲得重要證據來源之一[26]。
4.2 數據庫支持
藥物不良反應層級分類系統靶點庫(ADReCSTarget)可提供了藥物相互作用引起不良反應的蛋白、基因變異等復雜信息,它包括1710個蛋白-不良反應關系,2613個遺傳變異-藥物不良反應關系,63,298個基因-藥物不良反應關系[27]。可為分析中西藥相互作用不良反應分析提供良好分析平臺。
5 結語
中西藥聯合應用安全性是一個復雜的結構體系。若想在臨床實踐中安全有效的進行中-西藥的聯合應用,現階段應盡快進行臨床已經出現的、情況嚴重的、但是否由于聯合應用引起尚不清楚的不良反應分析。基于臨床不良反應特征,結合計算機預測中藥毒性作用機制及作用靶器官信息,建立臨床與機制驗證共同為臨床實踐參考的—“征靶關聯法”新模式。為中西藥聯合應用安全性評價提供了一種新的思路和方法,為指導臨床合理的應用提供依據,為在后期進行關鍵安全性信號監測提供了更明確的指導和方向。

