銅綠假單胞菌MexXY外排泵調控機制研究進展
鞠曉紅 王月華 孫艷美
(吉林醫藥學院,吉林 132013)
銅綠假單胞菌(Pseudomonas aeruginosa, PA)廣泛存在于自然環境,是引起醫院感染的重要條件致病菌,在免疫功能低下人群具有高感染性和高致死率特點。當生存環境發生改變,菌細胞為了維持自身平衡并在劣勢環境中獲得生存,許多正常條件下不表達或低表達基因被誘導性高表達,對抗環境壓力。其中,耐藥性變異是細菌最主要的生存手段。在銅綠假單胞菌眾多耐藥機制的研究中,RND家族的重要地位日益凸顯,成為近年來的研究熱點[1-3]。作為RND家族重要成員之一的MexXY外排泵,由于兼具組成性和誘導性表達雙重性,在銅綠假單胞菌天然耐藥和獲得性耐藥中均發揮重要作用。本文在簡要介紹銅綠假單胞菌RND外排泵系統的基礎上,重點對近年來有關MexXY表達調控機制的研究進展做一綜述,以期為抗假單胞菌藥物研制提供新靶點、為耐藥逆轉提供新思路。
1 銅綠假單胞菌RND外排泵系統簡介
外排泵系統(efflux pump system)又稱藥物主動轉運(active drug efflux)系統,由細菌染色體編碼,在革蘭陰性菌中普遍存在。根據超分子結構及序列同源性將外排泵分為5大家族,即RND家族、主要易化超家族(major facilitator superfamily, MFS)、多藥和毒性化合物外排(multidrug and toxic compound extrusion, MATE)家族,小多重耐藥家族(small multidrug resistance, SMR)和ATP結合盒(ATP-binding cassette, ABC)家族。目前,銅綠假單胞菌中發現的外排泵均屬于RND家族,介導天然耐藥和(或)獲得性耐藥,是其多重耐藥和泛耐藥的物質基礎。功能性RND外排泵以跨膜的三聚體形式轉運底物(圖1),即位于細胞膜的RND轉運子、位于周漿間隙的膜融合蛋白(membrane fusion protein, MFP)和位于外膜的通道蛋白(outer membrane protein, OMP)3部分組成,三聚體鑲嵌在細胞的內外膜上形成外排孔道,減少有害物質在菌體內積聚。目前已命名的銅綠假單胞菌RND外排泵有12種,分別是MexAB-OprM、MexCDOprJ、MexEF-OprN、MexXY-OprM、MexJKOprM、MexVW-OprM、MexGHI-OpmD、MexMNOprM、MexPQ-OpmE、MuxABC-OpmB、TriABCOpmH和CzcCBA,前4種在臨床耐藥菌株中高表達最為常見[4-6]。其中,MexAB-OprM和MexXY-OprM在野生株中組成性低表達,誘導后高表達;MexCD-OprJ和MexEF-OprN屬于誘導性表達。
4種臨床常見高表達外排泵中,MexAB-OprM、MexCD-OprJ和MexXY-OprM屬于負調節表達,分別受負調控蛋白MexR、NfxB和MexZ的調控,編碼基因位于相應外排泵編碼區上游,均與外排泵轉錄方向相反。MexEF-OprN屬于正調節表達,受正調節蛋白MexT調控,編碼基因亦位于外排泵上游,但與之轉錄方向一致。除此之外,RND外排泵還受到其他調節機制的調節,如群體感應系統、雙組分系統以及生存環境等。由于MexXY利用MexAB系統的外膜蛋白OprM,故MexAB-OprM表達下調影響MexXY系統的表達水平,而MexAB-OprM、MexCD-OprJ和MexEF-OprN之間表達存在逆向關系,暗示RND外排系統的調控機制和調控網絡極其嚴謹精密,各成員之間存在著極為復雜的相互關聯。目前有關各外排泵之間調節表達相關性的研究較少,有待于進一步深入探討,明確各成員之間的協同或拮抗關系及調控機制,為耐藥控制提供思路。
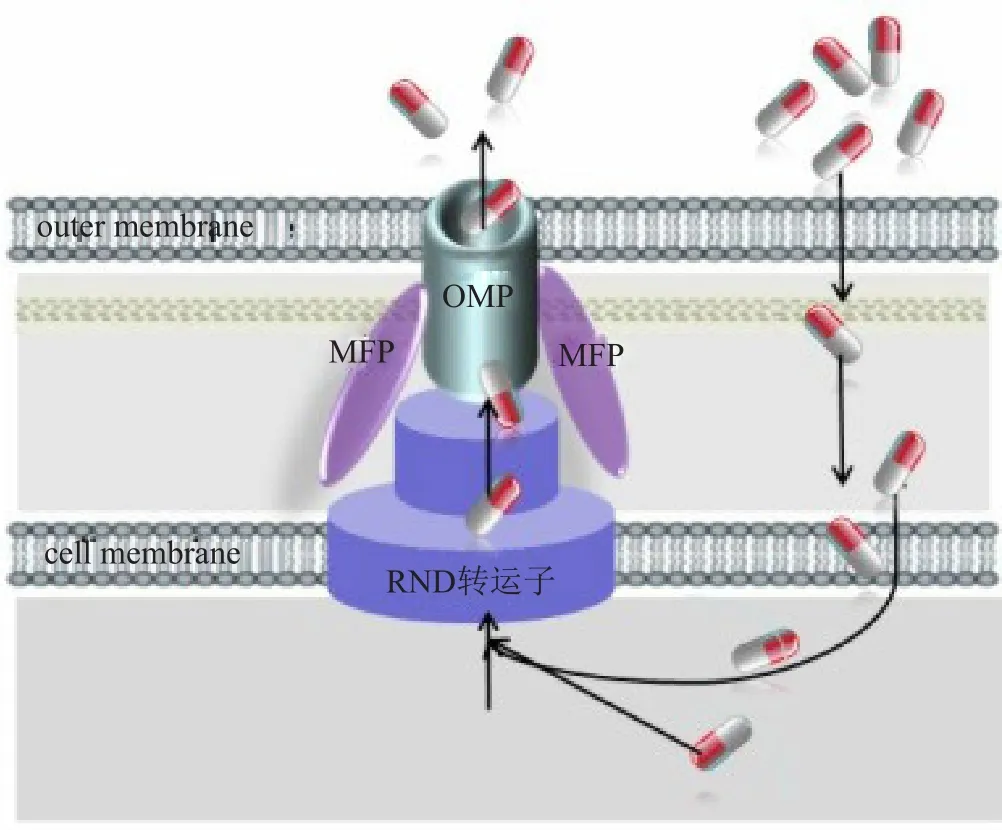
圖1 銅綠假單胞菌RND外排泵結構示意圖Fig.1 Schematic of RND effulx pump structure of Pseudomonas aeruginosa
2 MexXY外排泵結構與功能
MexXY外排泵發現于1999年,由mexXY操縱子編碼,在野生株中低水平組成性表達,暴露于核糖體靶向藥物后被誘導高表達[7]。mexXY操縱子全長5461bp,有2個開放閱讀框(open reading framework,ORF):mexX(1170bp)和mexY(3141bp),分別編碼膜融合蛋白MexX和RND轉運子MexY。由圖1可知,MexY位于細菌細胞膜上,由跨膜區域和突出周質區域兩部分組成,利用質子驅動力為能量,識別并結合外排底物,決定外排底物的特異性;MexX位于菌細胞的周漿間隙,在形成功能性外排泵的動態過程中,誘導或穩定外膜蛋白的開放狀態,同時包圍在MexY外面,形成一個跨越整個周質通道的穩定復合物,將MexY識別的藥物直接排出細胞外。MexX包含389個氨基酸殘基,分子量約41KD,MexY包含1046個氨基酸殘基,分子量約113KD。mexXY操縱子缺乏編碼通道蛋白的基因,雖可利用OpmB、OpmG、OpmI等作為外膜蛋白,但最主要利用的是MexAB-OprM外排泵組成性表達的OprM,組成功能性MexXY-OprM三聚體,MexAB-OprM表達下調可降低MexXY外排泵表達水平。在PA7分支,mexXY操縱子有第3個ORF,編碼OprM樣蛋白OprA作為外膜通道蛋白,組成MexXY-OprA三聚體,OprA與伯克霍爾德菌屬外排泵外膜蛋白高度同源[8]。
MexXY外排泵最主要的功能是通過外排胞內藥物介導銅綠假單胞菌天然和獲得性耐藥,穩定高表達MexXY菌株對所有底物藥物耐藥性升高2~16倍。核糖體靶位藥物(如四環素、慶大霉素、紅霉素等)是誘導MexXY高表達的特異底物,外排氨基糖苷類、四環素類、大環內酯類、氟喹諾酮類、氯霉素、替加環素和兩性離子型頭孢菌素(頭孢吡肟、頭孢吡普)等抗菌藥物。其中氨基糖苷類是MexXY專一的特異底物, 在MexY周質連接槽(periplasm-linked cleft)有其識別區,是氨基糖苷類耐藥決定子[9-10]。MexXY還可作為MexAB-OprM的補償機制協同外排氟喹諾酮類藥物,導致該類藥物耐藥水平升高。高氧環境亦可誘導MexXY表達上調,囊性肺纖維化(CF)患者分離菌株穩定高表達MexXY,可能是細菌在局部活性氧富集環境下的應激反應[11-12]。由此推測,MexXY可能在細菌的抗氧化保護中亦發揮重要作用。
3 MexXY外排泵的表達及調控機制
MexXY外排泵表達受基因水平、轉錄水平和蛋白水平的復雜調控,任一環節突變都可能導致MexXY高表達。目前已鑒定的MexXY高產突變株有3型,分別是agrZ、agrW1和agrW2突變型[13]。agrZ型是負調控基因mexZ自身突變,導致基因失活或編碼蛋白改變;agrW1型是各種原因導致的核糖體缺陷,通過PA5471通路解除MexZ蛋白的阻遏作用,本質上是對核糖體損傷的保護性應激反應;agrW2型與雙組分系統ParRS突變有關。最近,Lau等[14]發現一條新的調控途徑-AmgRS雙組分系統,不依賴上述已知的調節基因,說明MexXY的表達調控可能還涉及更多的未知因素,在局部或全局水平發揮調節作用。
3.1 MexZ通路
MexZ蛋白是負調控基因mexZ的編碼產物,屬于TetR超家族轉錄調節子,包含178個氨基酸殘基,分子量約19KD,N端有典型的DNA結合域,即高度保守的螺旋-轉角-螺旋基序,強效抑制mexXY轉錄。編碼基因mexZ位于mexXY操縱子上游,是mexXY的轉錄抑制子。無誘導因素存在時,MexZ以同源二聚體形式結合在mexX上游的mexZ~mexX間隔區域DNA上,結合位點是mexX翻譯起始點上游-104~66bp之間的20bp回文序列,mexXY啟動子所在區域[15]。MexZ直接抑制mexXY轉錄或通過阻斷RNA聚合酶進入啟動子結合點阻遏mexXY操縱子轉錄。各種原因誘導mexZ變異、MexZ結合DNA能力下降或mexZ~mexX間隔區DNA突變,均可解除MexZ的抑制,暴露mexXY啟動子DNA,轉錄翻譯MexXY。耐藥菌株mexZ測序結果顯示[16],57.9%菌株存在變異,以移碼突變為主(87.9%),其中19.3%發生錯義突變,主要位于二聚體功能區和DNA結合區,46位甘氨酸突變為纈氨酸(G46V)菌株MexZ結合DNA能力完全喪失。抗菌藥物不能通過直接作用于mexZ,抑制MexZ表達或干擾MexZ與間隔區mexXY啟動子DNA結合誘導MexXY高表達,而是通過蛋白-蛋白的相互作用間接對抗MexZ的阻遏作用上調MexXY表達,這一過程的關鍵蛋白是ArmZ,由PA5471基因編碼[15,17]。藥物或活性氧濃度升高可提高mexZ突變率,CF患者高表達MexXY的主要原因是mexZ突變,可能是在肺部活性氧富集的特殊環境下促進mexZ趨同進化(convergent evolution)的結果[18]。
3.2 PA5471通路
PA5471又稱為armZ基因,長度1140bp,編碼抗阻遏蛋白ArmZ。ArmZ直接與阻遏蛋白MexZ結合,將其從mexXY啟動子DNA上解離,下游mexXY基因去阻遏后大量表達。PA5471基因本身受核糖體功能調節,核糖體障礙是誘導ArmZ表達的關鍵因素。目前已知能引起核糖體機能障礙的因素除核糖體靶向藥物外,還有參與蛋白質轉錄翻譯的基因發生突變,如編碼50S核糖體蛋白L21、L27的rplU-rpmA操縱子突變;全局調控基因suhB(PA3818)突變、參與氨基酸轉運的fmt和folD突變等均可通過PA5471解除阻遏,上調MexXY表達、誘導細菌多重耐藥或泛耐藥[19-20]。PA5471缺失菌株MexXY表達顯著降低,對絕大多數底物藥物敏感。各種機制導致的核糖體結構或功能異常主要通過影響PA5471.1mRNA的二級結構調控PA5471轉錄和翻譯,解除MexZ對mexXY的抑制,清除核糖體損傷因素。
PA5471.1位于PA5471與PA5472之間367bp的間隔序列中,在PA5472下游114~155bp處,啟動子距離PA54723'端20bp,編碼一個含13個氨基酸殘基的前導肽(leader peptide),是PA5471的翻譯弱化子[21]。細菌生活在不存在核糖體受損因素環境時,轉錄的PA5471.1mRNA與鄰近區域形成1~2區配對、3~4區配對的兩個莖-環(stem-loop)結構,配對的4區在靠近PA5471翻譯起始位點形成富含尿嘧啶的轉錄終止子,通過轉錄衰減機制(transcriptional attenuation mechanism)阻止PA5471轉錄。當細菌處于氨基糖苷類、大環內酯類等核糖體靶向藥物環境或其他損傷核糖體的環境時,由于蛋白質合成功能受損、異常多肽出現,菌體正在合成新生肽鏈的核糖體停止活動,前導肽翻譯受阻,大量核糖體與tRNA、前導肽等結合成復合物停滯在PA5471.1的mRNA上,即通過核糖體停靠(ribosome stalling)機制,改變前導肽mRNA二級結構,阻礙1~2區配對形成莖-環結構,游離的2區與3區配對形成反終止子(antiiterminator),3~4區解離,轉錄終止子無法形成,對下游PA5471轉錄的抑制作用解除,PA5471轉錄翻譯挽救停靠的核糖體,實質是細菌啟動的核糖體保護機制(ribosome protection mechanisms)。大量翻譯的ArmZ蛋白與阻遏蛋白MexZ結合,mexXY啟動子暴露,RNA聚合酶進入啟動子位點,下游mexXY轉錄、翻譯,高表達MexXY外排泵。
3.3 ParRS通路
ParRS雙組分系統由位于同一操縱子的parR(PA1799)和parS基因(PA1798)編碼反應器蛋白ParR和傳感器激酶ParS。Fernández等[22]在研究銅綠假單胞菌多黏菌素耐藥機制時發現,多黏菌素可以不依賴MexZ和PA5471,通過激活雙組分系統ParRS獨立上調mexXY表達介導獲得性耐藥。雖然多黏菌素并非MexXY的特異底物,但多黏菌素耐藥菌株mexXYmRNA表達水平明顯上升[23]。進一步研究發現[24],ParRS變異菌株mexZ、PA5471基因序列及mRNA表達水平均未見改變;敲除ParRS變異株的PA5471、mexZ基因,mexY表達水平僅升高2倍,耐藥水平也未見明顯變化,mexY的表達水平和耐藥性變化明顯低于ParRS未變異PA5471、mexZ基因敲除菌株。上述結果說明,ParRS變異株MexXY高表達與已知的mexXY調控因子PA5471和mexZ無關,存在獨立的調節通路。變異株測序結果顯示,ParS蛋白L50P、A138T、R185G、A215T、A324V變異后組成性激活ParRS,上調mexXY表達,除A138T外均發現于動物菌株[25]。
研究認為[22],ParRS活化具有環境誘導性,陽離子抗菌肽是ParRS活化的強誘導劑。銅綠假單胞菌一旦在環境中檢測到特定信號,如多黏菌素,ParS傳遞信號激活ParR,活化的ParR主要作用是激活脂多糖修飾操縱子(lipopolysaccharide, LPS)arnBCADTEF-ugd基因、下調孔蛋白OprD和上調外排泵mexXY表達,通過改變藥物靶位、降低膜通透性和主動外排抵抗藥效、降低胞內毒性物質累積,介導對多黏菌素、β-內酰胺類、氨基糖苷類、氟喹諾酮類等藥物的多重耐藥。在沒有多黏菌素環境下,ParRS變異株mexXY轉錄水平無明顯變化;敲除未接觸多黏菌素野生株的parRS基因,細菌耐藥性及mexY也無改變;動物來源銅綠假單胞菌耐藥基因檢測發現,OprD表達下調的ParS變異菌株mexYmRNA水平顯著上升(升高9.44~72.57倍)[24]。根據上述結果推測,ParRS誘導mexXY高表達的目的并非針對MexXY的底物,可能只是細菌抵抗多黏菌素的伴隨結果,在對靶位的修飾或下調孔蛋白的過程中碰巧影響了與mexY表達有關的某個基因或蛋白。關于ParRS激活mexXY啟動子的機制尚不清楚,ParRS與眾多的上下游調節基因和蛋白相關,是否通過其中的某一種或幾種基因發揮作用,目前均不可知,詳細機制有待進一步闡明。
3.4 AmgRS通路
AmgRS是銅綠假單胞菌中普遍存在的包膜壓力應激調節雙組分系統,功能類似于大腸埃希菌的CpxRA,是對氨基糖苷類等藥物作用后產生異常多肽造成細胞膜損傷的一種適應性反應[14]。在amgR基因缺失菌株,慶大霉素對菌細胞膜的損傷明顯加重[26]。PA5471基因缺失菌株AmgS出現錯義突變(V121G)可3倍上調mexXY表達水平,說明AmgRS是不依賴ArmZ上調mexXY表達的又一通路。氨基糖苷類藥物暴露和amgS變異是激活AmgRS的主要途徑,活化的AmgRS通過增強MexXY表達外排藥物減輕因異常多肽插入細胞膜造成的菌體損傷。RNA聚合酶抑制劑利福平存在時,氨基糖苷類藥物巴龍霉素的活性明顯增強(MIC下降8倍),推測可能是利福平干擾蛋白質合成的同時抑制了巴龍霉素誘導的異常多肽合成,包膜壓力應激反應未啟動的結果。非氨基糖苷類藥物不能通過AmgRS途徑誘導mexXY表達,主要依賴ArmZ蛋白的抗阻遏作用,MexXY表達不受amgS、amgR影響。
AmgRS可能通過htpX、yccA、PA55283個靶基因間接調控mexXY的表達,三者是雙組分系統介導氨基糖苷類固有耐藥的主要因素[27]。htpX和yccA分別編碼大腸埃希菌胞漿膜相關蛋白酶和FtsH蛋白酶調節子的同源物,負責膜質量監控;PA5528編碼一種功能未知的膜相關蛋白。慶大霉素誘導后,amgR 陽性菌株htpX和PA5528表達水平升高2~3倍,amgR陰性菌株未見變化,推測AmgRS介導的mexXY表達可能依靠靶基因編碼的蛋白酶完成。在對amgRS、htpX、yccA和PA5528基因影響巴龍霉素耐藥性的研究中發現[28],amgR敲除菌株MIC下降8倍;htpX和PA5528單獨缺失菌株MIC分別上升和下降2倍,yccA單獨缺失MIC不受影響;htpX-PA5528雙缺失菌株MIC升高2倍,htpX-yccA或yccA-PA5528雙缺失MIC均下降4倍;三者同時缺失MIC下降32倍。據此證實,amgR通過3個靶基因介導耐藥,而三者在結構、作用底物或編碼產物等方面必然有相同之處,能部分功能互補,完成AmgRS依賴的MexXY表達調控。另外,3個靶基因同時缺失與amgR敲除株相比,藥物敏感性上升了4倍,說明可能存在amgR之外的調節因素,也可能氨基糖苷類藥物本身能影響其中的某個或某幾個基因表達,單獨存在時介導低水平耐藥。htpX敲除菌株PA5528表達上調,而PA5528敲除菌株htpX基因無明顯變化,說明二者可能部分共享調節基因。
AmgRS調控MexXY表達的本質是對異常蛋白干擾膜正常結構的應激反應。氨基糖苷類藥物作用核糖體后出現翻譯錯誤,產生的異常多肽插入細胞膜,膜功能異常激活包膜應激反應AmgRS雙組分系統,AmgS、AmgR依次激活,啟動靶基因htpX、yccA、PA5528轉錄,翻譯的活性蛋白酶降解插入細胞膜的異常多肽減輕菌細胞膜損傷,同時產生的降解產物可能是mexXY的底物或誘導劑,上調其高表達外排藥物。不造成膜損傷的氨基糖苷類不能啟動AmgRS,主要依賴PA5471途徑上調MexXY。
綜上所述,MexXY外排泵高表達本質上是細菌應對環境壓力的一種自我保護措施。目前已知誘導MexXY高表達的因素有3個(圖2):一是局部調節基因mexZ突變;二是核糖體結構或功能障礙;三是細菌胞膜受損。各種原因導致的核糖體功能障礙主要依賴PA5471途徑調控,通過核糖體停靠改變前導肽mRNA二級結構,解除對下游PA5471的轉錄抑制。胞膜受損因機制不同啟動路徑亦有差異,異常多肽插入引起的膜損傷激活AmgSR通路;多黏菌素造成的胞膜破壞啟動ParRS通路,但機制不清。最近有研究顯示[29],鈣離子濃度升高mexXYmRNA表達上調,推測可能與鈣離子轉運蛋白有關,具體機制有待研究。
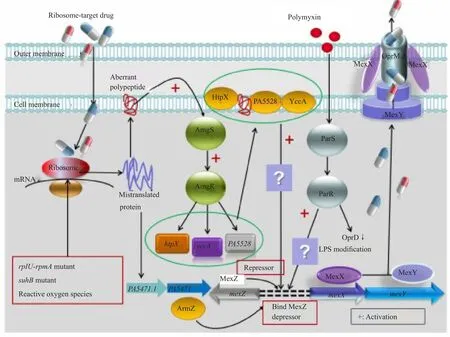
圖2 銅綠假單胞菌MexXY外排泵表達調控機制Fig.2 Regulation mechanism of MexXY ef flux pump expression of Pseudomonas aeruginosa
4 問題與展望
MexXY外排泵的表達調控涉及眾多基因和蛋白,共同組成了一個復雜、多水平的調控網絡。在生存環境存在不利因素時,通過某些基因的激活和失活清除有害物質、維持細胞的正常結構和功能。目前關于MexXY表達調控研究得較為清楚的是PA5471通路,新發現的AmgRS和ParRS雙組分系統誘導MexXY表達的具體機制尚不清楚,尤其是ParRS系統。闡明確切的調控機制是相關抑制劑研發,逆轉耐藥的前提和基礎。ParRS和AmgRS通路的基因調控、調控網絡中各調節基因對其他RND外排泵的影響以及有效外排泵抑制劑的篩選是未來研究應重點關注的問題。

