酶標儀法測定微孔板發酵液中林可霉素
余飛 秦艷飛 王洲 孫俊峰 張敏 薛正蓮,*
(1 安徽工程大學生物與化學工程學院,微生物發酵安徽省工程技術研究中心,蕪湖 241000;2 新宇藥業股份有限公司,宿州 234000)
林可霉素屬于林可胺類抗生素[1],對于革蘭陽性菌(藤黃八疊球菌、肺炎鏈球菌等)及支原體等引起的感染具有較好的治療效果,目前已成為臨床主要抗生素之一[2-5]。關于林可霉素的測定,近年來國內外有膠體金免疫層析法、高效液相色譜法(HPLC)、高效液相色譜串聯質譜法(LC-MS/MS)、流動注射-化學發光分析法、旋光法等[6]。但以上方法大多成本高、周期長、操作復雜,不宜用于大批量樣品的檢測。
酶標儀和分光光度計滿足吸光物質濃度在一定波長下與吸光度成線性相關的規律,是實驗室常用的設備,都適用于物質的檢測定量分析[7-9]。但分光光度計相對于酶標儀定量檢測物質操作復雜,效率低,試劑用量大,尤其是大批量樣品的快速檢測[10]。
林可霉素是由林肯鏈霉菌發酵產生的次級代謝產物,菌種生產能力的提升主要通過誘變技術獲得,誘變所獲得的大量的突變株經微孔板發酵后如何快速、準確的測定發酵液中林可霉素含量也是制約高產菌株高通量選育的重要因素。目前關于酶標儀法測定微孔板發酵液中林可霉素含量方面的研究尚未見報道,本實驗通過酶標儀法測定微孔板發酵液中林可霉素的含量,并利用Origin 8.6軟件與分光光度計法進行了擬合,顯示兩種方法具有很好的一致性,為后續高通量選育林可霉素高產菌株奠定了基礎。
1 材料與方法
1.1 儀器
BioTek Epoch全波長酶標儀;常溫室壓等離子誘變系統(ARTP),北京思清源生物科技有限公司;單道、八道手動可調移液器,Sartorius;TU-1810 紫外可見分光光度計,北京普析通用儀器有限責任公司;HTS-T008 Canvic甘薇深孔板搖床,上海甘薇生物科技有限公司。
1.2 藥品和試劑
林可霉素標準品(含量為96.2%,批號:1604312x),新宇藥業股份有限公司;氯化鈀(分析純),國藥集團化學試劑有限公司;鹽酸(分析純),南京化學試劑有限公司;水為蒸餾水。
0.02 mol/L氯化鈀溶液:稱取氯化鈀0.3547g,用1mol/L鹽酸溶解并定容至100mL,避光保存。
5mg/mL林可霉素工作液(I):稱取林可霉素標準品500mg,加蒸餾水溶解,用容量瓶定容至100mL。
5mg/mL林可霉素工作液(II):稱取林可霉素標準品500mg,加新鮮發酵培養基溶解,用容量瓶定容至100mL;8000r/min離心5min,吸取上清液待用。
1.3 菌種
林肯鏈霉菌:本實驗室保存。
1.4 培養基
種子培養基(g/L):淀粉20、豆粉20、葡萄糖15、硫酸銨1.5、碳酸鈣4、玉米漿30,pH7.0。115℃,滅菌25min。
發酵培養基(g/L):淀粉20、葡萄糖90、豆粉20、氯化鈉4、硝酸鈉8、硫酸銨7、玉米漿3、碳酸鈣8、磷酸二氫鉀0.25,pH7.0。115℃,滅菌25min。
1.5 實驗方法
1.5.1 檢測波長的選擇
吸取5mg/mL林可霉素工作液150μL置于1.5mL EP管中,加入0.02mol/L氯化鈀溶液150μL,用1mol/L鹽酸定容至1mL,放置30min,吸取反應液100μL至酶標板,以不含林可霉素同法配制的溶液作為空白對照,使用全波長酶標儀在200~900nm波長范圍內進行吸收圖譜掃描。
1.5.2 林可霉素測定原理及方法
實驗原理:在酸性條件下林可霉素與氯化鈀能夠形成有色絡合物,隨著林可霉素濃度的增大該絡合物的顏色逐漸加深,在一定的波長下可以使用酶標儀定量檢測林可霉素的濃度[11]。
分光光度計法:參考文獻[12]測定樣品中林可霉素含量。
酶標儀法:吸取發酵液150μL,依次加入0.02mol/L氯化鈀溶液150μL,用1mol/L鹽酸定容至1mL,放置30min,吸取反應液100μL至酶標板,以不含林可霉素空白溶液為對照,在380nm波長處測定其吸光度。
1.5.3 0.02mol/L氯化鈀溶液添加量的影響
5mg/mL林可霉素工作液分別取50、100、150、200和250μL,0.02mol/L氯化鈀溶液取值為0、25、50、100、150、200、250、300和350μL,用1mol/L鹽酸定容至1mL,放置30min,吸取反應液100μL至酶標板,以不含林可霉素空白溶液為對照,在380nm波長處測定其吸光度。
1.5.4 1mol/L鹽酸添加量的影響
5mg/mL林可霉素工作液分別取50、150和250μL,加入0.02mol/L氯化鈀溶液150μL,分別用0、0.5、1、1.5和2mol/L鹽酸定容至1mL,放置30min,吸取反應液100μL至酶標板,以不含林可霉素空白溶液為對照,在380nm波長處測定其吸光度。
1.5.5 標準曲線的建立
分別吸取用蒸餾水和發酵培養基制備的5mg/mL林可霉素工作液(I、II)50、100、150、200和250μL,按優化后的方法在380nm波長下酶標儀檢測吸光度值,繪制標準曲線1、2。比較標準曲線1和2差異。
1.5.6 精密度試驗
取已知質量濃度的發酵液,分為2份,分別加入5mg/mL林可霉素工作液75和225μL,制備待測溶液,按優化后的方法在380nm波長下酶標儀檢測吸光度值,計算林可霉素含量。
1.5.7 穩定性試驗
吸取5mg/mL林可霉素工作液150μL,置于1.5mL EP管中,按優化后的方法,放置0、0.5、1.0、1.5、2.0、2.5和3.0h,在380nm波長處測定其吸光度。
1.5.8 加標回收試驗
取已知質量濃度的發酵液,分為5份,分別加入5mg/mL林可霉素工作液25、75、125、175和225μL,制備待測溶液,按優化后的方法在380nm波長下酶標儀檢測吸光度值,計算回收率。
1.5.9 兩種方法的擬合驗證
按優化后的方法在380nm下,分別使用酶標儀和紫外可見分光光度計測定由ARTP誘變所獲得的25株突變株經48孔板發酵后其中的林可霉素含量,并用Origin 8.6軟件對兩種方法進行擬合分析。
2 結果與討論
2.1 檢測波長的選擇
按方法“1.5.1”項所測得的結果見圖1。由圖1可見,林可霉素與氯化鈀形成的絡合物在380nm波長處有最大吸收,故選擇380nm為檢測波長。
2.2 氯化鈀溶液添加量的影響
按方法“1.5.3”項所測得的結果見圖2。如圖2所示,當林可霉素濃度為250~1250μg/mL時,A值隨著氯化鈀溶液量的增加而遞增,當氯化鈀溶液的添加量達到150μL時,A值達到最大,繼續增加氯化鈀溶液的量,A值保持不變,因此當林可霉素濃度為250~1250μg/mL時,實驗確定添加0.02mol/L氯化鈀溶液150μL。
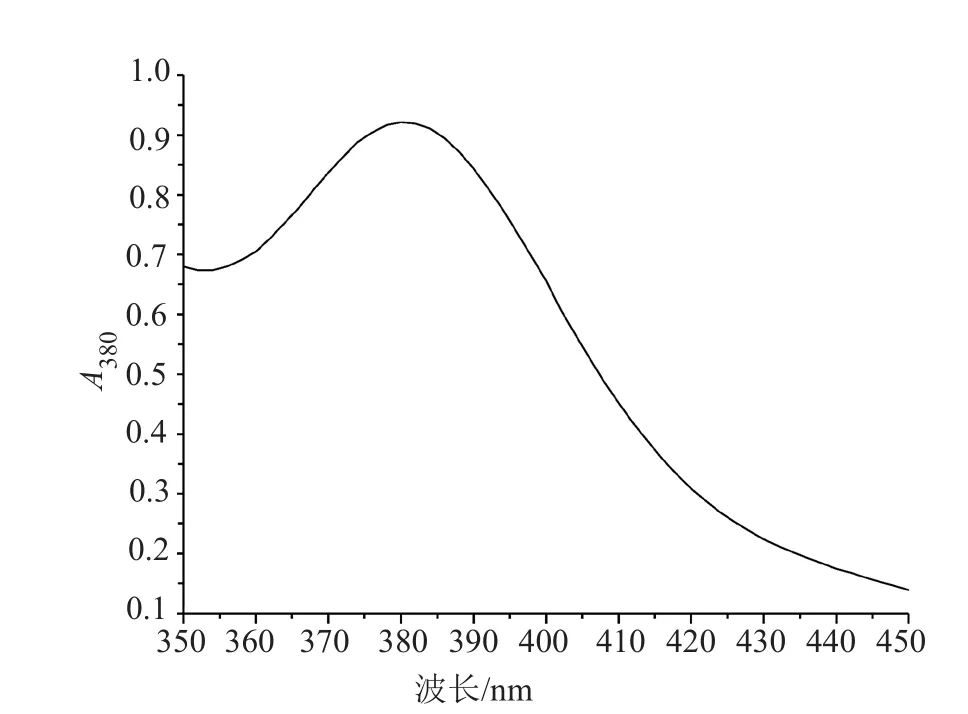
圖1 林可霉素紫外吸收圖譜Fig.1 UV absorption spectra of lincomycin
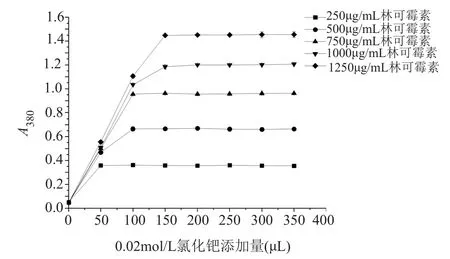
圖2 氯化鈀溶液添加量對吸光度的影響Fig.2 The in fluence of palladium chloride on absorbance
2.3 鹽酸添加濃度的影響
按方法“1.5.4”所測得的結果見圖3。如圖3所示,含相同濃度林可霉素的反應體系中,反應后的吸光度隨著鹽酸添加濃度的增加而增大,當鹽酸添加濃度為1mol/L時,吸光度達到最大,繼續增大鹽酸添加濃度,吸光度幾乎保持不變,因此在反應體系中可直接用1mol/L鹽酸定容。
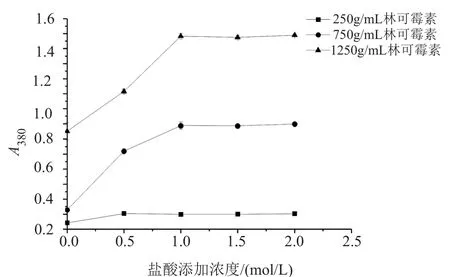
圖3 鹽酸添加濃度對吸光度的影響Fig.3 The in fluence of hydrochloric acid on absorbance
2.4 標準曲線的建立
按方法“1.5.5”繪制林可霉素濃度的標準曲線1和2,結果見圖4。由標準曲線1和2可知,林可霉素的濃度在250~1250μg/mL范圍內,測定的吸光度與濃度線性關系良好,可以用于林可霉素濃度的測定;且由表1可知,含相同濃度林可霉素的水溶液與培養基溶液,其A380差值均小于0.1,表明培養基成分干擾較小。
2.5 精密度試驗
按方法“1.5.6”所測得的精密度結果見表2。由表2可知,各組在低濃度和高濃度的RSD均小于0.5%,表明該方法測定林可霉素含量精密度高。
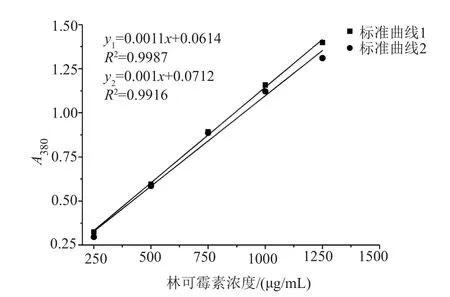
圖4 林可霉素標準曲線1與2對比Fig.4 Comparison of lincomycin standard curve 1 and 2
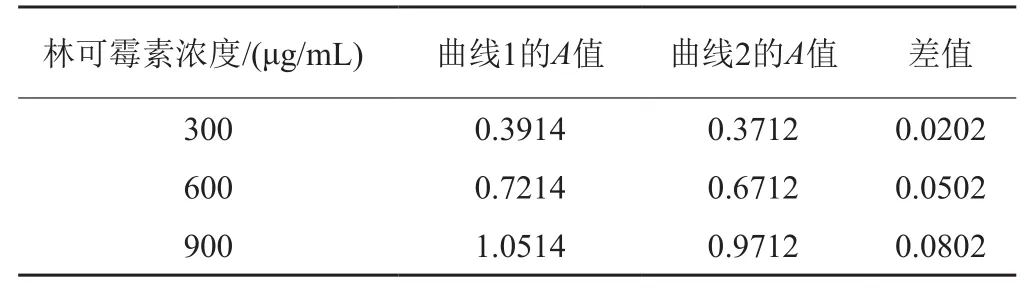
表1 標準曲線1與2差異比較Tab. 1 Comparison of lincomycin standard curve 1 and 2
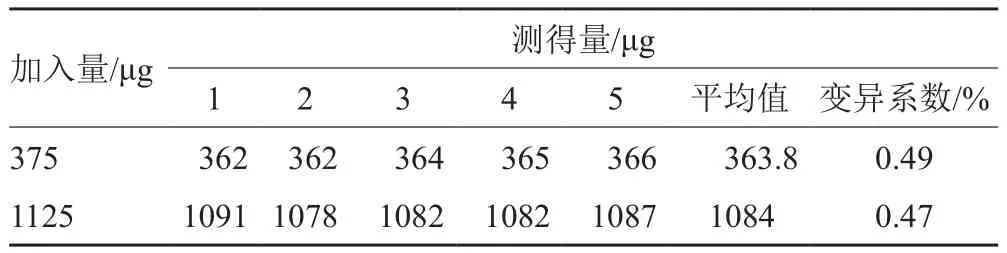
表2 精密度試驗Tab. 2 Accuracy examinations
2.6 穩定性試驗
按方法“1.5.7”項所測得的穩定性結果見表3。從表3可知,林可霉素工作液在3.0h內吸光度基本保持不變,穩定性良好。
2.7 加標回收試驗
按方法“1.5.8”項所測得的回收率結果見表4。從表4可知,平均回收率為96.84%,RSD為0.91%。結果表明,采用酶標儀法測定林可霉素加樣回收率較高。
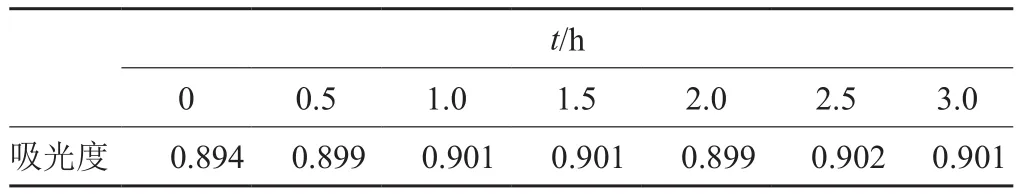
表3 林可霉素工作液的穩定性試驗結果Tab. 3 The stability test of lincomycin working solution
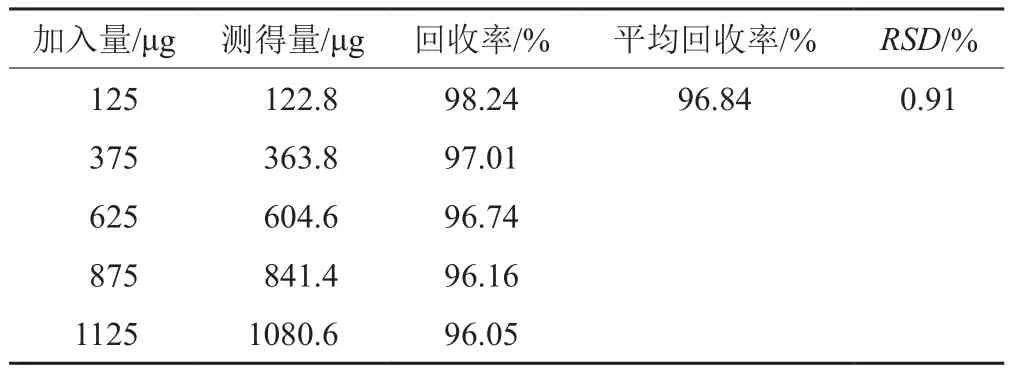
表4 加標回收率Tab. 4 Recoveries of spiked sample
2.8 擬合曲線的建立
按“1.5.9”項優化后的方法在380nm下,分別使用酶標儀和紫外可見分光光度計測定25株突變株孔板發酵液中林可霉素的含量,并利用Origin 8.6軟件驗證兩種方法的相關性,結果如圖5所示。
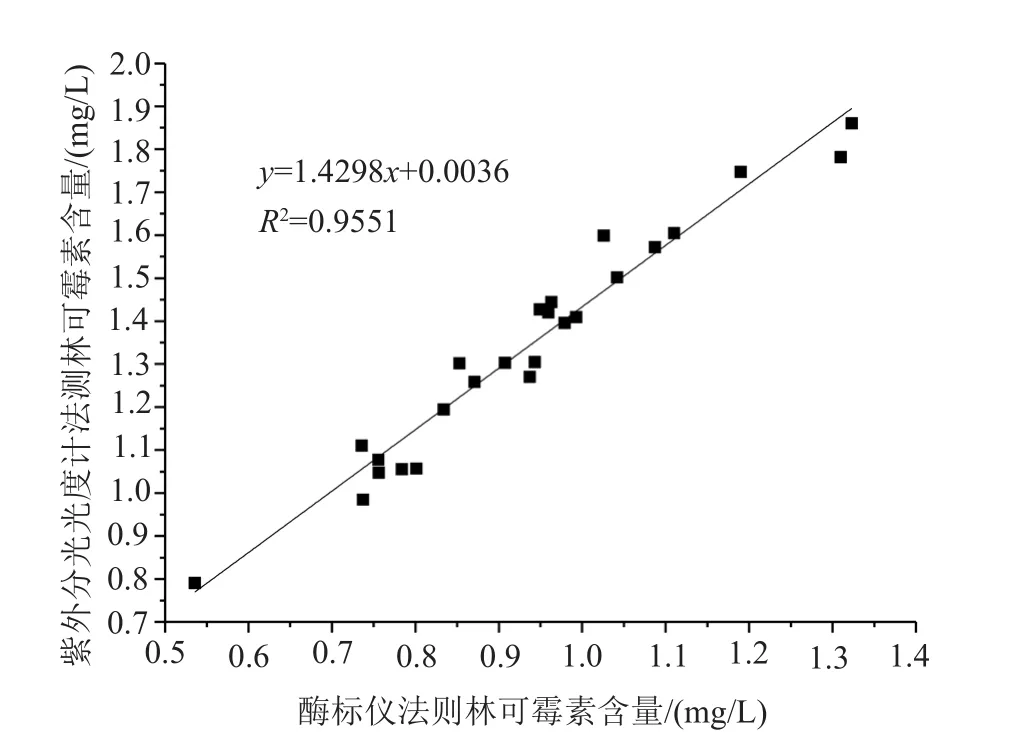
圖5 酶標儀法與分光光度計法的擬合曲線Fig.5 Thefitting curve of the enzyme-labelling and spectrophotometer measuring instrument
相關強度由相關系數的絕對值決定,相關系數的正負系數是相關方向。根據經驗,統計學家提出了相關性強度的判斷標準,將R2=0.7000作為一個較高的相關關系[13]。由圖5可知,擬合曲線的R2=0.9551,表明酶標儀法與分光光度計法具有很好的正相關性,可以利用酶標儀法快速、高效的測定較多發酵樣品中林可霉素的含量。
3 結論
本實驗采用酶標儀法檢測微孔板發酵液中林可霉素的含量并優化了該方法的主要影響因素,同時檢測了該方法的精密度,結果顯示該方法對于檢測微孔板發酵液中林可霉素的含量具有很好的可靠性;本實驗還利用Origin 8.6軟件對酶標儀法與分光光度計法測定發酵液中林可霉素的含量進行曲線擬合,顯示兩種方法具有很好的相關性;酶標儀法可以用于大批量樣品的快速檢測,為后續高通量選育林可霉素高產菌株奠定了基礎。

