揭秘中考化學源于教材的科學探究題
劉明根 王廷虎
(1.安徽省無為三中城南校區 238399;2.安徽省無為縣教子灣中學 238341)
科學探究是新課程的重要內容和學習方式,更是中考命題的重點和熱點.近年來,在全國各地的中考化學試題中,一些來源于教材中的較典型的“活動與探究”和重要實驗已成為命題素材的熱點內容之一.這類試題不僅能很好地考查學生的綜合實驗和科學探究的能力,而且還能有效地培養學生的科學精神和科學方法,提高學生的綜合素質,具有很強的選拔功能.
一、空氣中氧氣含量的測定
例1 某化學實驗小組用兩種方法驗證空氣中的氧氣含量.
方法一:如圖1所示進行.
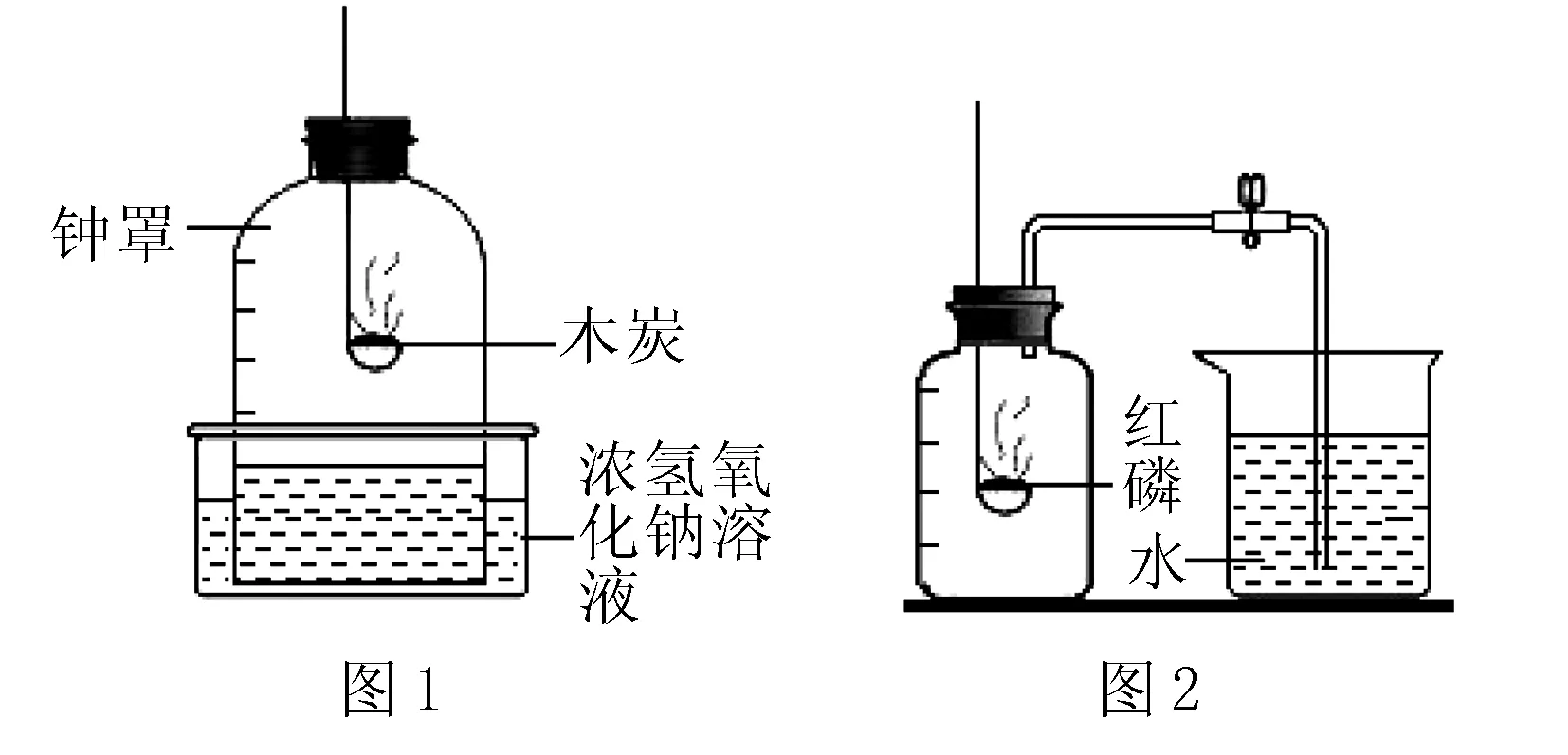
(1)寫出圖1中二氧化碳與氫氧化鈉溶液反應的化學方程式____.
(2)小星同學對該實驗提出質疑:木炭在燃燒過程中,氧氣濃度降低,參加反應的木炭與氧氣的質量之比在____范圍內,生成的CO對實驗結果會產生誤差.
方法二:如圖2所示進行.
(1)寫出圖2中紅磷燃燒的化學方程式____.
(2)實驗測定數據如表:(集氣瓶的容積為100mL).

組別123456進入集氣瓶中水的體積/mL302119221520
分析實驗數據,第2,3,4,6組驗證出氧氣約占空氣體積的____,第5組出現較大偏差的原因可能是____.
解析方法一:(1)二氧化碳與氫氧化鈉反應生成碳酸鈉和水;(2)若碳完全燃燒,生成氣體全部為二氧化碳時,碳與氧氣的質量比為3∶8,其中產生的二氧化碳可以完全被氫氧化鈉溶液吸收,通過液面上升的體積可以計算氧氣的體積分數;若碳不完全燃燒,生成氣體全部為一氧化碳時,碳與氧氣的質量比為3∶4,由于一氧化碳不能被氫氧化鈉溶液吸收,不能測定出氧氣的含量;因此要產生一氧化碳,其中參加反應的碳和氧氣的質量比必須滿足的條件為大于3∶8而小于等于3∶4.方法二:(1)紅磷燃燒產生五氧化二磷;(2)第2,3,4,6組的水的體積就是消耗的氧氣的體積,與空氣的體積100mL進行比較,結果得出氧氣約占空氣體積的1/5;而第五組的結果會偏小,可能是沒有冷卻到室溫讀數、紅磷量不足、裝置漏氣等原因.

二、探究催化劑的性質
例2 為比較相同濃度的FeCl3溶液和CuSO4溶液對H2O2分解的催化效果,某研究小組進行了如下探究:
(1)請寫出H2O2分解的化學方程式____.
【定性研究】

(2)如圖3,可通過觀察來定性比較兩者的催化效果.
【定量研究】 (3)如圖4,實驗前檢查該裝置氣密性的方法是____.要定量比較兩者的催化效果,可測量生成等體積氣體所需的____.
【深入研究】(4)在FeCl3溶液中,究竟是哪種粒子起催化作用呢?
猜想1:鐵離子(Fe3+)起催化作用;
猜想2:____起催化作用;
猜想3:____起催化作用;……
請設計實驗,驗證猜想1:

實驗操作實驗現象及結論
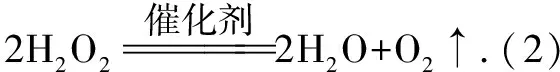


實驗操作實驗現象及結論取2支試管,各加入2mL 5%的H2O2溶液,再分別加入同濃度、同體積的FeCl3和HCl溶液,觀察現象若加入FeCl3溶液的試管中產生氣泡更快,則猜想1成立;否則,不能證明猜想1成立(需要進一步探究)
三、探究分子的性質
例3 小明同學對探究分子性質的實驗(如圖5所示)進行了改進.如圖6所示,試管丁、戊中各有一張每隔2厘米滴有一滴酚酞溶液的濾紙條,裝有適量濃氨水的小藥瓶固定在橡皮塞上,試管丁中小藥瓶上的瓶塞已塞緊,試管戊中的小藥瓶上無瓶塞.

關于圖5、圖6中的實驗有以下說法:
①圖6比圖5的實驗更環保、更節約;②圖5和圖6的實驗均能證明分子在不斷的運動;③濃鹽酸有揮發性,僅將濃氨水換成濃鹽酸也可達到實驗目的;④如果丁中沒有小藥瓶,圖6的實驗也可達到實驗目的;⑤若將戊浸入冰水中,濾紙條不會變紅.
以上說法中錯誤的是( ).
A.①② B.③④ C.③⑤ D.④⑤
解析對比改進前的實驗,改進后實驗的優點是能夠防止氨氣擴散到空氣中,污染大氣,且氨水用量較少,更能節省藥品,①正確;圖5實驗中,倒扣在大燒杯內的酚酞溶液變紅色,大燒杯外的酚酞溶液不變紅色,說明分子在不斷運動,圖6的實驗中,試管丁中盛放濃氨水的小藥瓶瓶塞塞緊,所以丁中濾紙條上的酚酞溶液不變紅色,戊試管中盛放濃氨水的小藥瓶沒有瓶塞,濾紙條上的酚酞溶液變紅色,說明分子不斷運動,②正確;濃鹽酸雖然具有揮發性,但鹽酸不能使酚酞溶液變色,故將濃氨水換成濃鹽酸不能達到實驗目的,③錯誤;圖6的實驗中,丁試管中沒有小藥瓶也可以與戊試管形成對照實驗,也可達到實驗目的,④正確;若將戊試管浸入冰水中,分子運動速度減慢,但依然能使濾紙條上的酚酞變紅,⑤錯誤.答案:C
四、模擬電解水的過程
例4 圖7為電解水的實驗裝置圖.接通電源觀察兩電極都有氣泡產生.
(1)通電一段時間后,玻璃管a收集到的氣體是____,a、b兩玻璃管收集的氣體體積比約為____.
(2)圖8為水分解的微觀過程:
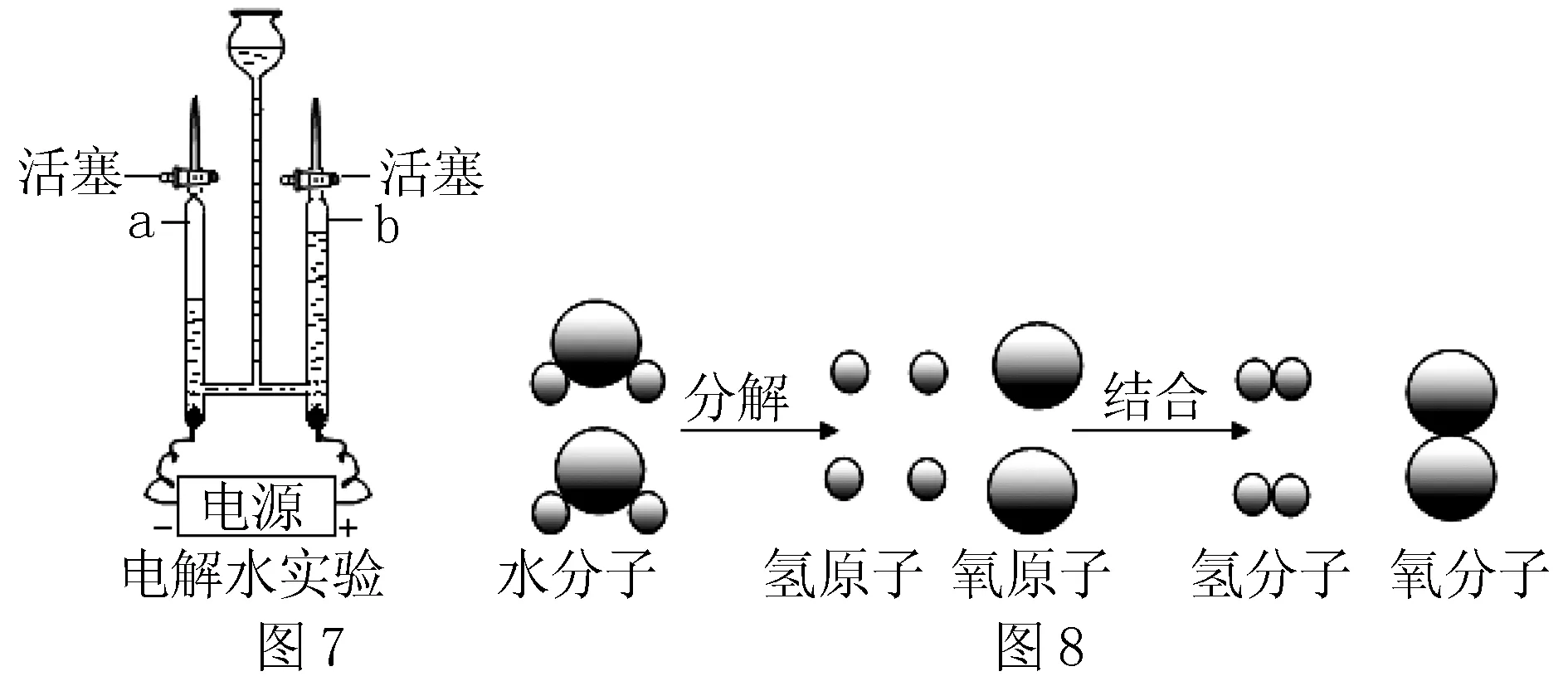
①水的分解過程中,不發生變化的微粒是____.
②結合實驗現象,寫出水通電分解的化學方程式____.
(3)已知同溫同壓下,氣體的體積比決定于氣體的分子個數比.該實驗中能夠說明水的化學式為“H2O”的實驗現象是____.


五、探究質量守恒定律
例5 某興趣小組為驗證質量守恒定律,做了鎂條在空氣中燃燒的實驗.

(1)請寫出鎂條與氧氣反應的化學方程式____.
(2)小明發現燃燒產物的質量大于反應物鎂條的質量,認為這個反應不遵循質量守恒定律.我____(“同意”或“不同意”)小明的觀點,因為____.
(3)小紅按圖9所示裝置改進實驗,驗證了質量守恒定律,卻發現產物中還有少量黃色固體.
【提出問題】黃色固體是什么呢?
【查閱資料】①氧化鎂為白色固體;②鎂能與氮氣劇烈反應生成黃色的氮化鎂(Mg3N2)固體;③氮化鎂可與水劇烈反應產生氨,該氣體能使濕潤的紅色石蕊試紙變藍.
【做出猜想】黃色固體是Mg3N2
【實驗探究】請設計實驗,驗證猜想

實驗操作實驗現象及結論
【反思與交流】空氣中N2的含量計遠大于O2的含量,而鎂條在空氣中燃燒生成的MgO卻遠多于Mg3N2,為什么呢?請給出合理的解釋____.
解析(1)鎂在氧氣中燃燒生成白色固體氧化鎂(MgO).(2)任何化學反應都遵守質量守恒定律,由于鎂條燃燒時空氣中有氣體參加了反應,從而導致燃燒產物的質量大于反應物鎂條的質量.(3)由于氮化鎂(Mg3N2)可與水劇烈反應產生氨氣,氨氣能使濕潤的紅色石蕊試紙變藍.因此若要驗證鎂條在空氣中燃燒的產物中有少量黃色固體Mg3N2,可以取燃燒的產物于試管中,加入少量的水,再將濕潤的紅色石蕊試紙放在試管口,若產生使濕潤的紅色石蕊試紙變藍的氣體,說明燃燒產物中含有黃色固體Mg3N2;雖然空氣中N2的含量遠大于O2的含量,但是氧氣的化學性質比氮氣的活潑,所以鎂條在空氣中燃燒生成的氧化鎂遠多于氮化鎂.


實驗操作實驗現象及結論取燃燒后的產物于試管中,加少量水,再將濕潤的紅色石蕊試紙放在試管口,觀察現象若產生使濕潤的紅色石蕊試紙變藍的氣體,說明燃燒產物中含有Mg3N2
O2比N2活潑(其他合理答案均可)
六、氣體的制取及性質
例6 根據圖10所列實驗裝置,按要求回答下列問題:

圖10
(1)儀器a的名稱:____.
(2)實驗室用高錳酸鉀制取氧氣,反應的化學方程式為____,應選用的發生和收集裝置是____.
(3)小明同學用F裝置驗證二氧化碳的性質,當通入二氧化碳一段時間后,試管①中產生的現象是____,試管②中澄清石灰水變渾濁,反應的化學方程式為是____,G中觀察到蠟燭由低到高依次熄滅,說明二氧化碳具有的性質是____,若兩支蠟燭幾乎同時熄滅,可能的原因是____(答一點即可).
解析(1)集氣瓶是收集氣體的儀器;(2)如果用高錳酸鉀制氧氣就需要加熱,高錳酸鉀受熱分解生成錳酸鉀和二氧化錳和氧氣;氧氣的密度比空氣的密度大,不易溶于水,因此能用向上排空氣法和排水法收集;(3)F裝置中,試管①中產生的現象是紫色石蕊試液變紅,因為二氧化碳和水反應生成碳酸,碳酸能使紫色石蕊試液;二氧化碳與氫氧化鈣反應生成碳酸鈣白色沉淀和水;G中觀察到蠟燭由低到高依次熄滅,說明二氧化碳具有的性質是不燃燒也不支持燃燒且密度比空氣大;若兩支蠟燭幾乎同時熄滅,可能的原因是傾倒二氧化碳的速度太快或集氣瓶口開的太大等.
七、探究可燃物燃燒的條件
例7 (2015·臨沂)控制變量法是學習化學常用的方法.下面是探究燃燒條件的實驗,請你根據實驗圖11和資料信息回答有關問題.

圖11
資料信息:白磷和紅磷的著火點分別是40℃、240℃.
(1)銅片上的紅磷不燃燒,是因為____.(2)水中的白磷不燃燒,是因為____.(3)如果要讓水中的白磷在水下燃燒,應采取的措施是____.(4)通過以上實驗事實證明,燃燒必須同時具備下列條件:①可燃物;②氧氣(或空氣);③____.
解析(1)銅片上的紅磷不燃燒是因為溫度沒有達到紅磷的著火點;(2)水中的白磷不燃燒,是因為白磷沒有與氧氣接觸;(3)讓水中的白磷在水下燃燒,需要與氧氣接觸,故需要通入氧氣;(4)燃燒必須同時具備可燃物、可燃物與氧氣接觸、溫度達到著火點三個條件,缺一不可.
答案(1)溫度沒有達到紅磷的著火點 (2)沒有與氧氣接觸 (3)用導管對準水中的白磷通入氧氣(或空氣) (4)達到燃燒所需的最低溫度(著火點)

