急性髓系白血病患者外周血粒細胞、單核細胞膜GPI錨鏈和紅細胞表面CD59表達水平的研究*
范臻佳,金麗蘭,史 冊,劉 禹,蔡 剛
(上海交通大學醫學院附屬瑞金醫院檢驗科,上海 200025)
急性髓系白血病(acute myelocytic leukemia,AML)是克隆性造血干細胞疾病的一類,是髓系造血干/祖細胞的惡性疾病。以骨髓和外周血中原始和幼稚的髓性細胞增生為主要特征,臨床表現為貧血、出血、感染、發熱、臟器浸潤和代謝異常等,發病早期部分癥狀與陣發性睡眠性血紅蛋白尿(paroxysmal nocturnal hemoglobinuria,PNH)的部分臨床表現較為相似,特別是血管內溶血的相關表現[1]。這可能與AML患者外周和骨髓異常血細胞缺乏相關膜錨鏈蛋白有關。眾所周知,PNH是以膜錨鏈蛋白CD55和CD59缺乏致血管內溶血為主要病理特征,其本質是造血干細胞的GPI錨鏈合成障礙,導致包括CD55和CD59在內的多種血細胞膜錨鏈蛋白缺乏。目前已有一些證據表明AML患者外周異常血細胞也存在CD59等相關膜錨鏈蛋白缺乏,但其是否也存在GPI鏈的缺乏,以及其表現是否與典型PNH相同,尚不清楚。嗜水氣單胞菌溶素變異體(fluorescent-labeled aerophilic plasminogen,FLAER)是一種可與GPI錨鏈特異性結合的物質[2],目前,通過流式細胞術采用熒光標記的FLAER及膜錨鏈蛋白的單克隆抗體檢測GPI錨鏈及其錨定蛋白的缺乏是國際臨床流式細胞協會(international clinical cytometry society,ICCS)和歐洲臨床細胞分析學會(european society for clinical cell analysis,ESSCA)推薦的對患者粒細胞和單核細胞進行PNH克隆診斷的確診方法[3]。ICCS/ESSCA也同時推薦檢測紅細胞表面CD59的表達水平,判斷其是否存在CD59部分缺陷(II型細胞)或完全缺陷(III型細胞)的細胞[4,5]。通過有核細胞與紅細胞共同確定患者是否存在PNH克隆。
基于ICCS/ESSCA推薦的PNH檢測方法,我們擬在本研究中,采用流式細胞術對不同類型的AML患者進行外周血紅細胞CD59和有核細胞FLAER檢測,同時以確診的PNH患者作為對照,分析AML患者是否存在FLAER陰性的類PNH克隆及其特點。
1 材料和方法
1.1 研究對象 收集瑞金醫院2014年~2018年門診和住院患者57例,確診為PNH患者21例(其中伴有再生障礙性貧血的5例,男性8例,女性13例);AML患者36例(其中M2 3例,M3 21例,M4 5例,M5 7例;男性17例,女性19例)。
1.2 儀器和試劑 美國BD公司CantoII流式細胞儀,anti-CD59- FITC,FLAER-ALEXA488,anti-CD33- APC,anti-CD14- Pacific Blue,anti-CD24- PE,anti-CD45-PC5等熒光標記流式抗體及溶血素等均購自BD Pharmingen。
1.3 方法
1.3.1 外周血粒細胞和單核細胞FLAER檢測 根據ICCS/ESSCA指南,基于CantoII平臺,采用五色流式細胞術檢測。避光孵育30 min后加入溶血素裂紅,完全溶血后加入PBS洗滌細胞,并上機檢測,從而得到目的細胞亞群的百分數。正常參考范圍:CD24-FLAER-細胞/CD45+粒細胞<1%,CD14-FLAER-細胞/CD33+單核細胞<1%。
1.3.2 外周血紅細胞CD59檢測:根據ICCS/ESSCA指南,基于CantoII平臺,采用單色流式細胞術檢測。將熒光素標記的各種單克隆抗體加入到洗滌紅細胞中,與細胞膜上相應的抗原結合,孵育后再次洗滌、重懸等步驟后,在流式細胞儀上進行分析,從而得到表達缺陷細胞的百分數。正常參考范圍:II型細胞和III型細胞比率均<1%。
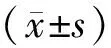
2 結果
2.1 紅細胞CD59的表達水平 見圖1。AML組患者未檢出明顯的CD59表達缺陷的細胞,PNH組患者進行檢測后CD59抗原表達出現不同程度缺失,AML組患者檢測結果與PNH組相比,各型紅細胞比例差異均有統計學意義(t=3.41~6.43,均P<0.001)。

表1 AML組和PNH組外周血細胞抗原缺失率

圖1 健康對照、AML及PNH患者紅細胞CD59流式比較
2.2 粒系和單核系 見圖2。AML組患者和PNH組患者進行檢測后粒細胞和單核細胞均出現了GPI雙陰性的缺失細胞。但AML組患者的缺失細胞的克隆比例與PNH組患者相比,差異具有統計學意義,結果見表1。同時,可在AML患者中檢出不同數量的FLAER單陽性細胞,例如CD24-FLAER+的粒細胞和CD14-FLAER+單核細胞。

圖2 健康對照、AML及PNH患者粒細胞、單核細胞FLAER流式比較
3 討論
由于白血病細胞具有“異質性”和“非同步性”,常伴有抗原表達紊亂現象[6],并且其分化發育各個階段出現了不規律和調節紊亂,從而導致其膜抗原的表達異常[7]。既往已有研究發現,部分AML患者常伴有粒、單細胞的CD55或CD59缺陷,可能是導致這些患者并發血管內溶血的重要原因。眾所周知,CD55和CD59是保護細胞免受異常補體激活殺傷的重要膜錨鏈蛋白[8]。AML患者這些CD55或CD59缺陷的細胞究竟是僅為膜錨鏈蛋白缺乏,還是也涉及糖基磷脂酰肌醇(glycosyl-phosphatidyl inositol,GPI)錨鏈的合成障礙,尚不完全清楚。由于GPI錨鏈合成障礙會導致包括CD55和CD59在內的多種膜錨鏈蛋白缺乏,可能對AML患者血細胞的多種生物學功能產生影響。
在本研究中,我們的結果清晰的顯示,盡管AML患者粒細胞、單核細胞檢出的典型PNH克隆明顯小于PNH患者,但勿庸質疑的是多種類型的AML病患都存在GPI膜錨鏈的合成障礙和/或錨鏈蛋白的缺失,不僅有典型的粒細胞、單核細胞PNH克隆出現,同時還存在不同數量的FLAER單陽性細胞,表明這些惡性干、祖細胞的相關抗原表達或蛋白合成明顯紊亂,這也與既往文獻報道AML患者粒細胞表面存在CD59表達異常的發現相一致[9]。值得注意的是,部分M3和M5患者均不僅有惡性細胞系的GPI錨鏈合成障礙,而且也存在其它有核細胞系的GPI錨鏈合成障礙,提示這部分患者骨髓的異常改變可能發生在造血細胞更原始的階段。但是,我們在納入的AML患者中未檢出明顯異常的CD59缺陷克隆,一方面間接提示了AML患者粒細胞、單核細胞的惡性改變未在DNA水平明顯影響紅系細胞的發展;另一方面,這也有助于鑒別診斷AML患者是否伴有PNH,因為典型的PNH患者都有明顯的CD59缺陷的II型和/或III型細胞,表現為紅系及有核細胞系的多系造血細胞GPI錨鏈合成障礙[10]。由于本研究中未納入紅白血病患者,因此未能對該類型患者的紅系及有核細胞系進行評估,觀察這類病人是否會同時出現紅系和粒細胞、單核細胞系的GPI錨鏈合成障礙,這需要在下次研究中予以澄清。
通過本項研究,我們了解到粒細胞、單核細胞等有核細胞系GPI錨鏈合成障礙在AML患者中是一種常見現象,盡管檢測到的錨鏈缺陷克隆小于典型PNH患者。由于GPI錨鏈具有重要的生物學意義,因此,其缺陷對AML等疾病的病理生理有何影響值得深入地進行研究;同時也表明,對AML患者檢測粒細胞、單核細胞的GPI錨鏈水平對于判斷病情及評估預后可能具有重要的臨床意義。

