糖耐量受損患者血清eNOS mRNA和TRB3 mRNA表達與疾病干預的相關性研究*
樊 萍,茍小林,李 娜
(咸陽市第一人民醫院a.檢驗科;b.內分泌科,陜西咸陽 712000)
糖耐量受損(IGT)是2型糖尿病的前期階段,并具有血糖溫和升高和胰島素抵抗(IR)的特征。IGT患者已被證實存在較高的2型糖尿病風險,過高的IR,血糖以及糖化血紅蛋白水平可以通過運動鍛煉和飲食調節來降低[1]。目前的研究顯示,人類循環內皮一氧化氮合酶(eNOS)和同源蛋白3(TRB3)的表達可能與IR及糖尿病的發生發展有關[2-3]。本研究采用RT-PCR技術分析IGT患者血清eNOSmRNA和TRB3mRNA的表達,旨在評價生活方式干預治療IGT疾病的效果,并為2型糖尿病的有效預防和控制提供理論依據。
1 材料與方法
1.1 研究對象 選擇2016年3月~2018年3月在咸陽市第一人民醫院就醫的58例IGT患者作為研究對象,均為初診且未接受治療。IGT患者均選擇運動鍛煉、飲食調節等生活方式干預治療。所有患者均符合1999年世界衛生組織(WHO)的IGT診斷標準:空腹血糖<7.0 mmol/L,負荷后2 h血糖7.8~11.1 mmol/L。男性35例,女性23例,年齡51.20±12.37歲。另選取53例同期體檢健康者納入對照組,其中男性32例,女性21例,年齡50.30±12.97歲,均排除糖尿病家族史。實驗組和對照組研究對象的性別和年齡比較差異均無統計學意義(P>0.05)。本研究已獲得咸陽市第一人民醫院醫學倫理委員會批準,并得到所有研究對象的知情同意。
1.2 試劑和儀器 血清葡萄糖和胰島素水平檢測采用羅氏MODULARP800全自動生化分析儀。糖化血紅蛋白(HbA1c)采用高效液相色譜儀檢測。RNA提取試劑盒(上海久盛醫療用品有限公司)。反轉錄試劑盒(日本Takara公司),實時熒光定量試劑盒(美國Promega公司),化學發光凝膠成像系統(ChemiDocTM XRS)(美國Bioad公司),PCR擴增儀(美國ABI公司)。
1.3 研究方法
1.3.1 方法:IGT患者于干預治療前及干預治療3個月后分別采集靜脈血液,HbA1c檢測采用全血,其余項目均采用血清進行分析。所有研究對象均接受葡萄糖耐量試驗和胰島素釋放試驗,胰島素抵抗指數(HOMA-IR)通過空腹血糖(FPG)及空腹胰島素(FINS)計算得到,即HOMA-IR=FINS×FPG/22.5[4]。生活方式干預措施按照糖尿病飲食標準制定,每日飲食量包括主量約6兩加少量脂肪并同時進行體育鍛煉,觀察時間為3個月。目標是減輕體重約10%。為了使患者體育鍛煉目標能實現,本研究制訂了最基本且易實現的運動方式,即飯后快步行走0.5~1 h,行走約1~2千米路程,體質較好的患者在此基礎上可適當增加運動量或選擇自己喜好的其他鍛煉方式,活動量控制以患者在運動中自測心率在100次/min以內為宜,期間經常督促、鼓勵患者堅持以達到目標。
1.3.2 PCR擴增:采用Trizol法提取血清RNA。引物設計采用Pfimer5軟件,TRB3mRNA的引物序列為:上游5’-CTCTGGTCCTGCGTGATCTCAA-3’,下游5’-GTATGAGGCCCG7rGAGCTC AGTA-3’,擴增產物長度為115bp。eNOSmRNA的上游引物序列為5’-CGAGAGATGTAGTGTGCG-3’,下游為5’-AAGCAGGGCCATGTGCCA-3’,擴增產物長度為255 bp。采用β-actin作為內參照,其引物序列為:上游5’-GCCATCTTGACTGGAT-3’,下游5’-ACCTGGAGCGCGGACAACTA-3’,擴增產物長度為570 bp。cDNA測定采用熒光定量PCR儀。反應條件:95℃20 min,95℃30 s,58℃30 s,72℃45 s,以上反應進行30個循環,然后72℃5 min于4℃保存。將擴增產物進行凝膠電泳,并通過圖像處理系統分析得到mRNA的吸光度。以β‐actin的吸光度為參考,求出eNOSmRNA和TRB3mRNA吸光度的變化值(△Ct)。mRNA表達量通過2-△Ct求得。
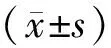
2 結果
2.1 各組糖尿病影響因素比較 見表1。治療前組的體重指數(BMI),空腹血糖(FPG),空腹胰島素(FINs),HbA1c及HOMA-IR分別與治療后組比較顯著增高,治療后組的各項指標與對照組比較顯著增高,差異均有統計學意義(P<0.05或0.01)。

表1 各組糖尿病影響因素比較
2.2 各組血清eNOSmRNA和TRB3mRNA表達比較 見表2和圖1,圖2。TRB3mRNA在治療前組的表達顯著高于治療后組,治療后組的表達與對照組比較顯著增高(F=93.27,P<0.01);而eNOSmRNA在治療前組的表達顯著低于治療后組,治療后組的表達與對照組比較顯著降低(F=89.65,P<0.01),差異均有統計學意義。

表2 各組血清eNOSmRNA和TRB3mRNA的表達比較

M.Marker(DL2000);a.對照組;b.治療后組;c.治療前組。 M.Marker(DL2000);a.對照組;b.治療前組;c.治療后組。
圖1 eNOSmRNA擴增產物電泳圖圖2 TRB3mRNA擴增產物電泳圖
2.3 相關分析 在治療前組和治療后組中,血清eNOSmRNA和TRB3mRNA的表達具有負相關性(r=-0.867,-0.826,均P<0.01)。在治療前組和治療后組中eNOSmRNA的表達分別與FPG,FINs,HbA1c水平及HOMA-IR有顯著負相關性[(r=-0.779,-0.739,-0.727,-0.755,均P<0.01),(r=-0.726,-0.689,-0.667, -0.696,均P<0.01)],而TRB3mRNA與各指標則具有正相關性[(r=0.823, 0.769, 0.753, 0.797,均P<0.01),(r=0.753, 0.697, 0.685,0.726,均P<0.01)]。
2.4 利用ROC曲線評價兩標志物的價值 以治療前組和治療后組eNOSmRNA和TRB3mRNA的表達為因變量分析顯示,兩標志物的AUC分別為[0.858(95%CI:0.756~0.960,P<0.01),0.862(95%CI:0.753~0.970,P<0.01)]。eNOSmRNA和TRB3mRNA在最佳臨界值處評價IGT患者治療效果的敏感度和特異度分別為80.3%和87.5%;81.3%和90.2%。提示血清eNOSmRNA和TRB3mRNA對評價生活方式干預IGT的療效監測有診斷意義。見圖3。

圖3 eNOSmRNA和TRB3mRNA的ROC曲線
3 討論
胰島素抵抗被定義為外周組織(骨骼肌和脂肪)對胰島素效應的敏感性降低。最近的研究證明胰島素抵抗可能參與糖代謝異常的發生和發展過程。在糖代謝異常的早期階段,胰島素抵抗促進胰島素的分泌[5]。這種效應導致胰島β細胞發生慢性過載并呈現過度增殖,長期的作用會引起β細胞功能減退,導致胰島素的分泌不足進而出現血糖水平升高。這種狀況使IGT或糖尿病的發生最終變為顯性[5]。Lutz等[6]認為IGT患者伴隨著溫和的血漿葡萄糖水平增加,反映了患者糖代謝呈現受損的狀態。IGT患者糖代謝異常被認為可能是患者長期暴露于胰島素抵抗而導致的結果[7]。本研究結果顯示IGT患者的BMI,FPG,FINs,HbA1c及HOMA-IR與對照組比較顯著增高(P<0.05或0.01)。這些結果印證了上述的IGT患者糖代謝的異常狀態。一氧化氮是由一氧化氮合酶(NOS)產生的氣體。NOS包括神經型(nNOS)、內皮型(eNOS)和誘導型(iNOS),這三種亞型在骨骼肌組織均有表達,eNOS主要分布在血管內皮細胞中。研究認為NO對骨骼肌胰島素的敏感度以及葡萄糖的攝取利用具有重要的調節作用[8]。Feng等[9]分析108例IGT患者的研究結果發現胰島素抵抗主要起始于血管內皮。他們認為eNOS功能障礙引起NO合成減少導致微循環血流量減少,從而降低胰島素對敏感組織的輸送。Hasegawa等[10]研究發現eNOS -//-小鼠(eNOS基因敲除小鼠)組織中胰島素介導的葡萄糖攝取已被抑制。進一步的研究顯示eNOS功能的恢復可以降低胰島素抵抗,增加組織對葡萄糖的利用。這些過程的作用機制可能與PI3K/AKT信號通路有關,該通路的抑制可能促進胰島素的發生[3],降低循環eNOS活性,進而影響NO的濃度,抑制胰島素介導的血管舒張,降低循環血流量,最終導致骨骼肌和脂肪組織對葡萄糖的攝取減少以及血糖濃度升高[11]。另外的研究通過分析糖尿病大鼠模型的結果顯示有氧運動與抗阻力運動能刺激PI3K通路的磷酸化導致NO和eNOS濃度的增加,改善血管內皮功能從而促進糖尿病大鼠血管的舒張功能。這些過程最終導致大鼠的血糖和血脂水平降低以及胰島素抵抗改善[12]。提示血管內皮功能的改善可能增加eNOS的活性,增強組織對胰島素的敏感度,改善胰島素抵抗的效應[13]。本研究結果顯示IGT患者生活方式干預前循環eNOSmRNA表達顯著低于干預后組(P<0.01),推測IGT患者可能存在血管內皮功能的損傷,進而影響組織對胰島素的敏感度,并且促進胰島素抵抗的發生。進一步地研究顯示治療后組eNOSmRNA表達仍然低于對照組,提示IGT患者血管內皮的損傷未能完全恢復。盡管如此,治療前后循環eNOSmRNA的差異表達顯示生活方式干預可以有效地改善胰島素抵抗,修復受損的糖耐量。
Tribbles蛋白是最早在果蠅體內被發現的哺乳動物同源蛋白,其被發現可能參與PKB/AKT信號通路中的AKT磷酸化激活過程。TRB3作為Tribbles蛋白中的一員,通過直接結合AKT,阻礙AKTthr308,ser473位點的磷酸化,干擾PI3K/AKT信號傳導通路,引發葡萄糖轉運的減弱,增強IR在胰島素靶器官的發生[4]。曹梅等[14]通過高糖高脂飲食誘導大鼠建立胰島素抵抗模型。他們的研究發現模型組中TRB3mRNA以及其蛋白質表達顯著增加,而治療后TRB3mRNA表達則呈現下調。提示TRB3的上調可能影響骨骼肌和脂肪組織對葡萄糖的攝取和利用。研究發現TRB3在應激條件下的表達呈現上調并且介導多個糖尿病及其并發癥相關的生物學過程。進一步的研究顯示禁食狀態下肝細胞中的TRB3表達增加抑制蛋白激酶B(參與PKB/AKT通路)ser473及thr308位點的磷酸化,損傷糖耐量導致血糖升高[3]。董靜等[15]認為骨骼肌PKB/AKT磷酸化水平的增強可以下調TRB3的表達,這些過程可通過長期耐力運動來實現。耐力運動被證實可能增加肌細胞對葡萄糖的攝取和利用,降低血糖濃度進而改善胰島素抵抗。本研究通過對58例IGT患者的分析顯示血清TRB3mRNA表達在治療前明顯增高(P<0.01),而治療后TRB3mRNA表達顯著下調,從而印證了生活方式干預治療IGT的有效性。進一步顯示治療后該標志物表達顯著高于對照組,提示生活方式干預治療IGT可能是一個持續的漫長過程。生活方式干預治療被認為是糖尿病最基礎的治療方法。糖尿病患者的高血糖和HbA1c水平可通過長期耐力運動和合理飲食得到有效控制,這些干預措施能減緩糖尿病相關慢性并發癥的發生和發展[16-17]。本研究結果顯示治療前后eNOSmRNA和TRB3mRNA的表達具有負相關性,且兩標志物的表達分別與FPG,FINs,HbA1c水平及HOMA-IR也具有顯著相關性(P<0.01)。推測兩標志物與IGT的發生和發展密切相關,其差異性的表達可以反映IGT治療后患者糖代謝的改善狀況。ROC曲線的分析結果顯示,血清eNOSmRNA和TRB3mRNA對IGT患者生活方式干預治療的療效監測有診斷意義,并顯示出良好的敏感度和特異度。綜上所述,血清eNOSmRNA和TRB3mRNA的檢測可應用于評價生活方式干預治療IGT的效果,并可能為IGT及2型糖尿病的治療提供有效的基因學依據。

